外泌体对HepG2细胞增殖、凋亡的影响
程永芳,段慧明(广西中医药大学科学实验中心,广西中医基础研究重点实验室,南宁 530200)
肝癌(hepatocellular carcinoma,HCC)是临床上较为常见的消化系统恶性肿瘤,发病率和病死率高。美国癌症协会发布的癌症统计分析报告显示,全球HCC发病率和病死率在恶性肿瘤中分别排第6位和第3位,主要分布在亚洲和非洲等[1-2]。由于肝癌早期不易被察觉,其转移快且隐蔽,大多数肝癌患者确诊时已到中晚期,并且我国肝癌患者大多在确诊时还伴随有严重的肝硬化,目前的多种治疗手段包括手术放化疗、靶向治疗、免疫治疗甚至联合治疗均未能改变其预后差、5年生存率低等特征。外泌体研究的兴起,深入研究外泌体在肝癌中的作用机制,将为肝癌的早期诊断、治疗和预后的评估开辟新的途径。
外泌体是一种几乎所有类型细胞(包括肿瘤细胞)都会分泌的,直径为30~100 nm的小囊泡[3]。它们富含来自亲代细胞的选择性蛋白质和核酸,具有标志蛋白(CD81、CD9、CD63、TSG101、ALIX等)[4],可传递关键成分,具有调节细胞间通信的潜力,并且是通过“运输”分子来调节细胞过程的关键信使。外泌体可以传递蛋白质、可溶性因子,最重要的是可以传递调节受体细胞蛋白表达的RNA和microRNAs(miRNAs)[5]。这对于机体的正常稳态和各种疾病包括肿瘤的发病机制都是非常重要的[6]。肿瘤来源的外泌体可能有助于肿瘤微环境的募集和重编程以形成促致瘤的土壤。肿瘤来源的外泌体可改变局部和全身微环境,通过将其内容物(如EGFRVIII、KRAS、lncRNAs或miRNAs等)转移到其他肿瘤细胞以诱导上皮间充质转变,迁移和侵袭或受体细胞耐药,从而促进肿瘤进展和转移并可通过TGF-β1或其他配体的分泌抑制肿瘤细胞凋亡[7-10],本研究通过对HepG2肝癌细胞系外泌体的分离及分析,揭示外泌体在肝癌进展中的作用。
1 材料
1.1 细胞
HepG2细胞株,购自中国科学院上海细胞库。
1.2 试药
DMEM高糖培养基(凯基生物);胎牛血清(四季青);兔CD9、TSG101、ALIX单克隆抗体及HRP-山羊抗兔二抗(Servicebio);胰蛋白酶(Solarbio);PBS缓冲液(凯基生物);CCK-8试剂盒(Beyotime);Caspase3/7细胞凋亡活性检测试剂盒“绿色荧光”(上海生工);BCA蛋白定量试剂盒(南京建成)。
1.3 仪器
MCO-18AIC二氧化碳培养箱(日本PHCbi公司);CP100NX超速冷冻离心机、HT7800/HT7700透射电子显微镜(日本Hitachi公司);Multiskan Sky全波长酶标仪(美国Thermo Fisher公司);Infinite M200Pro Nanoquant光吸收微孔板荧光检测仪(瑞士TECAN公司);DYCZ-24DN双垂直电泳仪、DYCZ-40D转印电泳仪(北京六一仪器厂)。
2 方法
2.1 细胞培养
将HepG2肝癌细胞置于DMEM高糖培养基(含10%胎牛血清)中。种板24 h后,换成含1%胎牛血清的DMEM高糖培养基[11],将细胞置于37℃、5%CO2饱和湿度的培养箱中进行培养。
2.2 外泌体提取
待细胞状态良好且生长至1×107~1×108,收集细胞培养上清液用以提取外泌体。4℃,300×g离心10 min,去除细胞污染。吸取上清液于2000×g离心10 min,去除死细胞。吸取上清液于10 000×g离心30 min,去除细胞碎片,吸取上清液于100 000×g超速离心90 min,去除上清液,磷酸盐缓冲液(PBS)洗涤后于100 000×g超速离心90 min,沉淀即为外泌体[12]。PBS重悬,BCA法测定蛋白浓度,-80℃冻存备用。
2.3 电镜观察
用移液枪吸取外泌体20 μL滴在碳膜铜网放置5 min,用滤纸吸去多余液体。将2% 磷钨酸滴在碳膜铜网上放置2 min,用滤纸吸去多余液体,室温干燥。透射电子显微镜下观察,采集图像分析。
2.4 外泌体定性检测
取出冻存的外泌体,室温下冰上放置融化3 min,取出10 μL分离出的外泌体,加入5 μL含有蛋白酶抑制剂的RIPA细胞裂解液,振荡混匀,室温放置10 min,4℃下20 000×g离心20 min。上清液为蛋白裂解液,取10 μL裂解液加入5×loading buffer,95℃加热5 min,冷却,经12%SDS-PAGE 150 V恒压跑胶1.5 h,15 V恒压转膜,于室温下脱色摇床上用5%的脱脂牛奶(0.5%TBST配)封闭1 h,加入1∶1000稀释兔抗人CD9、TSG101、ALIX单克隆抗体,4℃摇床孵育过夜,TBST洗膜3次,每次5 min,将二抗用TBST稀释3000倍,室温下孵育30 min后,用TBST在室温下脱色摇床上洗3次,每次5 min,化学发光显色,凝胶图像分析。
2.5 肝癌细胞增殖检测(CCK-8法)
收集处于对数生长期细胞,接种至96孔板中(2500细胞/孔),种板24 h后,换成含1%胎牛血清的DMEM高糖培养基,加入外泌体(300 μg·mL-1)10 μL共孵育作为外泌体组,用等体积的PBS处理的细胞作为对照组,没有细胞的小孔加入等体积PBS作空白组。每组设置3个复孔,细胞培养24~72 h后,每孔加10 μL CCK-8溶液,再孵育1 h,450 nm处测定吸光度值。
2.6 荧光法检测外泌体对细胞凋亡的影响
收集处于对数生长期细胞,接种至96孔板中(2250细胞/孔),种板24 h后,换成含1%胎牛血清的DMEM高糖培养基,加入外泌体(206 μg·mL-1)20 μL共孵育48 h作为外泌体组。对照组未作共培养处理,用Caspase3/7细胞凋亡活性检测试剂盒检测细胞凋亡情况(酶标仪检测Ex/Em=490/525 nm处的荧光强度)。
2.7 统计学分析
所得数据用均数±标准差(±s)表示,用Excel对数据进行统计和分析作图,两组间比较采用t检验,以P<0.05为差异有统计学意义。
3 结果
3.1 外泌体的形态观察
用透射电子显微镜观察外泌体的形态,一般为圆形或椭圆形膜性囊泡,直径30~100 nm,见图1。
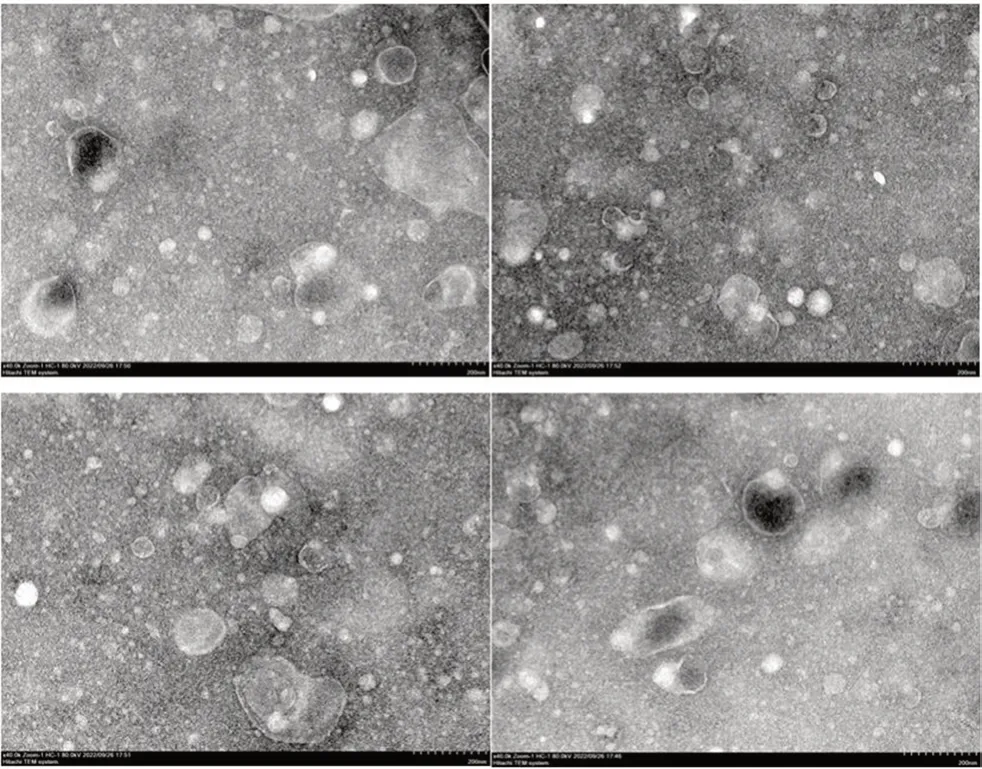
图1 透射电子显微镜下观察到的外泌体形态(×40 000)Fig 1 Morphology of exosomes under transmission electron microscope(×40 000)
3.2 外泌体标志物的检测
对HepG2细胞分泌的外泌体作Western blot定性分析,可见外泌体稳定表达CD9、TSG101、ALIX等蛋白标志物,见图2。
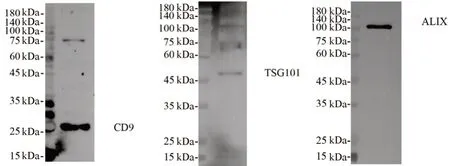
图2 外泌体标志物的表达Fig 2 Expression of exosomal markers
3.3 外泌体对肿瘤细胞增殖的影响
以CCK-8法检测加入外泌体处理后的肿瘤细胞的增殖趋势,可发现外泌体具有促进肿瘤细胞增殖的能力,但72 h相比48 h细胞吸光度值有所减少,见表1。
表1 CCK-8法检测细胞不同时间点吸光度值( ±s,n=3)Tab 1 Absorbance of cells at different time measured by CCK-8 method ( ±s,n=3)
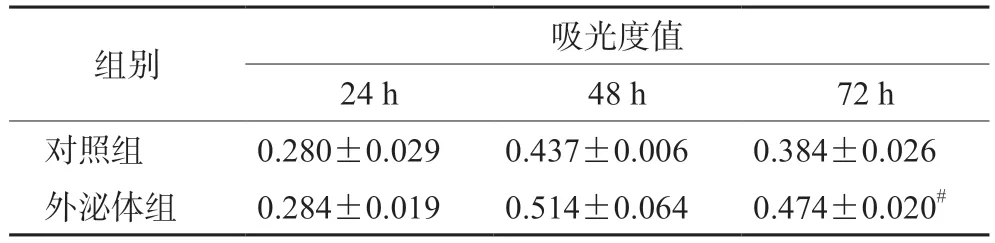
表1 CCK-8法检测细胞不同时间点吸光度值( ±s,n=3)Tab 1 Absorbance of cells at different time measured by CCK-8 method ( ±s,n=3)
注:与对照组比较,#P<0.01。Note:Compared with the control group,#P<0.01.
组别吸光度值24 h48 h72 h对照组0.280±0.0290.437±0.0060.384±0.026外泌体组0.284±0.0190.514±0.0640.474±0.020#
3.4 外泌体对肿瘤细胞凋亡的影响
采用绿色荧光法(Caspase3/7细胞凋亡活性检测试剂盒)检测细胞凋亡的水平,可发现相比于对照组,外泌体具有抑制肿瘤细胞凋亡的作用,但不显著,见图3。
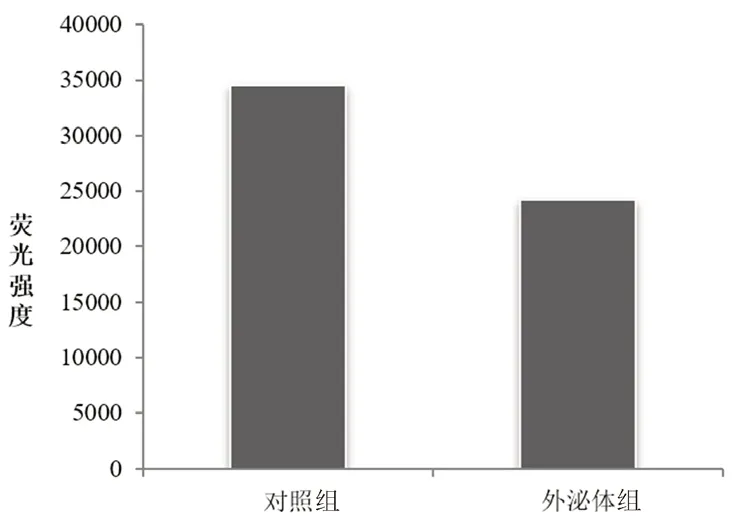
图3 外泌体对HepG2细胞凋亡的影响(n=3)Fig 3 Effects of exosomes on apoptosis of HepG2 cells(n=3)
4 讨论
外泌体是近些年国内外研究的热点,尤其在肿瘤方面应用广泛,越来越多的证据表明,来源于肿瘤细胞的外泌体在癌症中起着关键作用[13],本研究主要探索肝癌细胞外泌体对肝癌细胞增殖和凋亡的影响。
本研究采用多步超速离心法从肝癌HepG2细胞的培养液上清液中分离出外泌体(因考虑最大限度利用外泌体,同时为了防止其降解,外泌体是分批次提取,每次实验提取一次)并通过透射电子显微镜观察外泌体形态,利用Western blot检测其标志物的表达。采用CCK-8法、绿色荧光法分别检测外泌体对HepG2细胞增殖和凋亡的影响。
多步超速离心分离外泌体是最常见的外泌体提取方法,100 000×g超速离心,时间在70 min以上是多步离心的关键步骤。最后PBS溶解后的外泌体可以直接使用不影响后续实验,而不需要在使用前过滤除菌,过滤很容易使外泌体浓度降低,因为外泌体直径与滤膜孔径接近,不易滤过。
电镜观察到的外泌体一般为圆形或椭圆形膜性囊泡状结构,直径在200 nm以下,也有直径在200 nm以上的其他微泡和凋亡小体等,外泌体具有标志性蛋白CD9、TSG101、ALIX等。外泌体的电镜观察证明提取到的囊泡从形态和大小上符合外泌体的描述,但还不能完全证实就是外泌体,只是初步验证,而Western blot检测到外泌体的标志性蛋白则更进一步从结构成分上验证了外泌体的存在。
CCK-8法显示外泌体对HepG2细胞具有促增殖作用,24 h和48 h效果较弱且48 h细胞量要高于72 h,可能细胞在生长到72 h时营养下降,导致细胞量下降的作用可能逐渐超过增殖作用,原因可能是种板时采用的是含10%血清的高糖DMEM,而在外泌体处理前(即种板24 h后)将含10%血清的高糖DMEM换成了含1%血清的高糖DMEM(血清浓度高会影响增殖),但浓度低了又会导致后续营养不足,也可能是种板时三块板上的细胞未处在同一个生长期导致,需要更好的优化生长条件并对培养基进一步摸索条件使其在进入第3日时还能保持很好的营养,为了有更好的效果同时还应进一步加大外泌体的提取浓度。
绿色荧光法检测用外泌体共培育的HepG2细胞的凋亡情况,结果显示外泌体有一定的抑制HepG2细胞凋亡的作用,但幅度不大,作用不显著,这可能和本批次提取的外泌体浓度(质量浓度为206 μg·mL-1)不高有关。
增殖和凋亡是外泌体功能的一体两面,能促进增殖就能抑制凋亡。促进增殖的作用强,必定抑制凋亡的作用也强,反之亦然,促增殖能力弱必定抑制凋亡能力也弱。而本研究促增殖能力要稍强于抑制凋亡能力,没有较好表现出两种作用强度的一致性,很可能是由于外泌体是分批次提取,导致浓度的差异,因此体外实验也应尽量接近体内这种作用的统一性,最好所有实验都采用一次提取的外泌体,这样能保证增殖和凋亡实验都是采用同一浓度的外泌体,但是这样也会导致一次收集的细胞工作量过大的问题,而且,外泌体长时间低温保存也会导致外泌体的降解,因此需要找到一个合理的浓度。
综上,本研究从肝癌细胞的培养液中提取到的外泌体(其浓度还应进一步提高),具有促进肝癌细胞增殖和抑制其凋亡的能力。

