饲料及饲料原料中沙门氏菌污染状况研究
孙玉林,谢 灿,赵雄艳,王 宇*
(1.昆明市技术合同认定登记站,云南 昆明 650021;2.官渡区水生动物监督管理站,云南 昆明 650206;3.官渡区动物疫病预防控制中心,云南 昆明 650206)
动物饲料是“从农场到餐桌”食品安全链的第一个环节,饲料被病原菌污染可导致人类食源性疾病。病原菌污染饲料的方式途径不一,饲料中的沙门氏菌主要有二个来源[1]:一是原料本身携带有沙门氏菌,二是外源性的。既可能来自于植物性原料如大豆和谷类作物的污染、动物源性饲料如鱼粉、骨粉、羽毛粉等污染、微生态制剂及酶制剂中病原菌污染及加工环境造成的交叉污染等,这些被病原菌污染的饲料进入生物体内后可通过其产品转移、传播,危害人类健康。沙门氏菌是一种严重威胁人类及动物生命健康的病原菌,被沙门氏菌污染的饲料往往是人和动物被感染的源头。从饲料生产、经营和使用环节抽取饲料及饲料原料进行沙门氏菌检测,以期摸清饲料中沙门氏菌的污染情况,为进一步加强和完善饲料微生物安全监测工作提供数据支持。
1 材料与方法
1.1 试验材料
1.1.1 样品来源及种类
饲料生产、经营和使用环节抽取配合饲料80批、动物性饲料原料35批包括鱼粉、肉骨粉、羽毛粉和血粉,植物性饲料原料56批、微生态制剂10批、酶制剂12批、饲料生产企业加工车间粉尘5批、微生态制剂生产原料9批,样品共计207批。
1.1.2 培养基和试剂
BPW缓冲蛋白胨水、氯化镁孔雀绿肉汤、XLT4琼脂、沙门氏菌显色培养基;细菌基因组DNA快速提取试剂盒、Taq PCR Master Mix;EB、琼脂糖、DNA Marker DL2000。
1.1.3 仪器
恒温摇床(Thermo)、恒温培养箱(德国Memmer)、台式高速冷冻离心机(Sigmas)、梯度PCR仪(SENSO)、电泳仪(GE)、凝胶电泳成像分析系统(Gei Doc XR)、微生物鉴定系统(美国Sensititre)。
1.1.4 引物
以沙门氏菌invA基因为基础,选择特异性引物,序列为F:5'-GTGAAATTATCGCC ACGTTCGGGCA A-3',R:5'-ATCGCACCGTCAA AGGAAXX-3'。
1.2 试验方法
1.2.1 增菌培养
无菌称取样品25 g,于225 mL已灭菌的BPW肉汤中,37 ℃培养16~18 h,再取1 mL BPW增菌液于9 mL已灭菌的氯化镁孔雀绿肉汤中进行选择性增菌16~18 h。
1.2.2 模板DNA提取
样品增菌液DNA的提取采用试剂盒提取,具体步骤为:
①加入150μL Buffer CS,用1 mL Tips吹打或者Vortex震荡充分悬浮细胞沉淀→②加入5μL Proteinase K和300 μL Buffer CL,Vortex 10 s或者剧烈摇晃20次混合均匀,置于70 ℃水浴10 min。样品为革兰氏阳性菌和真菌可选步骤12,000×g离心2 min,将离心上清倒入或者用移液器转入另一个干净的1.5 mL离心管→③加入230μL无水乙醇或者95%乙醇(此时可能会出现絮状凝集物,不影响实验效果),温和翻转离心管10次混合均匀,避免产生大量泡沫,简短离心(离心速度达到 3,000×g后立即停止)去除离心管盖上的液体→④将步骤A4中的溶液和絮状物一起倒入或者用移液器转入DNA吸附柱-C30(置于收集管中)中,室温放置1~2 min或者更长时间→⑤12,000×g离心1 min,弃收集管,将DNA吸附柱-C30放入另外一个干净的收集管中→⑥在DNA吸附柱-C30中加入500 μL Buffer WAG,室温放置1~2 min或者更长时间,12,000×g离心1 min,弃收集管,将DNA吸附柱-C30放入另外一个干净的收集管中→⑦在DNA吸附柱-C30中加入500 μL Buffer WB1,12,000×g离心1 min,弃废液,将DNA 吸附柱-C30放回收集管中→⑧重复步骤A8→⑨12,000×g 离心2 min→⑩将 DNA 吸附柱-B转入试剂盒携带的1.5 mL 离心管中,向硅胶膜的中央加40~200 μL TE或者去离子水(pH≥7),将1.5 mL离心管的盖子扣在DNA吸附柱上,做好标记,去除DNA吸附柱的盖子。室温放置1~2 min 或更长时间,12,000×g 离心1 min。
1.2.3 PCR检测方法
PCR反应采用50 μL体系,组成如下为Taq PCR Master Mix 25 μL,dd H2O 18 μL,P1、P2各1 μL,模板5 μL。PCR反应条件为95 ℃预变性5 min;95℃变性30 s,60 ℃退火30 s,72 ℃延伸40 s,35个循环;72 ℃保温5 min;4 ℃保存。每个试样重复2次,同时设置阴性对照、阳性对照和空白对照。
1.2.4 PCR产物的电泳检测
配制1.5%的琼脂糖溶液,每100 mL琼脂糖溶液中加入5μL溴化乙锭溶液,混匀融化,稍适冷却后制胶、电泳,电泳结束于凝胶成像系统成像。
1.2.5 细菌鉴定
将PCR检测为阳性的样品增菌液划线接种于XLT4平板,挑取典型菌落进行分离纯化,采用微生物鉴定系统进行鉴定。
1.2.6 检测结果判定
PCR检测结果为阳性,划线接种于XLT4琼脂获得典型沙门氏菌菌落,经微生物鉴定系统鉴定为沙门氏菌则判定为检出沙门氏菌。
2 结果与分析
2.1 样品检测结果电泳图(图1)

图1 饲料及饲料原料中沙门氏菌PCR检测电泳图
样品中沙门氏菌检测PCR产物电泳图,样品中在阳性对照对应位置扩增出的DNA条带,为疑似沙门氏菌阳性样品;未扩增出的DNA条带,为沙门氏菌阴性样品。可看到泳道14、15及20、21对应的样品均为疑似沙门氏菌阳性样品,其余为沙门氏菌阴性样品。
2.2 疑似阳性样品平板鉴定(表1、图2)
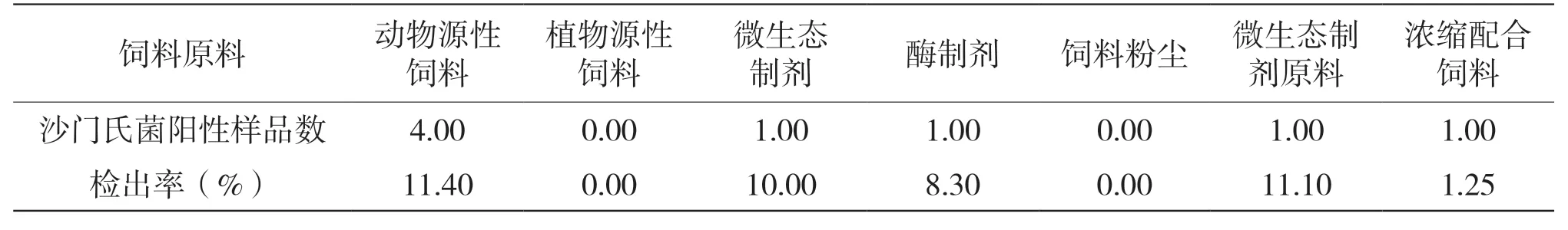
表1 饲料原料及产品中沙门氏菌检测结果表

图2 平板检测结果图
饲料中沙门氏菌的检出率为3.9%,其中检出率由高至低分别为动物性原料、微生态制剂生产原料、微生态制剂、酶制剂、浓缩配合饲料。
3 讨论与结论
3.1 讨 论
沙门氏菌病是公共卫生学上有重要意义的人畜共患病之一,由它引起的食物中毒在世界各国的细菌性食物中毒中常常位居前列,蛋、家畜和肉制品是主要的传播媒介。因沙门氏菌污染饿饲料而导致畜禽大量死亡,给养殖业造成了巨大的经济损失[2-3]。传统的沙门氏菌检测方法需进行非选择性和选择性增菌、生化及血清学鉴定很费力、耗时,需4~7 d才能完成,其他如抗体检测法,虽然快速,但其高假阳性不适合于常规检测[4]。此外,低水平的病原菌污染,饲料加工后导致沙门氏菌的“致伤”及饲料中其他成分的干扰等因素,使得沙门氏菌的检测受到一些限制。因此,急需一些快速、特异、敏感的检测方法,以及时发现致病菌,控制污染及其可能对人体健康产生的危害。随着分子生物学技术的不断发展和进步,针对沙门氏菌开展的快速检测方法得到迅速发展,已经在沙门氏菌的准确、快速检测和鉴定中起到重要作用[5]。本研究以沙门氏菌特异的invA 基因为目的片段,invA基因是与沙门氏菌侵袭作用相关的高度保守的一段序列[6-7],核苷酸序列在沙门氏菌属不同菌株具有较高的同源性,并且经BLAST检索未发现与其他物种有同源关系[8],以此建立检测沙门氏菌的PCR法,对抽检的饲料样品,用PCR法和传统的细菌分离法进行了检测,提高了检验效率及灵敏度[9]。
3.2 结 论
本次监测结果显示,动物源性饲料、饲料成品以及微生态制剂、酶制剂等都存在沙门氏菌污染的情况。动物源性饲料是畜禽饲料中沙门氏菌的主要污染源,其中以骨粉、鱼粉、血粉等蛋白质饲料最易被沙门氏菌污染。饲料企业缺乏对原料和成品沙门氏菌的监测措施,对进厂的原料和出厂的产品未进行严格的控制,这是饲料污染沙门氏菌的重要因素之一。微生态制剂及酶制剂近年来在畜禽养殖业中得到了广泛应用,但对于其质量及安全性评价手段较为缺乏,本次监测不仅从市场上抽取了酶制剂及微生态制剂成品,而且抽取了生产环节的各原料及辅料进行了沙门氏菌的监控,均检出沙门氏菌。微生态制剂及酶制剂因其活性的问题不能经高温处理,或使用高温干燥器或挤压蒸煮器等加热设备杀灭细菌,经常直接用于饮水或拌料中供动物饲用,因此其安全性对于畜禽养殖业有至关重要的作用。
3.3 建 议
为了杜绝饲料被沙门菌等致病菌污染,饲料企业应加强对原料和成品的管理,不同原料和成品存放地和运输车辆应进行专门分配和划分,并定期消毒,对高风险的饲料原料如骨粉、血粉、羽毛粉等应提高甄别等级并与其他原料保持隔离;采取措施控制加工设备的粉尘,对粉碎和输送设备进行对应划分,在特定区域内发生污染时,可迅速对相关设备进行消毒等。
饲料安全是一个日益严重的问题,就全球而言,安全的饲料是畜牧业防止微生物污染的第一关也是最重要的一关,随着饲料行业的发展,关于饲料安全的法律法规也将更加严格和健全。饲料生产企业应加强致病菌的来源、危害和预防以及相关检验技术的培训,以提高企业对致病性微生物防控的能力。

