糖尿病肾病患者触珠蛋白基因多态性及血清触珠蛋白浓度分析
李雨阳 朱晓蓉 刘 婧 郑晓敏 杨金奎,4* 杨芳远,4*
(1. 首都医科大学附属北京同仁医院内分泌科,北京 100730;2. 北京市海淀医院感染性疾病科,北京 100080;3. 清华大学附属垂杨柳医院内分泌科,北京 100022;4. 北京市糖尿病研究所,北京 100730)
糖尿病肾病(diabetes kidney disease,DKD)是糖尿病主要的微血管并发症之一,可导致终末期肾病,是糖尿病患者的重要死亡原因之一。在中国人群中,DKD已经比肾小球肾炎相关慢性肾病更为常见[1]。除糖尿病病程、血糖、血压等危险因素外,遗传因素在DKD发生发展过程中起着关键的作用。触珠蛋白(haptoglobin,Hp)是一种急性期反应蛋白,其抗氧化应激和促新生血管作用与DKD的发展息息相关[2]。人体的Hp有Hp1、Hp2 2种等位基因,组合形成Hp1-1、Hp2-1、Hp2-2 3种不同的基因型。Hp基因多态性于1955年通过淀粉凝胶电泳法首次被鉴定[3]。近年来,通过对DKD新型诊断标志物的探索发现,体内Hp浓度及其基因型与DKD发生发展相关[4-5]。Hp的三种基因型结构不同,导致其生物学功能存在差异。不同Hp基因型对糖尿病患者血管并发症的影响也不用,Hp基因型可能对DKD具有潜在的预测价值[6]。然而此前研究[7-14]显示,Hp基因型在不同人群中的分布差异很大,与DKD的相关性研究结论不一致,且目前我国DKD患者人群的相关研究较少。本研究旨在通过病例对照研究探讨血清Hp及Hp基因多态性与DKD易感性的关系,为DKD的防治提供理论基础。
1 对象与方法
1.1 研究对象
将首都医科大学附属北京同仁医院内分泌科自2018年6月至2019年2月住院的2型糖尿病患者作为研究对象,所有患者均符合世界卫生组织糖尿病委员会的糖尿病诊断标准,彼此之间无血缘关系。依照患者尿白蛋白/肌酐比值(albumin-to-creatinine ratio, ACR)浓度,选择ACR<30且糖尿病病程大于10年的212例患者定义为对照组;ACR>30的249例糖尿病患者定义为DKD组,即病例组。研究对象排除:1型糖尿病(type 1 diabetes mellitus, T1DM);妊娠;考虑存在其他肾疾病;急慢性感染;严重心脑血管疾病等。本研究得到首都医科大学附属北京同仁医院伦理委员会准可(伦理审批号:TRECKY2018-037),入选患者均签署知情同意书。
1.2 资料收集
收集患者住院期间的一般资料信息,包括姓名、性别、年龄、病程、并发症及合并症情况、用药情况等。测定血压(患者休息30 min后测量),测量身高、体质量,计算体质量指数(body mass index, BMI)。记录患者住院期间糖化血红蛋白(hemoglobin A1c,HbA1c)、三酰甘油(triglyceride,TG)、总胆固醇(total cholesterol,TC)、高密度脂蛋白胆固醇(high density lipoprotein-cholesterol,HDL-C)、低密度脂蛋白胆固醇(low density lipoprotein-cholesterol,LDL-C)、血肌酐(serum creatinine,Scr)、尿素氮(blood urea nitrogen, BUN)、尿微量白蛋白/肌酐(urinary albumin-to-creatinine ratio, UACR)等生化指标结果。
1.3 标本收集
患者禁食12 h后,于清晨空腹抽取静脉血,常温3 000 r/min条件下离心5 min,取上清进行分装后,样品储存在-80 ℃,用于后续基因型与浓度检测。
1.4 Hp基因型及血Hp测定
将冷冻的标本取出,室温融化,混匀,再次离心取上清后采用丙烯酰胺凝胶电泳(polyacrylamide gel electrophoresis,PAGE)电泳法进行基因型检测。取10 μL血清样品与2 μL 10%(质量分数)血红蛋白(hemoglobin, Hb)溶液混合,并在室温下静置5 min以形成Hp-Hb复合物。复合物随后加入10 μL 20%(质量分数)蔗糖进行平衡。取出电泳装置,配置7.4%(质量分数)丙烯酰胺凝胶作为分离胶, 5%(质量分数)丙烯酰胺凝胶作为浓缩胶,将凝胶板放入电泳槽,加入5 mmol/L pH 9.0硼酸盐电泳缓冲液,按顺序依次加入样本,每条泳道上10 μL。电泳在50 V恒压下进行4 h。电泳完成后,取出凝胶,滴加联苯胺过氧化氢显色剂,待条带清晰显现后,放入蒸馏水中终止反应,拍照记录Hp基因型。所需仪器为北京六一DYCZ-24D型电泳槽。
血清样本中Hp浓度应用BNⅡ全自动特定蛋白分析仪(西门子公司,德国)及触珠蛋白测定试剂盒(和亚公司,中国)通过散射比浊法按操作说明进行测定。
1.5 统计学方法

2 结果
2.1 两组患者一般资料和实验室检查结果比较
单纯糖尿病组患者均为病程大于10年的患者,其年龄和糖尿病病程显著高于DKD组(P<0.05)。病例组男性患者、吸烟患者所占比例显著高于对照组(P<0.05),且其收缩压、舒张压、BMI、Scr、BUN、HbA1c、Glu、TG都显著低于对照组(P<0.05)(表1)。
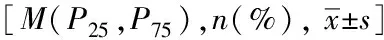
表1 受试者一般资料和实验室检查结果比较Tab.1 Comparison of demographic, clinical and laboratory characterization of the subjects
2.2 两组患者基因型比较
应用PAGE电泳法对患者Hp基因型进行鉴定,共检测出Hp1-1、Hp2-1、Hp2-2 3种基因型(图1)。3种基因型在2组患者中的频率见表2。样本基因型分布符合Hardy-Weinberg平衡(χ2=1.827,P=0.401),提示该样本具有群体代表性。在两组患者中,Hp1-1基因型均占比最低,而Hp2-2基因型占比最高。Hp1-1、Hp2-1、Hp2-2 3种基因型分布频率在病例组分别为8.5%、36.3%、55.2%,在对照组分别为:8.0 %、34.5%、57.4%。基因型分布组间差异无统计学意义(χ2=0.234,P=0.89)。Hp等位基因频率在两组患者间差异也无统计学意义(χ2=0.217,P=0.641)(表3)。
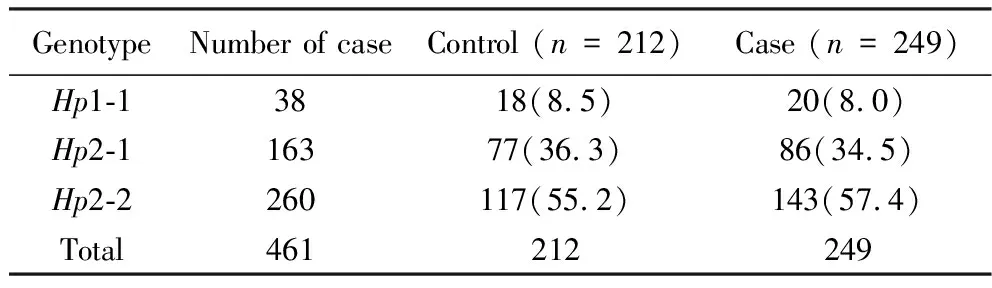
表2 Hp基因型在两组中的出现频率

表3 两组间Hp基因分布频率比较
图1 Hp基因型电泳结果Fig.1 Electrophoresis results of Hp genotypes
2.3 两组患者血清Hp浓度比较
DKD病例组患者血清Hp浓度[0.98(0.66~1.39)]显著高于对照组患者[0.86(0.63~1.26)] (P<0.05)(图2)。携带Hp1-1基因的患者血清Hp浓度显著高于其他两种基因型的患者(图3)。比较血清Hp与年龄、血压和Scr等临床指标的相关性发现,血Hp浓度与血红蛋白浓度负相关,与年龄、BMI、SBP、DBP、血压、Scr、HbA1c、BUN等无显著相关性(表4)。
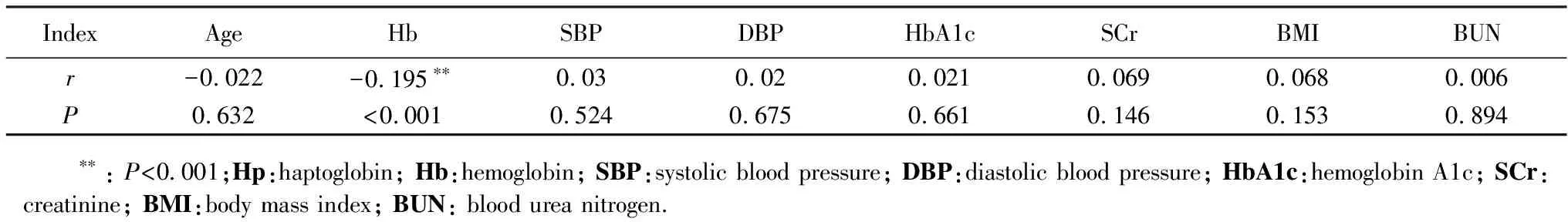
表4 血Hp与糖尿病危险因素的相关性分析Tab.4 Correlation analysis of blood Hp and diabetes risk factors
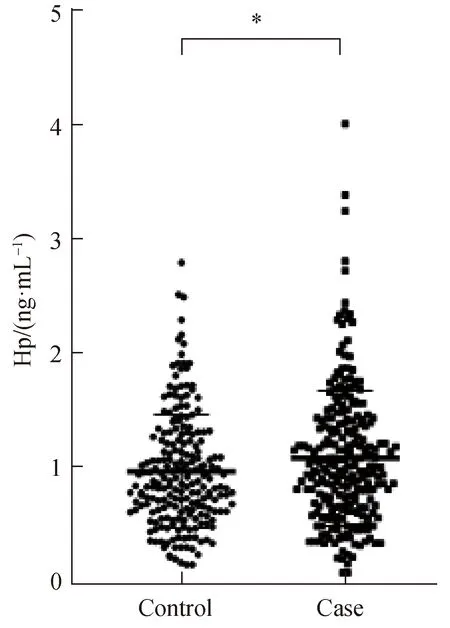
图2 血清Hp浓度组间比较Fig.2 Hp levels between two groups*: P<0.05;Hp:haptoglobin.
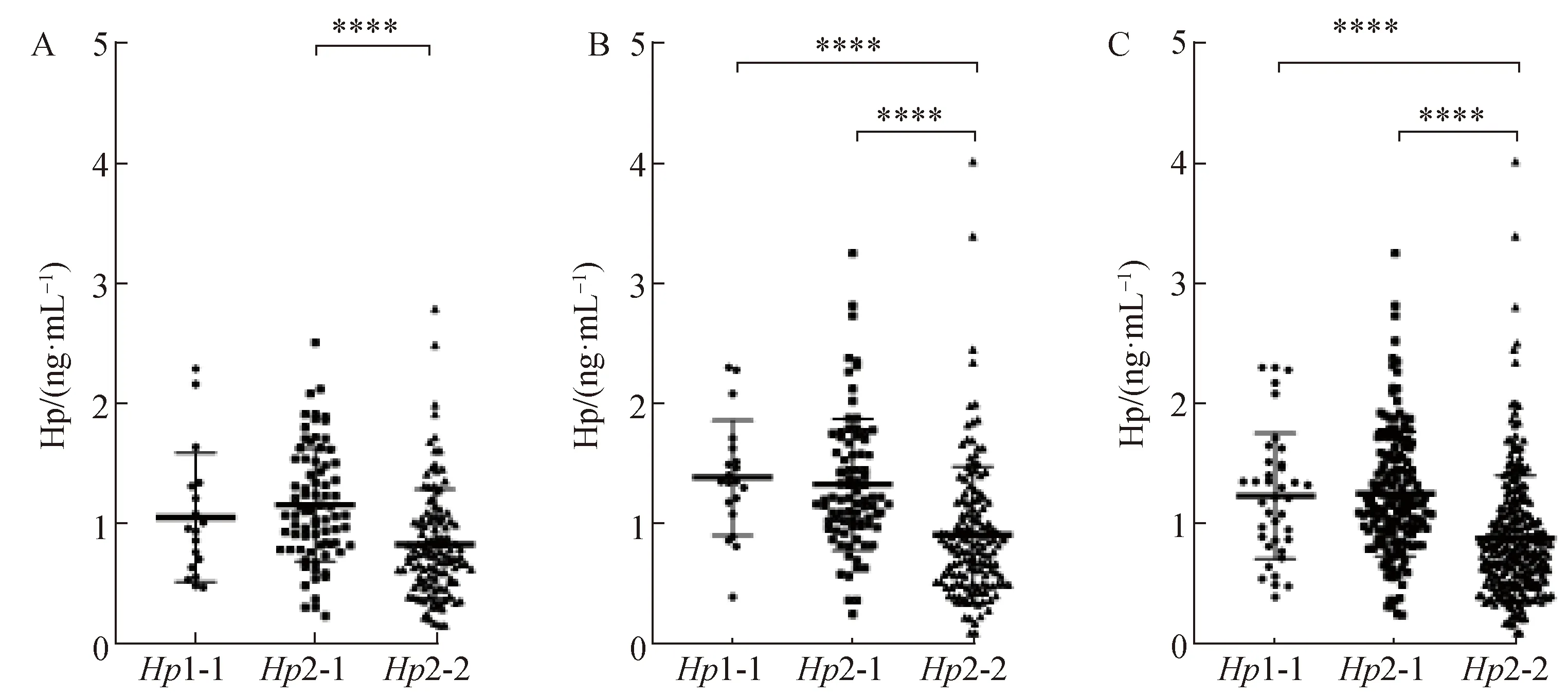
图3 不同基因型间的血清Hp浓度Fig.3 Hp levels among different genotypes
3 讨论
Hp是一种具有遗传多态性的血浆糖蛋白,其基因型的分布表现为区域和种族差异,Hp1-1为南美最流行的基因型,而在亚洲Hp2-2更为普遍[7]。有关Hp基因多态性与DKD关系的研究大多数在西方人群中进行,在亚洲人群中缺乏确凿的证据。一项以色列的研究[8]表明,DKD患病率及严重程度与Hp2-2基因型明显相关,Hp2-2基因型可能是DKD发生的主要易感基因。此外,爱尔兰、埃及、约旦的研究[9-11]均证实Hp2-2基因型与DKD发生的相关性。但并不是所有研究都得出一致的结论,巴西的一项针对265例糖尿病人群的研究[12]及西班牙一项114例糖尿病人群的研究[13]均未发现Hp2-2基因型与DKD发生相关。终末期肾疾病在亚洲人群中的发病率高于西方人群,且DKD在中国2型糖尿病中的患病率高达52.5%[14]。因而有必要继续补充亚洲人群中Hp基因多态性与DKD易感性的研究,为进一步探讨DKD发病机制及疾病预测提供基础。
本文研究比较了糖尿病病程大于10年且无慢性肾病的单纯糖尿病患者(对照组)及DKD患者(病例组)Hp基因型分布情况。结果显示,Hp1-1、Hp2-1和Hp2-2在对照组中的基因频率与此前在中国北方糖尿病人群中Hp基因型分布的报道[15]基本一致。本文研究中,与单纯糖尿病患者比较,DKD患者3种基因型分布无显著差异,提示Hp基因型和等位基因频率与DKD的易感性无关。这与此前日本、西班牙、约旦和巴西患病人群的研究[12-13,16-17]结论一致。目前,Hp基因多态性与DKD的关系在不同种群中尚无一致性的结论,可能与种族、遗传背景、病例选择标准、样本量、其他代谢指标控制情况等因素有关。考虑到亚洲人群中基因型分布中Hp2-2的占比过高,可能导致统计过程中出现假阴性结果。本文研究仅基于北京一家医疗机构收治的2型糖尿病患者,结果是否普遍适用还需进一步大规模探索。
Hp作为急性期蛋白,主要功能是与血浆中的游离血红蛋白(Hb)结合形成Hp-Hb复合物而被清除,继而减弱游离Hb导致的一系列氧化反应[18]。白细胞介素-6、白细胞介素-1、肿瘤坏死因子α等细胞因子可以与Hp基因调控位点结合进而诱导Hp的产生[19-20]。在炎症进展中,循环中Hp浓度会升高[21]。目前关于Hp表达与DKD关系的研究多集中于尿Hp浓度。多项研究[22-23]表明尿Hp是肾损害的生物标志物,对DKD进展具有诊断及预测价值。血Hp表达与DKD的关系的研究较少,本文研究发现DKD组的血Hp浓度明显高于单纯糖尿病组,提示血清Hp浓度可以作为2型糖尿病患者DKD发生的危险因素。
不同基因型的Hp产物在功能上存在差异,例如与Hb的结合能力与抗氧化作用具有基因型依赖性,Hp1-1型的抗氧化作用最强,Hp2-2的作用最弱[24]。此外,研究[25]表明Hp基因型对于Hp在患者体内的表达情况有影响。本文研究表明,无论是单纯糖尿病患者组还是DKD患者组,血清中的Hp浓度与Hp基因型存在显著相关性。基因型为Hp2-2的受试者体内Hp表达量较低,这一发现与多份临床研究[26-27]结果一致:在欧洲和非洲人群中,发现Hp1-1基因型的患者循环中的Hp浓度明显高于其他两种基因型的患者。目前尚无明确机制对这一现象进行解释,但考虑到Hp1与Hp2在与Hb结合能力上的差异,这一现象或许与其抗氧化生物学功能有关。相关性分析显示,血清中的Hp浓度与Hb浓度存在显著相关性,进而证实血清Hp升高与Hb浓度有关。因此,在研究血清中的Hp浓度与DKD关系时,应注意观察人群中的基因型分布情况。
综上,本文探讨了血清Hp浓度和Hp基因多态性与DKD的关系。血清Hp在病例组中的浓度明显增高,表明Hp与肾功能受损有关。尽管本文研究未发现Hp基因型与DKD的患病风险存在关联,但Hp基因型会影响血清Hp浓度。这提示血清Hp浓度也可以作为DKD的潜在生物标志物,并提示在考虑血清Hp的作用时需要同时考虑Hp基因型。
利益冲突所有作者均声明不存在利益冲突。
作者贡献声明李雨阳:分析数据,撰写论文;朱晓蓉、刘婧、郑晓敏:采集数据;杨金奎、杨芳远:提出研究思路,设计研究方案,撰写论文。

