基于网络药理学及代谢产物分析白首乌对乙醇性肝损伤的作用机制
宋婉钰 李勇 李春阳 冯进 吴承东 马永强

摘要:通过网络药理学及分子对接技术阐述一年生、多年生白首乌代谢产物对乙醇性肝损伤的作用机制。使用液相色谱-飞行时间质谱分析白首乌提取物的化学组成,通过PubChem数据库及文献查找方法筛选出具有生物活性的成分,预测成分靶点、获取疾病靶点并通过构建蛋白质-蛋白质互作网络,筛选关键成分及核心靶点,最后对交集靶点进行富集通路分析与分子对接及可视化处理。经过筛选发现,白首乌含有25种已认证的生物活性因子,其在多年生白首乌中的含量显著高于一年生白首乌(活性成分有20种);一年生白首乌中含量显著高于多年生白首乌(活性成分有5种),验证了白首乌主要活性成分中的多糖类、氨基酸类能与潜在作用靶点发生相互作用。最后得出,一年生白首乌中的成分是通过减少细胞色素活性及减轻炎症反应来抑制乙醇性肝损伤及相关疾病,多年生白首乌中的成分则是通过影响基因表达及能量代谢途径来实现保护肝脏的功能。
关键词:白首乌;代谢产物分析;网络药理学;分子对接;乙醇性肝损伤
中图分类号:R285.5 文献标志码:A 文章编号:1002-1302(2023)09-0166-09
基金项目:江苏省农业科技自主创新资金[编号:CX(20)2006)]。
作者简介:宋婉钰(1996—),女,山东黄县人,硕士研究生,研究方向为食品科学。E-mail:wanyu18545546152@126.com。
通信作者:李春阳,博士,研究员,研究方向为营养与活性功能。E-mail:lichunyang968@126.com。
白首乌(Cynanchum auriculatum Royle ex Wight)是萝藦科鹅绒藤属植物耳叶牛皮消的块根,别称隔山消、隔山撬、白人参、和平参、白木香、山花旗等,广泛分布于华东、中南及河北、陕西、甘肃等地[1]。我国95%的白首乌产自江苏滨海地区,2010年滨海白首乌获得国家质监总局地理标志保护产品认证,并于2012年成为江苏省地理标志产品。
目前,有关一年生白首乌功效的报道较多,主要集中在抗肿瘤[2]、保肝护肝[3]与免疫调节[4]等方面,而关于多年生白首乌活性成分组成、含量及生物功能性差异等方面的研究则鲜见报道。本研究基于液相色谱-飞行时间质谱(liquid chromatography-time of flight mass spectrometry,LC-QTOF/MS)及网络药理学技术,对一年生白首乌与多年生白首乌提取物的活性组成、含量进行较为系统的研究,同时对两者生物活性功能进行比较及预测,以期为白首乌产品开发及工业化生产提供有效的理论依据。
1 材料与方法
1.1 材料与试剂
白首乌由盐城果老首乌科技有限公司提供。分析纯乙醇(批号:20200319),购自国药集团化学试剂有限公司。
1.2 仪器与设备
LC-QTOF/MS高效液相色谱(安捷伦1260)串联飞行时间质谱(AB SCIEX TOF 5600+),购自安捷伦科技有限公司;FD-2A真空冷冻干燥机,购自北京博医康实验仪器有限公司;L3-5K台式低速离心机,购自湖南可成仪器设备有限公司;RE52-A旋转蒸发仪,购自上海亚荣生化仪器厂。
1.3 试验方法
1.3.1 LC-QTOF/MS分析白首乌提取液 将一年生白首乌、多年生白首乌冻干后研磨成粉末。称取相同质量的白首乌粉末,以乙醇为溶剂,热回流提取1.5 h,提取温度为70 ℃,于4 500 r/min离心15 min并收集上清液。将白首乌残渣经过2次提取离心后,合并2次离心所得上清液,减压浓缩至无醇味,冷藏静置2 h,过滤,得到白首乌提取液。
1.3.1.1 LC-QTOF/MS条件 参考刘启月等的方法[5]。色譜柱:XSelect HSS T3(4.6 mm×150.0 mm,3.5 μm);正电离模式流动相A为0.1%甲酸/水,流动相B为乙腈;负电离模式流动相A为0.005 mol/L乙酸铵,流动相B为乙腈。质谱条件:QTOF/MS全扫描模式,质量扫描范围为50~1 000 质荷比;正、负电离模式的源电压分别为 5 500、4 500 V;帘气、雾化器和加热气体的流动压力分别为25、50、50 psi;正、负模式离子源电压分别为30、-30 V。
1.3.1.2 LC-QTOF/MS数据处理 用MS-DI-AL软件进行相似性匹配来鉴定化合物。化合物鉴定后,采用RStudio进行主成分分析,随后通过Excel 2016的T TEST公式进行计算,将表现为显著(P<0.05)的数据采用TBtools进行聚类分析。基于一年生、多年生白首乌差异代谢物,进一步通过PubChem网站、类药五原则(lipinski rules)[6]及相关参考文献对差异代谢物进行进一步分析注释,筛选出具有生物活性功能的差异代谢物。
1.3.2 成分靶点预测及疾病靶点筛选 从PubChem网站获得各个成分的Smiles化学结构式,首先将Smiles化学结构式上传到Swiss Target Prediction网站,选择“Homo sapiens”作为研究物种,获得该成分可能的靶点蛋白信息。同时将Smiles化学结构式上传到Similarity Ensemble Approach (SEA)网站,获得预测靶点信息,再通过Excel筛选出“HUMAN”作为研究物种,得到可能的靶点信息。最后将2个数据库得到的成分靶点蛋白信息进行去重,整合取并集,分别得到一年生白首乌、多年生白首乌潜在的作用靶点。
在KEGG DISEASE网站上检索乙醇性肝损伤,得到“Alcoholic liver disease”,再以“Alcoholic liver disease”为关键词,分别在Therapeutic Target Database(TTD)、PharmGKB、Drugbank和Online Mendelian Inheritance in Man(OMIM)数据库中进行搜索,可得到与乙醇性肝损伤相关的疾病靶点,对得到的靶点进行去除假阳性、去重处理,得到与乙醇性肝损伤相关靶点的总和。
用Venny 2.1.0软件绘制Venn图,将成分与疾病的靶点蛋白相交,得到作为活性成分缓解抑制疾病的靶点。将活性成分与UniProt网站中获取的靶点进行匹配,导入Cytoscape 3.7.2中绘制白首乌-成分-疾病靶点相互作用网络图。
1.3.3 PPI网络构建 通过STRING 11.5数据库,绘制蛋白质-蛋白质之间相互作用的网络图(PPI)。通过RStudio,将数据库数据以大于中位值作为关键靶点的标准进行筛选后,导入Cytoscape 3.7.2中,对目前的相互作用靶点进行拓展,发现直接靶点与间接靶点之间产生的内在联系,进而进行全面考察,最终得到治疗疾病的关键靶点及其对应的活性成分。
1.3.4 富集分析 将活性成分的靶点蛋白通过DAVID数据库中的“OFFICIAL_GENE_SYMBOL”基因名进行识别,以“Homo sapiens”为研究对象,得到GO、KEGG及WIKI数据;再利用Bioinformatics网站中的富集分析工具对靶点进行信号通路分析。
1.3.5 成分-靶点分子对接验证 在RCSB PDB数据库中获取靶点蛋白的3D结构,在PyMOL 2.5.0软件中进行去除水分子、游离配体后,将其命名为受体文件;在PubChem数据库中获取小分子成分的3D结构,通过Open Babel软件进行格式转化,将其命名为配体文件。最后将受体蛋白、配体通过AutoDock 4进行分子对接。以最低结合能为标准筛选可能的分子对接结构,最后通过PyMOL 2.5.0软件对对接结果进行可视化处理。
2 结果与分析
2.1 代谢产物分析
对检测数据进行主成分分析(PCA)与聚类分析。由图1可以看出,一年生白首乌(OA)、多年生白首乌(OB)表现为明显的离散型,表明两者在成分组成、含量方面确实存在显著差异。这可能是因为随着栽培年限的增加,白首乌次级代谢产物的种类、含量发生了显著变化。
如图1所示,一年生白首乌(a01、a02和a03)与多年生白首乌(b01、b02和b03)中含量存在显著差异的成分有117种,其中烯丙基丁酮、柠檬酸及鸟氨酸等多种氨基酸成分在多年生白首乌中的含量显著高于一年生白首乌中的含量,而烟酰胺、蔗糖及胆碱等成分在多年生白首乌中的含量却显著低于一年生白首乌中的含量(P<0.05)。
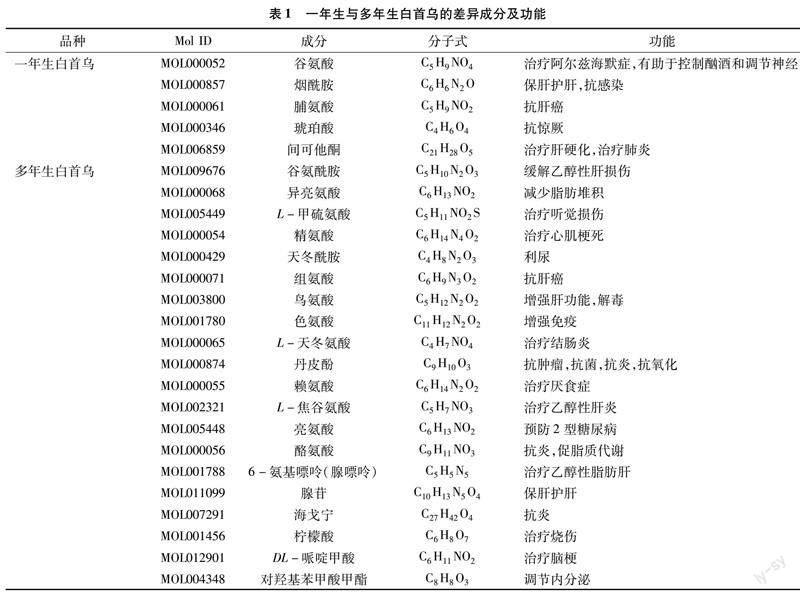
通过对117种存在含量差异的成分进行Lipinski筛选,以相对分子量<500、脂水分配系数<5、氢键供体数<5、氢键受体数<10和旋转键<10为标准,找出了67种符合标准的成分,又根据在PubChem网站中的查找结果及参考大量文献,发现白首乌含有25种已认证的生物活性因子,其中在多年生白首乌中含量显著高于一年生白首乌的活性成分有20种,在一年生白首乌中含量显著高于多年生白首乌的活性成分有5种。对各成分进行功能注释,并将结果汇总于表1,发现上述20种多年生白首乌成分主要具有缓解乙醇性肝损伤和抗肿瘤等功能,而一年生白首乌中的5种活性成分则主要表现为抗氧化及保肝护肝等功能。
2.2 成分靶点预测及疾病靶点筛选
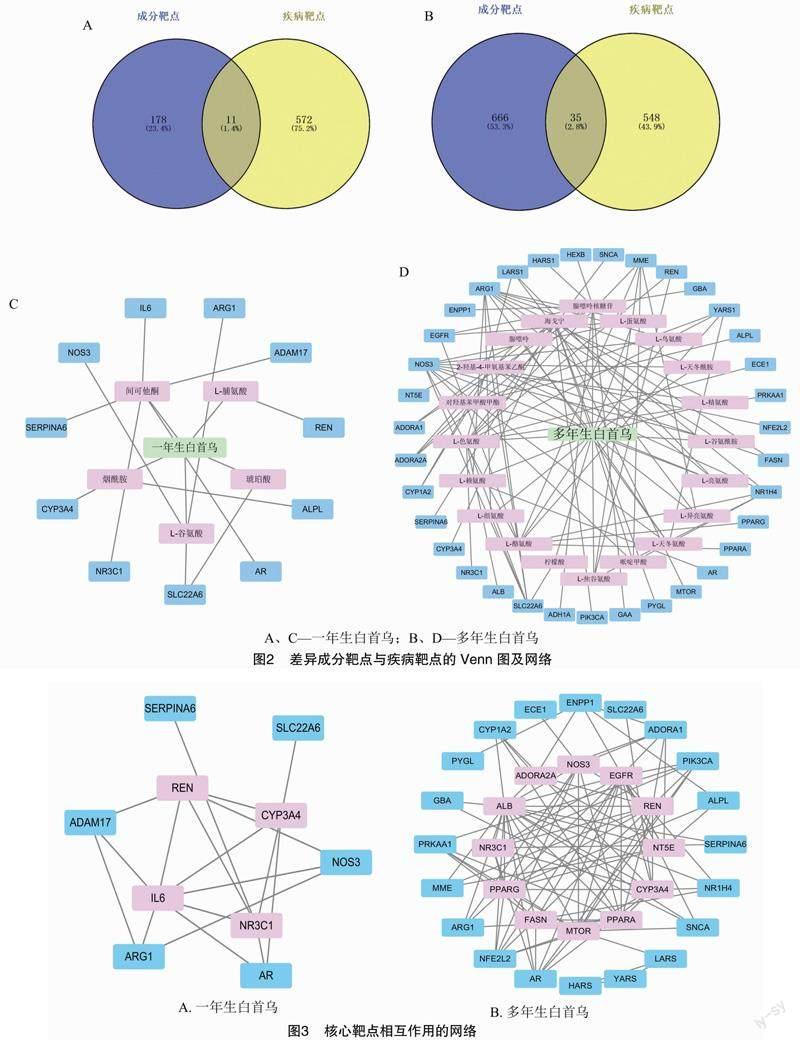
将一年生白首乌中5种活性成分的Smiles化学结构式上传到Swiss Target Prediction网站和SEA网站,得到预测靶点,进行去重整合后,得到189个作用靶点。从TTD、OMIM、PharmGKB及DrugBank这4个数据库中搜索与乙醇性肝损伤相关的靶点,去除假阳性及去重后,得到583个疾病靶点,将一年生白首乌中的活性成分靶点和乙醇性肝损伤疾病靶点相交,得到11个相交靶点(图2-A)。同时,对多年生白首乌中20种活性成分的701个作用靶点与乙醇性肝损伤疾病靶点相交,得到35个相交靶点(图2-B)。将相关信息导入Cytoscape 3.7.2软件后,得到白首乌-成分-疾病靶点相互作用网络图。如图2-C、图2-D所示,在一年生白首乌中,间可他酮有5个靶点,烟酰胺有2个靶点,谷氨酸有3个靶点;在多年生白首乌中,腺苷、色氨酸各有10个靶点,海戈宁、酪氨酸各有9个靶点,丹皮酚有5个靶点,赖氨酸有4个靶点,焦谷氨酸、天冬氨酸、亮氨酸、甲硫氨酸、哌啶甲酸及对羟基苯甲酸甲酯分别有3个靶点,谷氨酰胺、天冬酰胺及剩余氨基酸分别有2个靶点。
2.3 PPI网络的构建
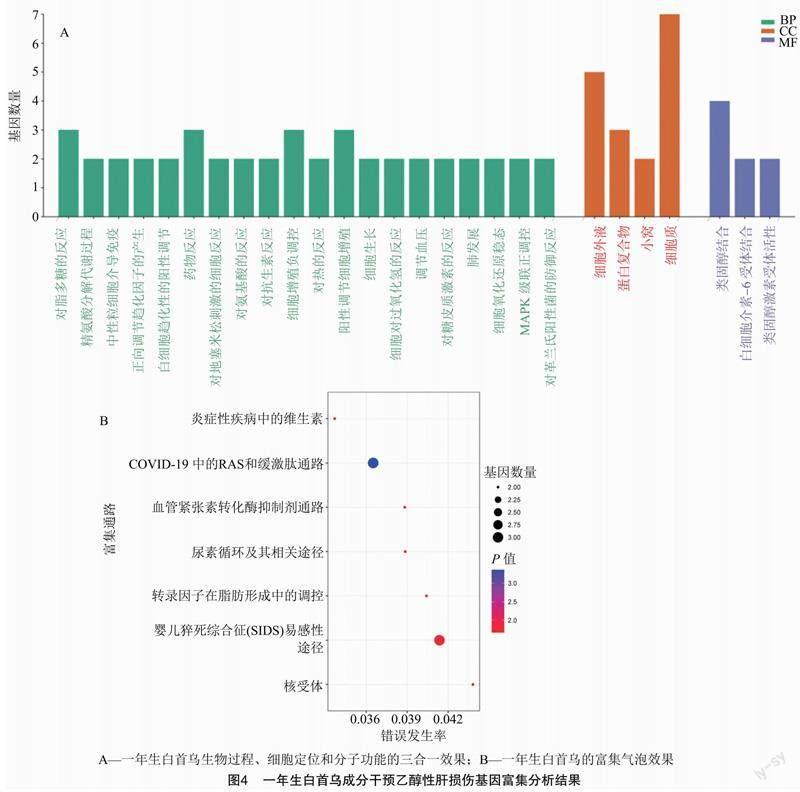
将多年生白首乌及一年生白首乌与乙醇性肝损伤的共同靶点上传至STRING 11.5数据库中,得到PPI网络。将结果通过RStudio以大于中位值作为关键靶点的标准进行筛选后得到核心靶点。图 3-A 为一年生白首乌成分干预下的乙醇性肝损伤靶点相互作用网络,其中CYP3A4、REN、NR3C1及IL6为一年生白首乌成分缓解抑制乙醇性肝損伤的4个关键靶点。图3-B中的NOS3、EGFR、REN、NT5E、CYP3A4、PPARA、MTOR、FASN、PPARG、NR3C1、 ALB及ADORA2A为多年生白首乌成分缓解抑制乙醇性肝损伤的12个关键靶点。
2.4 富集分析
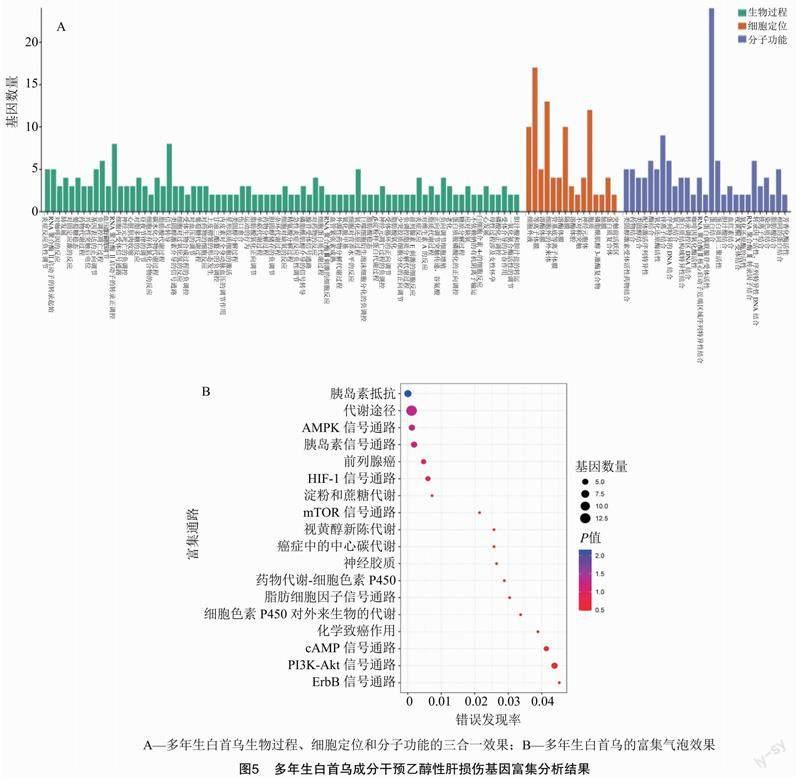
通过Bioinformatics网站中的富集分析工具对一年生白首乌、多年生白首乌干预乙醇性肝损伤的靶点基因进行分析,得到如图4、图5的富集结果。如图4所示,一年生白首乌预防乙醇性肝损伤的靶点参与了对脂多糖、氨基酸和糖皮质激素等的反应过程,这些靶点主要集中在蛋白复合物、细胞质及细胞外液等部位,具有结合类固醇、细胞增殖、中性粒细胞介导免疫、精氨酸分解代谢、正向调节趋化因子的产生和调节血压等功能,靶点主要集中在血管紧张素转化酶抑制剂通路、尿素循环及转录因子在脂肪形成中的调控等相关途径。由图5可知,多年生白首乌预防乙醇性肝损伤的靶点参与了对过氧化氢、维生素A、有机氮化合物及固定激素等反应过程,这些靶点主要集中在等离子体膜、细胞质以及细胞外液等部位,具有结合蛋白、激活转录因子及信号转导等功能,这些靶点主要富集在胰岛素、脂肪细胞因子、AMPK、HIF-1、mTOR、cAMP、PI3K-Akt与ErbB等信号通路及淀粉、蔗糖和药物等代谢途径。
2.5 分子對接验证
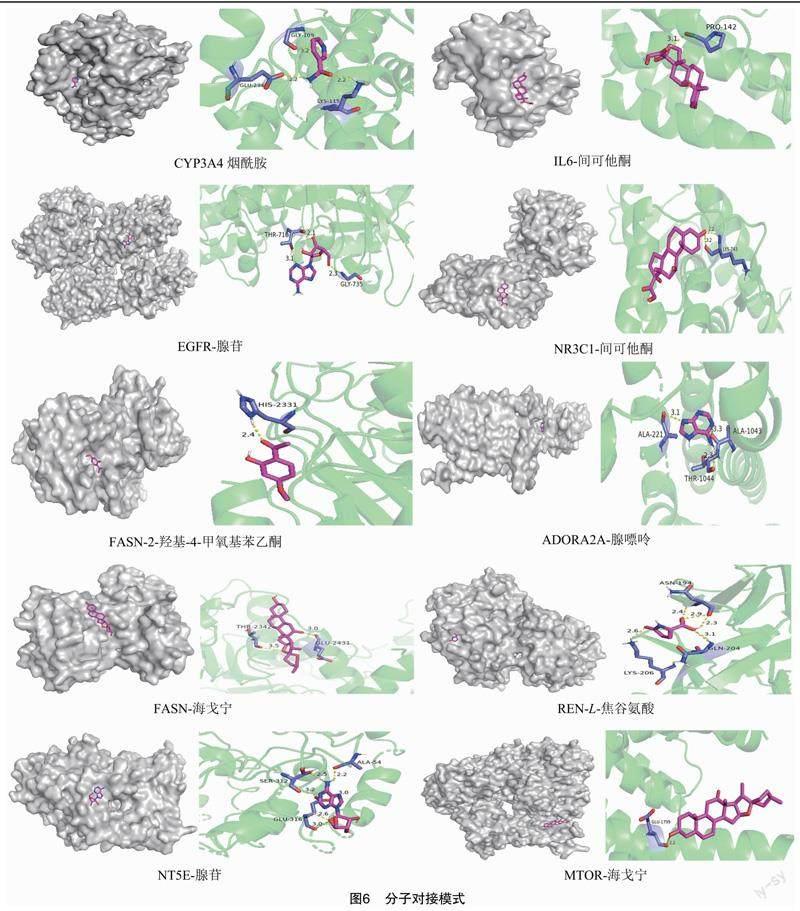
在靶点的PPI网络图中,多年生白首乌的12个关键靶点对应的成分为腺苷、海戈宁、腺嘌呤、丹皮酚(2-羟基-4-甲氧基苯乙酮)及L-焦谷氨酸等,由于靶点蛋白是执行功能的主要物质,因此选择EGFR、REN、NT5E、MTOR、FASN、NR3C1及ADORA2A对应的成分进行分子对接验证。在一年生白首乌中选择CYP3A4、IL6对应的烟酰胺、间可他酮进行分子对接验证。如图6所示,所选分子对接的能量均小于0,同时每个成分都结合在靶点蛋白的空腔内 因此可以推测每个组分在细胞内都可以与靶点自发结合形成靶点-配体二元复合物。
3 结论与讨论
根据数据库查询结果对差异成分进行靶点预测及比较,发现多年生白首乌对肝脏具有更好的保护作用。在多年生白首乌中,色氨酸、酪氨酸和赖氨酸等成分具有较多靶点,经过关键靶点筛选后,得到的关键靶点对应的成分为腺苷、海戈宁、腺嘌呤、丹皮酚及L-焦谷氨酸,表明这些成分在保护肝脏方面都具有一定作用,其中腺苷[7]、海戈宁[8]、腺嘌呤[9]、丹皮酚[10]及L-焦谷氨酸[11]起到了主要作用,而其他成分则通过促进靶点与关键靶点的相互作用来保护肝脏。
有研究发现,一次性或长期大量饮用含有乙醇的饮品后,乙醇及其代谢物在人体内代谢进入肝脏,刺激各种细胞释放出三磷酸腺苷(adenosine triphosphate,ATP),被水解的一磷酸腺苷再用胞外CD73(5′-nucleotidase,NT5E)将其水解成腺苷,大量腺苷积聚后启动免疫反应,释放出炎症因子,使机体在短期内形成乙醇性肝损伤,长期的炎症因子刺激肝星状细胞活化后分泌胶原,从而形成慢性乙醇性肝纤维化[12]。除循环肾素-血管紧张素系统(renin-angiotensin system,RAS)外,活化的肝星状细胞高表达肝脏局部RAS能以不同分泌方式在肝细胞脂肪沉积、调节肝脏功能等方面发挥重要作用[13],并且抑制CD73、CD39可以阻断腺苷A2A(adenosine A2a receptor,ADORA2A)和腺苷A2B受体的激活及TGF-β/Smad3通路的形成,从而阻止星状细胞的活化,缓解急性乙醇性肝损伤、慢性乙醇性肝纤维化。靶点表皮生长因子受体erbB1(epidermal growth factor receptor erbB1,EGFR)就是ATP-CD39-CD73信号通路和ATP代谢通路中缓解抑制乙醇性肝损伤的预防靶点[14]。长期大量摄入乙醇会过度激活肝细胞MTOR复合物1,表现为肝细胞蛋白磷酸化水平升高。依赖丝氨酸/苏氨酸蛋白激酶(serine/threonine-protein kinase,MTOR)相互作用蛋白的MTOR复合物1受到抑制时,会减弱由乙醇诱导的细胞质积聚,阻止抑制脂肪酸氧化,对人类乙醇性脂肪变性、炎症和肝损伤有潜在治疗作用[15]。生脂基因激活、肝细胞中脂质积聚是通过糖皮质激素受体(glucocorticoid receptor,NR3C1)的反式激活和N6-甲基腺苷去甲基化来减少脂质积聚的,可以防止肝脏脂肪变性[16]。减少脂肪酸合成酶(fatty acid synthase,FASN)含量及活性是预防乙醇性肝损伤及保护肝脏的关键[17]。因此,从NT5E、REN、ADORA2A、EGFR、MTOR、NR3C1以及FASN这些靶点的研究结果可以推测:多年生白首乌活性成分是通过影响基因表达及能量代谢途径来达到保护肝脏的功能。
非乙醇性脂肪肝病和糖尿病与肝脏细胞色素P450 3A4(cytochrome P450 3A4,CYP3A4)活性降低有关,通过抑制CYP3A4酶含量对肝损伤具有保护作用[18]。植物提取物对肝脏有一定的保护作用,研究发现,白细胞介素-6(interleukin-6,IL6)就是通过减轻炎症反应来减少肝脏脂肪变性和肝细胞坏死的靶点之一,通过减轻炎症反应和氧化应激可以保护肝脏,预防乙醇性肝损伤[19-20]。通过对CYP3A4、IL6这2个靶点的研究,推测一年生白首乌中的成分是通过减少细胞色素的活性及减轻炎症反应来抑制乙醇性肝损伤及相关疾病。分子对接的可视化结果显示,通过分子之间的相互对接验证了上述靶点确实对乙醇性肝损伤起到了重要作用。
参考文献:
[1]印 鑫,丁永芳,邵久针,等. 白首乌的研究进展[J]. 中草药,2019,50(4):992-1000.
[2]Dong J R,Peng X R,Li L,et al. C21 steroidal glycosides with cytotoxic activities from Cynanchum otophyllum[J]. Bioorganic & Medicinal Chemistry Letters,2018,28(9):1520-1524.
[3]Wu Z H,Wang Y Y,Meng X,et al. Total C-21 steroidal glycosides,isolated from the root tuber of Cynanchum auriculatum Royle ex Wight,attenuate hydrogen peroxide-induced oxidative injury and inflammation in L02 cells[J]. International Journal of Molecular Medicine,2018,42(6):3157-3170.
[4]Qin J J,Chen X,Lin Z M,et al. C21-steroidal glycosides and sesquiterpenes from the roots of Cynanchum bungei and their inhibitory activities against the proliferation of B and T lymphocytes[J]. Fitoterapia,2018,124(6):193-199.
[5]刘启月,李 勇,陈小龙,等. 基于代谢组学分析桃胶中酚类化合物含量及抗氧化活性[J]. 江苏农业学报,2021,37(3):746-753.
[6]Rampogu S,Parate S,Parameswaran S,et al. Natural compounds as potential Hsp90 inhibitors for breast cancer-Pharmacophore guided molecular modelling studies[J]. Computational Biology and Chemistry,2019,83(C):107113.
[7]Testino G,Leone S,Fagoonee S,et al. The role of adenosyl-methionine in alcoholic liver disease and intrahepatic cholestasis[J]. Minerva Gastroenterologica e Dietologica,2018,64(3):187-189.
[8]Santos Cerqueira G,dos Santos E Silva G,Rios Vasconcelos E,et al. Effects of hecogenin and its possible mechanism of action on experimental models of gastric ulcer in mice[J]. European Journal of Pharmacology,2012,683(1/2/3):260-269.
[9]黃时顺,刘 洋,张 冰,等. 聚腺苷二磷酸核糖聚合酶在酒精性脂肪肝中的研究进展[J]. 中国医药导报,2017,14(22):51-54.
[10]Zhang L,Li D C,Liu L F. Paeonol:pharmacological effects and mechanisms of action[J]. International Immunopharmacology,2019,72:413-421.
[11]朱 云. 通过非靶向代谢组学分析乙型肝炎病毒协同酒精诱导小鼠肝脏组织的生物标志物和代谢通路[D]. 合肥:安徽医科大学,2020:12-26.
[12]单 亮. ATP-CD39-CD73通路调控肝星状细胞炎症因子和纤维化因子分泌在酒精性肝病中的作用[D]. 合肥:安徽医科大学,2020:47-89.
[13]Zhang H F,Gao X,Wang X,et al. The mechanisms of renin-angiotensin system in hepatocellular carcinoma:from the perspective of liver fibrosis,HCC cell proliferation,metastasis and angiogenesis,and corresponding protection measures[J]. Biomedicine & Pharmacotherapy,2021,141:111868.
[14]Meena A S,Shukla P K,Sheth P,et al. EGF receptor plays a role in the mechanism of glutamine-mediated prevention of alcohol-induced gut barrier dysfunction and liver injury[J]. The Journal of Nutritional Biochemistry,2019,64(2):128-143.
[15]Chen H Q,Shen F,Sherban A,et al. DEP domain-containing mTOR-interacting protein suppresses lipogenesis and ameliorates hepatic steatosis and acute-on-chronic liver injury in alcoholic liver disease[J]. Hepatology,2018,68(2):496-514.
[16]Hu Y,Feng Y,Zhang L C,et al. GR-mediated FTO transactivation induces lipid accumulation in hepatocytes via demethylation of m6A on lipogenic mRNAs[J]. RNA Biology,2020,17(7):1736868.
[17]Moreira R J,Castro ,Oliveira T E,et al. Lipoatrophy-associated insulin resistance and hepatic steatosis are attenuated by intake of diet rich in omega 3 fatty acids[J]. Molecular Nutrition & Food Research,2020,64(7):1900833.
[18]Jamwal R,de la Monte S M,Ogasawara K,et al. Nonalcoholic fatty liver disease and diabetes are associated with decreased CYP3A4 protein expression and activity in human liver[J]. Molecular Pharmaceutics,2018,15(7):2621-2632.
[19]Dai W B,Chen C,Feng H T,et al. Protection of Ficus pandurata Hance against acute alcohol-induced liver damage in mice via suppressing oxidative stress,inflammation,and apoptosis[J]. Journal of Ethnopharmacology,2021,275(7):114140.
[20]Ding C B,Zhao Y C,Chen X Y,et al. Taxifolin,a novel food,attenuates acute alcohol-induced liver injury in mice through regulating the NF-κB-mediated inflammation and PI3K/Akt signalling pathways[J]. Pharmaceutical Biology,2021,59(1):868-879.

