AM真菌联合柠檬酸对紫云英生长的协同效应
张抒情 王月 张亚 王立龙 柯丽霞 杨安娜

摘要:为了解AM真菌联合柠檬酸对紫云英生长发育及生理特性的影响,通过接种Funneliformis mosseae和联合施加柠檬酸进行紫云英温室盆栽试验,测定紫云英幼苗植株形态、根系发育、养分吸收、抗氧化酶活性、渗透调节系统等指标。结果表明,AMF联合柠檬酸的组别相较于CK组株高、分枝数和生物量均显著增加(P<0.05)。在不同柠檬酸浓度下,接菌后的紫云英比CK组的根冠比和根系活力均显著提升,4 mmol/L浓度组的根冠比提升了51.9%、2 mmol/L 浓度组的根系活力提升了1.34倍;单独施加柠檬酸可显著增加紫云英磷含量和叶绿素含量,接菌之后进一步提升二者的含量,在接菌且柠檬酸浓度为4 mmol/L条件下,磷含量和叶绿素含量较CK组分别增加92.2%、48.2%;AMF联合柠檬酸可显著促进紫云英抗氧化酶活性:在柠檬酸浓度为2 mmol/L条件下的超氧化物歧化酶活性最佳,达378.38 U/g;在柠檬酸浓度为4 mmol/L条件下的过氧化物酶和过氧化氢酶活性最佳,分别达到1 617.50、1 834.89 U/(g·min);在相同柠檬酸浓度下,联合处理组与单施柠檬酸组相比,进一步显著增加紫云英可溶性糖和可溶性蛋白含量且显著降低丙二醛含量。综上,AM真菌联合柠檬酸可以通过促进根系发育和养分吸收,进而提高紫云英幼苗生理代谢水平,对紫云英幼苗生长具有一定协同作用。
关键词:AM真菌;柠檬酸;紫云英;生长发育
中图分类号:S182;S541+.304 文献标志码:A 文章编号:1002-1302(2023)09-0254-07
基金项目:安徽省自然科学基金(编号:1908085MD104)。
作者简介:张抒情(1995—),女,河北廊坊人,硕士,主要从事土壤微生物学研究。E-mail:550890757@qq.com。
通信作者:杨安娜,博士,副教授,主要从事土壤微生物学研究。E-mail:anyz@163.com。
丛枝菌根真菌(arcusbular mycorrhizal fungui,AMF)是土壤真菌的重要成员。它属于菌物界球菌门球菌纲,是一类最古老的、专性活体营养共生菌。地球约90%的陆生植物都可与丛枝菌根真菌共生[1-2]。AMF如同在土壤和植物之间形成了一座营养互通的桥梁——碳水化合物与矿质养分交换[3]。AMF通过共生在植物根皮层细胞中获取植物提供的碳水化合物,作为回报,AMF根外菌丝帮助植物吸收土壤中的矿质养分(如氮和磷)输送到植物根部,从而促进宿主植物的生长[4-5]。在可持续农业生产中,利用AMF菌根生物技术可以改善植物的生长状况与生态环境[6]、提高农作物产量[7]等,AMF与植物的互作研究已经成为生态农业研究的热点且受到广泛关注。柠檬酸(citric acid)别称枸杞酸,学名3-羧基-3-羧基戊二酸。在农业植物研究方面,柠檬酸作为绿色环保的低分子量有机酸,在土壤中作为载体增强土壤矿物溶解性和营养元素有效性。使菌根植物能够吸收非菌根植物无法活化的氮、磷形式从而提高宿主植物的抗逆性和生物量[8-9]。近年来,部分学者认为,柠檬酸能够通过螯合作用和酸溶解作用促进植物吸收土壤中的有效磷(主要为H2PO-4、HPO2-4和PO3-4)。宋金凤等认为,适宜浓度的柠檬酸能促进暗棕壤中磷的活化,使落叶松和水曲柳幼苗吸收充足的养分,提升植物生长参数和营养价值[10]。刘路路等认为,柠檬酸在土壤中可调节有益土壤微生物(如AM真菌和根瘤菌)的群体布局和数量;可改变重金属的形态,提高植物根际土壤环境;可增加活性有机物质,促进玉米作物生长[11]。房福力等认为,外源施加柠檬酸可以减少化肥使用量,从而保护生态环境,还可以提高农作物番茄产量和经济效益[12]。所以探究外源添加柠檬酸对植物矿质营养吸收与化肥的作用具有重要意义。紫云英(Astragalus sinics)别称红花草、翘摇,是豆科黄芪属越年生草本植物。紫云英是南方稻区最主要的覆盖作物,在长江流域广泛种植[13]。紫云英在稻田种植后,丰富的土壤微生物类群利于土壤有机质的循环转化,翻压后还可以促进土壤碳、氮、磷、钾等元素的释放。它兼具强大的固氮作用,可以改善土壤理化性状和肥力,优化土壤生态环境,使农作物的质量与经济效益大幅提升[14-15]。紫云英的经济发展前景广阔,可以用作蔬菜牧草和蜜源植物,用于研制抗氧化和抗癌保健药品[16-17],还可以应用于绿肥施田与观景旅游为一体的系统[18]。因此,传统覆盖作物紫云英作为本试验的宿主具有一定的研究价值,紫云英在根际共生微生物与绿色有机酸的联合处理下生理响应如何?是否经生物-化学联合处理紫云英通过其生理响应能够反映出协同效应?本研究在生物与化学联合应用的生态农业方面具有一定的意义。因此,本研究采用温室盆栽试验,设置AMF和柠檬酸浓度2个环境处理因素,接种菌种为摩西斗管囊霉(Funneliformis mosseae),探究丛枝菌根真菌联合柠檬酸对覆盖作物紫云英生长及生理指标的影响。旨在改善农田生态环境,为绿色农业可持续发展提供理论依据。
1 材料与方法
1.1 试验设计
以紫云英作为宿主植物。土壤基质为自然风干的土壤、河沙与草炭在121 ℃、0.1 MPa灭菌 2 h,连续灭菌3次。将灭菌后的土壤、河沙、草炭放入已灭菌的花盆中,按照1 ∶ 1 ∶ 1比例混合均匀后作为供试基质待用。菌剂:供试菌种为摩西斗管囊霉(Funneliformis mosseae),由北京农林科学院植物营养与资源环境研究所提供。
将紫云英种子浸入 95%(体积分数)的乙醇 5 min,再以 5%(体积分数) NaClO 表面消毒 10 min,无菌水洗涤4~5次,之后将种子栽种至装有土壤基质的花盆中,每盆播撒5~6粒,再用2~3 cm 的土壤基质覆盖。不接种AMF处理组每盆放入土壤基质500 g;接种AMF处理组每盆放入土壤基质480 g,菌剂土壤20 g。每隔2 d浇水1次,每隔7 d施用 Hoagland 完全培養液。试验设0、2、4、6 mmol/L外施柠檬酸水平(以CA0、CA2、CA4、CA6表示),各施CA水平下设不接种与接种处理组别,(CK、CA2、CA4、CA6和CA0+AM、CA2+AM、CA4+AM、CA6+AM)共8个处理,每种处理10次重复。
温室试验于2022年6月1日在安徽师范大学生命科学学院植物恒温气候室进行。待植株生长20 d后,6月21日开始施加外源柠檬酸溶液:在CA2、CA4、CA6接菌与不接菌组植物根际施加 100 mL 相应浓度梯度的柠檬酸溶液,CK和CA0+AM组施加等量的蒸馏水。期间每隔2 d浇1次柠檬酸溶液,为期10 d的外源处理。待植株生长到 72 d 收获,将收获的紫云英幼苗用蒸馏水清洗干净,先利用液氮速冻处理然后置于-80 ℃冰箱存放,以便用于生长发育与生理生化指标的测定。
1.2 测定项目与方法
1.2.1 根系发育测定 根冠比:將根及地上部鲜样置于恒温箱内,105 ℃下杀青30 min,70 ℃下烘干至恒质量,称量根系和地上部干质量,计算根冠比。根系活力:采用氯化三苯基四氮唑(TTC)法测定根系活力[19]。
1.2.2 叶片养分测定 磷含量测定:采用钼蓝法[19]测定植株中磷元素含量。叶绿素含量测定:采用丙酮提取法[19]提取植物叶片中的叶绿体色素。
1.2.3 抗氧化系统和渗透调节物质测定 酶活性与渗透调节物质测定方法参照《植物生理学实验》[19]。采用氮蓝四唑法测定超氧化物歧化酶(SOD)活性,愈创木酚氧化法测定过氧化物酶(POD)活性,紫外吸收法测定过氧化氢酶(CAT)活性,采用苯酚法测定可溶性糖含量,采用考马斯亮蓝法测定可溶性蛋白含量。
1.2.4 丙二醛含量测定 采用硫代巴比妥酸法[19]测定丙二醛(MDA)的含量。
1.3 数据统计分析
所有指标均重复测定3次,结果以平均值±标准误差表示。采用Microsoft Excel 2016对数据进行汇总、整理与计算,SPSS 20.0软件进行显著性分析、单因素方差分析和多重检验;采用Graphpad软件进行相关图表制作。
2 结果与分析
2.1 AMF联合不同浓度柠檬酸对幼苗生长及菌根侵染影响
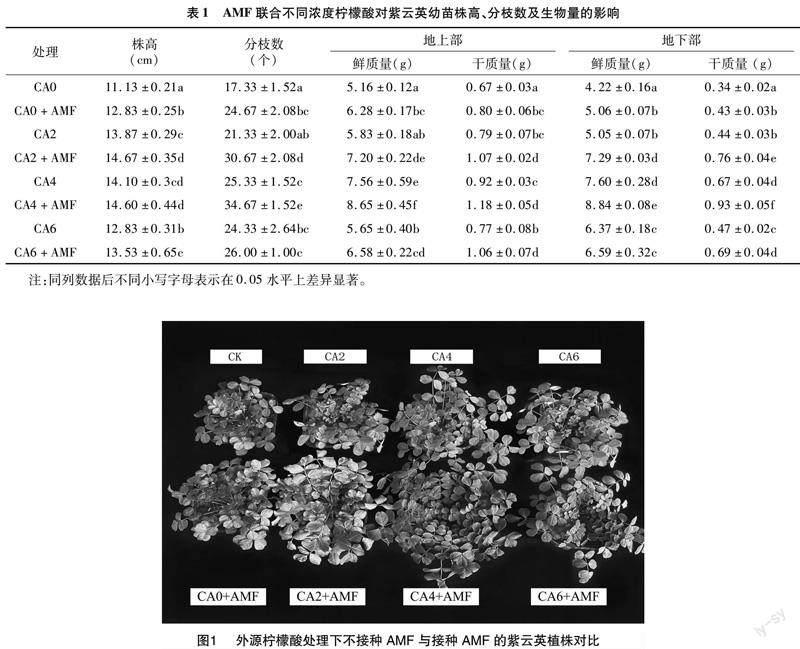
通过双因素交互分析,发现AMF与柠檬酸联合处理均能够显著影响紫云英的株高、分枝数(P<0.05)。在单施柠檬酸的情况下,各浓度与CK组相比,除单施柠檬酸CA2组地上部鲜质量差异不显著(P>0.05)外,其余组别对植株的生物量均具有显著促进作用(P<0.05)。在接菌与联合处理下,与CK组相比,CA0+AM、CA2+AM、CA4+AM、CA6+AM的地上部鲜质量分别提高 21.7%、39.5%、67.8%、27.6%,地上部干质量分别提高20.0%、61.0%、76.5%、59.1%。CA4+AM组的地下部鲜质量和地下部干质量提高效果最佳,与CK组相比分别提高1.09、1.76倍(表1)。
由图1可知,同时接种AMF和添加外源柠檬酸处理下的紫云英生长状况整体要优于CK处理,单独接菌组也优于CK组。且在同一柠檬酸浓度下,联合处理组比单施柠檬酸组促进紫云英生长发育的效果更优。
AM菌根共生体是AMF与宿主植物之间亲和力的象征,从接种AMF的紫云英幼苗根系中可以看到,菌丝进入根部皮层细胞后在细胞内或细胞间延伸和生长发育;在细胞中形成连续分枝的丛枝结构,行使真菌与植物间的营养交换功能;在细胞内或细胞间形成泡囊结构,泡囊是AMF的营养储存器官(图2)。接种摩西斗管囊霉可以较好地侵染紫云英幼苗根系,与植物有良好的营养共生关系。
2.2 AMF联合不同浓度外源柠檬酸对幼苗根系发育影响
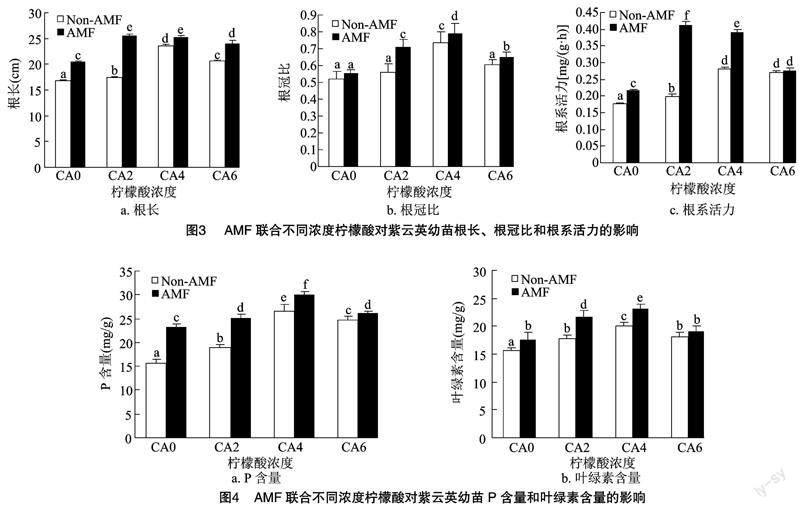
植物根系是植物重要的营养吸收器官,根的发育和活力水平对地上部的生长发育和植株产量有重要影响,根系的生长指标主要包括根长、根冠比、根系活力等。由图3可知,与CK组相比,除单独接菌组与单施柠檬酸的CA2和CA6组根冠比差异不显著(P>0.05),其余组别根长、根冠比和根系活力均具有显著促进作用(P<0.05)。在相同柠檬酸浓度下,联合处理组的根系发育指标均优于单施柠檬酸组。联合处理组与CK组相比,CA2+AM、CA4+AM、CA6+AM组根冠比分别增加36.5%、51.9%、25.0%;联合处理组中幼苗根系活力也具有显著促进作用,与CK组相比,CA2+AM组根系活力达到0.411 mg/(g·h)。2 mmol/L和4 mmol/L浓度的柠檬酸联合接种AMF处理可以有效促进根系发育,而较高浓度(6 mmol/L)柠檬酸促进作用减弱,也间接抑制了AMF对幼苗根系发育的促进作用(图3)。
2.3 AMF联合不同浓度外源柠檬酸对幼苗营养合成的影响
植物磷含量和叶绿素含量是评价植物营养状况与光合作用强弱的重要指标。在单施柠檬酸的情况下,与CK组相比,各浓度组别的磷含量和叶绿素含量均具有显著促进作用(P<0.05),各浓度组别的磷含量分别增加20.4%、69.1%、57.6%;叶绿素分别增加13.1%、28.1%、15.3%。在相同柠檬酸浓度下,联合处理与单施柠檬酸组相比进一步显著增加了幼苗的磷含量和叶绿素含量,且4 mmol/L浓度的柠檬酸联合接种AMF处理组较CK组的促进作用最明显,其磷含量达30.11 mg/g,叶绿素含量达23.21 mg/g(图4)。
2.4 AMF联合不同浓度外源柠檬酸对幼苗抗氧化系统和渗透调节物质的影响
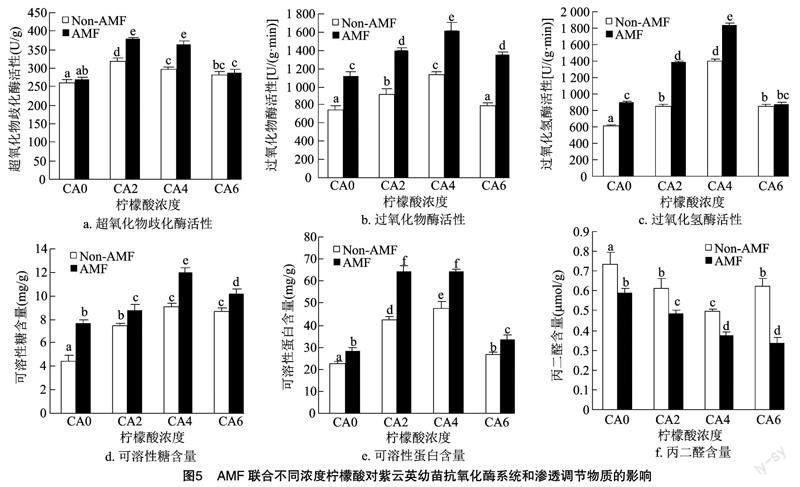
SOD、POD和CAT作为抗氧化酶共同保卫植物细胞的完整性,维持活性氧的相对平衡。与CK组相比,除单接菌组的SOD活性与CA6组的POD活性差异不显著(P>0.05),其他各组别的SOD、POD、CAT活性均具有显著促进作用(P<0.05)。在相同柠檬酸浓度下,联合处理与单施柠檬酸组相比,除6 mmol/L组的SOD活性与CAT活性差异不显著,2 mmol/L和4 mmol/L组的3种抗氧化酶活性和6 mmol/L组的POD活性均有显著提升。联合处理组与CK组相比,3个浓度组别的SOD活性分别提高45.8%、41.0%、11.1%;联合处理下的POD活性和CAT活性与CK组相比也具有显著促进作用(P<0.05),3个浓度组别的POD活性分别提高86.6%、117.1%、80.5.%;3个浓度组别的CAT酶活性分别提高125.3%、198.7%、42.1%(图5)。
可溶性糖與可溶性蛋白是植物细胞中重要的渗透调节物质,其含量多少与植物细胞代谢调节能力强弱呈正相关。在单施柠檬酸的情况下,与CK组相比,各浓度组别的可溶性糖与可溶性蛋白含量均具有显著促进作用(P<0.05)。在相同柠檬酸浓度下,联合处理组的可溶性糖和可溶性蛋白含量均显著高于单施柠檬酸组。联合处理组与CK组相比,各浓度组别的可溶性糖含量分别提高98.0%、172.3%、129.3%,其中CA4+AM组含量达 12.03 mg/g;各浓度组别的可溶性蛋白含量分别提高189.2%、190.0%、50.1%,其中CA4+AM组可溶性蛋白含量达64.52 mg/g(图5)。
膜脂过氧化水平可以由丙二醛(MDA)含量的高低表示,因为MDA是膜脂过氧化产物之一。在单施柠檬酸的情况下,与CK组相比,各浓度组别MDA含量均显著降低(P<0.05)。在相同柠檬酸浓度下,联合处理组的丙二醛含量均显著低于单施柠檬酸组。接菌后各处理组的MDA含量随着施加柠檬酸的浓度递增进一步降低。其中CA4+AM和CA6+AM组差异不大,二者MDA含量分别为0.37、0.34 μmol/g(图5)。
3 讨论
3.1 AMF联合不同浓度柠檬酸对紫云英幼苗生长发育和养分吸收的影响
AM真菌与自然界的大多数植物均可良好共生[20-23],大多数植物生长过程中对外源有机酸相对敏感[24-26],本试验结果进一步证实了前人的研究结论。本研究在紫云英苗期生长发育过程中,单施外源柠檬酸可以提高生物量和促进根部发育,且中等柠檬酸浓度对紫云英的根部发育促进作用最强,较低或过高浓度柠檬酸起到的促进作用会相对较弱,说明外源柠檬酸会影响植物的生长发育,并存在适宜浓度的阈值,这与王鸿燕等对马蔺的研究结果[27]、陈佳等对栝楼的研究结果[28]一致。AMF与柠檬酸联合处理下,更加显著促进植株根部发育和养分吸收,可能是AM真菌调节土壤水分梯度和根际环境来改变紫云英的根构型和细胞壁伸长,促进其生长发育[29],进而促进柠檬酸的利用,同时适当浓度的柠檬酸可以改善植物根部生长发育与细胞环境,还可以促进AMF与根部的共生发育与营养水平的提升。因此,接种AMF与适宜浓度的柠檬酸有助于塑造良好的根系结构,提高根系活力,促进根系吸收磷元素和矿质营养,促进植物进行光合作用,从而增加其叶绿素含量。
3.2 AMF联合不同浓度柠檬酸对紫云英幼苗抗氧化酶活性和渗透调节物质的影响
植物生长过程中不可避免地受到各种逆境胁迫,植物体内抗氧化酶系统和渗透调节物质对体内清除活性氧自由基及维持细胞稳态具有重要作用[30]。本研究单施外源柠檬酸可以提高紫云英幼苗抗氧化酶活性并增加可溶性糖和可溶性蛋白的含量。但高浓度柠檬酸促进作用会相对减弱,可能是由于过高浓度柠檬酸会与土壤中的金属离子产生过度螯合作用对植物逐渐产生不利影响[31];同一柠檬酸浓度下,单施柠檬酸低于AMF与柠檬酸联合处理,二者联合使用更加显著提高植株抗氧化酶系统活性并增加渗透调节物质。Klinsukon等认为,AMF的定殖可以提高桉树幼苗的耐盐能力[32];李娇娇在不同干旱条件下,发现2种AMF(Funneliformis mosseae和Glomus etunicatum)均可以不同程度地提高梨树幼苗渗透调节及抗氧化能力,调节植物内源激素平衡[33];Cesaro 等也发现AM菌根共生体会促进番茄根系有益分泌物和渗透调节物质的增加[34]。本研究结果对上述研究成果也进行了验证,可见接种AMF与适宜的柠檬酸浓度具有一定协同作用,有助于植物抗氧化系统的完善和营养价值的提升。
4 结论
综上,AMF联合适宜浓度柠檬酸可在一定程度上促进覆盖作物紫云英的生长发育并提高其生理生化指标。因此,AMF与该绿色有机酸联合可以考虑作为一种新兴生态环保菌剂施用于紫云英生长时期的农田中,待其翻压后间接影响农作物生长和产量,充分呼应生态农业的理念,也响应农业生产与环境保护同步发展的号召。
参考文献:
[1]Dodd I C,Pérez-Alfocea F. Microbial amelioration of crop salinity stress[J]. Journal of Experimental Botany,2012,63(9):3415-3428.
[2]Bhantana P,Rana M S,Sun X C,et al. Arbuscular mycorrhizal fungi and its major role in plant growth,zinc nutrition,phosphorous regulation and phytoremediation[J]. Symbiosis,2021,84(1):19-37.
[3]Kiers E T,Duhamel M,Beesetty Y,et al. Reciprocal rewards stabilize cooperation in the mycorrhizal symbiosis[J]. Science,2011,333(6044):880-882.
[4]Menezes K M S,Silva D K A,Queiroz M A A,et al. Arbuscular mycorrhizal fungal communities in buffelgrass pasture under intercropping and shading systems in Brazilian semiarid conditions[J]. Agriculture,Ecosystems & Environment,2016,230:55-67.
[5]Belimov A A,Shaposhnikov A I,Azarova T S,et al. Microbial consortium of PGPR,rhizobia and arbuscular mycorrhizal fungus makes pea mutant SGECdt comparable with Indian mustard in cadmium tolerance and accumulation[J]. Plants,2020,9(8):975.
[6]陈保冬,于 萌,郝志鹏,等. 丛枝菌根真菌应用技术研究进展[J]. 应用生态学报,2019,30(3):1035-1046.
[7]Matthias C,Carlos A,Bergmann J,et al. Plant root and mycorrhizal fungal traits for understanding soil aggregation[J]. New Phytologist,2015,205:1385-1388.
[8]Dutta S C,Neog B.Inoculation of arbuscular mycorrhizal fungi and plant growth promoting rhizobacteria in modulating phosphorus dynamics in turmeric rhizosphere[J]. National Academy Science Letters,2017,40(6):445-449.
[9]屈明华,俞元春,李 生,等. 丛枝菌根真菌对矿质养分活化作用研究进展[J]. 浙江农林大学学报,2019,36(2):394-405.
[10]宋金凤,崔晓阳,王政权.低分子有机酸对暗棕壤P、Fe、K有效性及林木吸收的影响[J]. 水土保持学报,2011,25(1):123-127.
[11]刘路路,谭长银,曹雪莹,等. 柠檬酸活化协同伴矿景天-玉米套作对镉轻微污染土壤的修复效果[J]. 农业工程学报,2022,38(7):257-263.
[12]房福力,姚志鹏,林 偉,等. 柠檬酸对温室土壤磷有效性的影响[J]. 农业环境科学学报,2015,34(6):1166-1173.
[13]Xie Z J,Tu S X,Shah F,et al. Substitution of fertilizer-N by green manure improves the sustainability of yield in double-rice cropping system in South China[J]. Field Crops Research,2016,188:142-149.
[14]Coudel A,Alletto L,Tribouillois H,et al. Cover crop crucifer-legume mixtures provide effective nitrate catch crop and nitrogen green manure ecosystem services[J]. Agriculture,Ecosystems & Environment,2018,254:50-59.
[15]施海帆,郭振飞. 紫云英种质资源与遗传育种研究进展[J]. 草业科学,2020,37(12):2507-2519.
[16]黄 晶,高菊生,张杨珠,等. 紫云英还田后不同施肥下的腐解及土壤供钾特征[J]. 中国土壤与肥料,2016(1):83-88.
[17]潘孝晨,唐海明,肖小平,等. 不同耕作和秸秆还田模式对紫云英-双季稻土壤微生物生物量碳、氮含量的影响[J]. 生态环境学报,2019,28(8):1585-1595.
[18]谢志坚,周春火,贺亚琴,等. 21世纪我国稻区种植紫云英的研究现状及展望[J]. 草业学报,2018,27(8):185-196.
[19]肖家欣.植物生理学实验[M]. 合肥:安徽人民出版社,2010.
[20]Begum N,Ahanger M A,Su Y Y,et al. Improved drought tolerance by AMF inoculation in maize (Zea mays) involves physiological and biochemical implications[J]. Plants,2019,8(12):579.
[21]Noceto P A,Bettenfeld P,Boussageon R,et al. Arbuscular mycorrhizal fungi,a key symbiosis in the development of quality traits in crop production,alone or combined with plant growth-promoting bacteria[J]. Mycorrhiza,2021,31(6):655-669.
[22]刘云龙. 丛枝菌根真菌对大豆生长及N2O排放的影响及其机制[D]. 北京:中国农业科学院,2021.
[23]侯殿明. 丛枝菌根真菌对盐渍土辣椒生长、生理代谢及土壤无机磷组分的影响[J]. 江苏农业科学,2022,50(15):101-107.
[24]薛博晗,李 娜,宋桂龙,等. 外源柠檬酸、苹果酸和草酸对披碱草镉耐受及富集的影响[J]. 草业学报,2018,27(6):128-136.
[25]Farid M,Ali S,Rizwan M,et al. Citric acid assisted phytoextraction of chromium by sunflower;morpho-physiological and biochemical alterations in plants[J]. Ecotoxicology and Environmental Safety,2017,145:90-102.
[26]丛俊超,胡华兵,王荣华,等. 不同浓度柠檬酸对甜菜种子的引发影响[J]. 中国农学通报,2022,38(20):13-19.
[27]王鸿燕,佟海英,黄苏珍,等. 柠檬酸和草酸对Pb胁迫下马蔺生长和生理的影响[J]. 生态学杂志,2010,29(7):1340-1346.
[28]陈 佳,韩 杰,郑佳梦,等. 外源柠檬酸对铝胁迫栝楼抗氧化酶系及根尖铝积累的影响[J]. 贵州农业科学,2018,46(2):120-123.
[29]Basyal B,Emery S M.An arbuscular mycorrhizal fungus alters switchgrass growth,root architecture,and cell wall chemistry across a soil moisture gradient[J]. Mycorrhiza,2021,31(2):251-258.
[30]赵若含,陈红卫,欧行奇,等. 不同氮素水平对冬小麦根叶氧化酶活性的影响[J]. 中国农学通报,2020,36(11):1-7.
[31]Qiu L,Gao W L,Wang Z G,et al. Citric acid and AMF inoculation combination-assisted phytoextraction of vanadium (V) by Medicago sativa in V mining contaminated soil[J]. Environmental Science and Pollution Research,2021,28(47):67472-67486.
[32]Klinsukon C,Lumyong S,Kuyper T W,et al. Colonization of arbuscular mycorrhizal fungi improve salinity tolerance of Eucalyptus(Eucalyptus camaldulensis)[J]. Seedlings,2020,331(12):313-327.
[33]李嬌娇. 丛枝菌根真菌对干旱胁迫下梨树幼苗生长以及抗旱性的影响[D]. 重庆:西南大学,2021.
[34]Cesaro P,Massa N,Cantamessa S,et al. Tomato responses to Funneliformis mosseae during the early stages of arbuscular mycorrhizal symbiosis[J]. Mycorrhiza,2020,30(5):601-610.

