地西他滨对AML1-ETO 阳性急性髓系白血病细胞中PD-L2 分子表达的影响
李梦月,邵杨柳,李雨晴,王莉莉,高晓宁
1 解放军总医院第五医学中心血液病医学部,北京 100071;2 解放军医学院,北京 100853;3 解放军总医院第一医学中心血液科,北京 100853
t(8;21)(q22;q22)染色体易位是急性髓系白血病(acute myeloid leukemia,AML)最常见的细胞遗传学异常之一,AML-ETO(A/E)是t(8;21)染色体易位所产生的一种异常融合基因,已被发现与AML 中特异性DNA 甲基化模式相关[1],介导相关靶基因沉默。程序性细胞死亡蛋白-1(programmed cell death protein 1,PD-1)是一种主要在活化T 细胞中表达的免疫抑制受体。程序性细胞死亡蛋白-配体2(programmed cell death-ligand 2,PD-L2)作为PD-1 的配体,与之结合后活化免疫检查点信号通路,对抗T 细胞受体提供的激活信号,发挥免疫抑制作用[2],导致T 细胞耗竭和免疫逃逸,促进AML 难治/复发[3]。
DNA 甲基转移酶抑制剂地西他滨(decitabine,DAC)作为一种DNA 去甲基化药物(hypomethylating agent,HMA),已被应用于治疗AML 及骨髓增生异常综合征(myelodysplastic syndrome,MDS)[4-5]。目前已有多个HMA 联合免疫检查点抑制剂治疗AML 的临床研究[6-7]。我们根据前期生物信息学分析推测,PD-L2 基因启动子区富含CG 位点,故其表达可能受DNA 甲基化调控。本研究分析了A/E阳性AML 细胞系中,PD-L2 启动子甲基化水平及DAC 处理对其表达的影响;并比较了沉默或表达A/E 的细胞系中,DAC 处理对PD-L2 mRNA 表达影响的差异,初步探索A/E 阳性AML 细胞中DNA 甲基化对PD-L2 表达的调控作用,为未来将HMA 与PD-1 抑制剂联合用于复发难治t(8;21)AML 的治疗提供理论依据。
材料与方法
1 材料、试剂与仪器 RPMI Medium 1640 细胞培养基(Gibco),100 × 青霉素-链霉素溶液(Biosharp:BL505A),胎牛血清(Gibco),二甲基亚砜(dimethyl sulfoxide,DMSO;Solarbio:DB 371),DAC(5-氮杂-2’-脱氧胞苷;Merck:A3656),ZnSO4溶液(储存浓度:100 mmol/L),快速逆转录试剂盒(上海奕杉生物科技公司:RT001),TRIzol®Reagent (Ambion:15596026),通用型 KAPA SYBR®FAST qPCR (Roche),Wizard® Genomic DNA Purification Kit (Promega:A1120),GoTaq®Green Master Mix (Promega:M7122),EpiTect®Bisulfite Kits (Qiagen:59104),(BM) Gelred 核酸染料(10 000 ×)、6 × DNA Loading Buffer、50 bp Ladder DNA Marker(北京博迈德基因技术有限公司)。细胞培养箱(Thermofisher),GeneQuant pro紫外/可见光分光光度计(Biochrom),PCR 扩增仪(Applied Biosystems:96 Well Thermal Cycler),实时荧光定量PCR 仪(Stratagene:3000P),电泳仪(北京六一生物科技有限公司:DYY-6C型),全自动数码凝胶图像分析系统(上海天能科技有限公司:Tanon 1600)。
2 细胞来源与培养 A/E 阳性AML 细胞系Kasumi-1,稳定沉默A/E 的细胞系SKNO-1-siA/E及其空载体对照SKNO-1-PGK(A/E 阳性),稳定转染A/E 表达载体的U937A/E 及其空载体对照U937-MT 细胞系均由解放军总医院第一医学中心血液科实验室冻存。U937A/E 细胞系常规培养下仅有微量A/E 蛋白表达,经100 µmol/L 的ZnSO4处理后可使A/E 过表达[8]。细胞复苏后悬于含10%胎牛血清的RPMI 1640 培养液(含100 U/mL 青霉素和100 mg/L 链霉素,pH 值调至7.2~ 7.4)中,置于37℃、5% CO2培养箱中常规孵育,每2~ 3 d换液,分瓶传代继续培养。取对数生长期的细胞用于后续实验。
3 细胞加药处理 取对数生长期的Kasumi-1 或SKNO-1-PGK 或SKNO-1-siA/E 细胞3 × 106个置于培养皿,培养液终体积10 mL,共取4皿。分别向4 皿Kasumi-1 细胞中加入终浓度为0 µmol/L(对照组,采用终浓度为0.1% DMSO)、0.25 µmol/L、1.0 µmol/L 和2.5 µmol/L 的DAC,使4 皿细胞样品中DAC 药物浓度依次递增。将加药处理后的细胞混匀后置于培养箱内,每孵育24 h 收集细胞重新换液并加药,至72 h 后收集细胞进行后续硫化修饰后测序(bisulfite sequencing,BSP)和逆转录实时定量PCR(quantitative reverse transcription PCR,RT-qPCR)实验。U937-MT、U937A/E、U937A/E +ZnSO4细胞系只设置对照组与2.5 µmol/L DAC 处理组,余步骤同前。U937A/E+ZnSO4细胞系中ZnSO4浓度为100 µmol/L,每孵育24 h 收集细胞重新换液加入ZnSO4及药物。
4 DNA 提取、BSP 检测甲基化水平 收集适量处理后的Kasumi-1、SKNO-1-PGK 细胞,按Wizard®Genomic DNA Purification Kit 说明书提取总DNA,用紫外分光光度计以DNA260/280的比值进行DNA样品的纯度判定与浓度测定。DNA 纯度和浓度合格者利用EpiTect®Bisulfite Kits 进行DNA 的亚硫酸氢盐处理及纯化回收。利用DNA 模板、PD-L2 BSP 引物、GoTaq®Green Master Mix 进行BSP 反应,反应体系为25 µL,扩增条件:95℃预变性2 min;然后95℃变性30 s,58℃退火30 s,72℃延伸30 s,共进行35 个循环,最终72℃延伸5 min。采用MethPrimer 软件(http://www.urogene.org/cgi-bin/methprimer2)对PD-L2 基因转录起始位点及上游2 000 bp 的序列进行CpG 位点分析,并设计BSP 引物,所用引物如下,PD-L2 BSP 上游引物:5'-AGAGAATGGTAATTTTTAAGGAAAT-3';PD-L2 BSP 下游引物:5'-AACCTAAATAATCAAT CCTTCTCCTAC-3',产物长度400 bp,引物由北京博迈德基因技术有限公司合成。将扩增产物进行琼脂糖凝胶电泳以鉴定、分离DNA,交由北京博迈德基因技术有限公司进行TA 克隆与产物测序(每种细胞系各筛选20 个菌落进行测序),以进行DNA 甲基化分析。
5 总RNA 提取及RT-qPCR检测mRNA表达收集处理后的Kasumi-1、SKNO-1-PGK、SKNO-1-siA/E、U937-MT、U937A/E、U937A/E+ZnSO4细胞,Trizol 一步法提取细胞总RNA。用紫外分光光度计以RNA260/280的比值进行RNA 样品的纯度判定与浓度测定。RNA 纯度和浓度合格者使用RNA 快速逆转录试剂盒制备cDNA,KAPA SYBR®FAST qPCR 试剂盒完成RT-qPCR 检测。以GAPDH作为内参基因,反应体系为20 µL,扩增条件:95℃预变性20 s;然后95℃变性3 s,60℃退火20 s,72℃延伸20 s,共进行40 个循环,最终72℃延伸15 min。引物由北京博迈德基因技术有限公司合成,所用引物如下,GAPDH 上游引物:5'-CTCTGGTAAAGTGGATATTGT-3',GAPDH 下游引物:5'-GGTGGAATCATATTGGAACA-3'。PDL2 上游引物:5'-ATTGCAGCTTCACCAGATAGC-3',PD-L2 下游引物:5'-AAAGTTGCATTCCAGG GTCAC-3'。反应结束后根据熔解曲线判断扩增产物,记录各组Ct值,目的基因相对表达量应用2-△△Ct公式计算,△△Ct=(Ct 处理组目的基因 -Ct处理组内参基因) -(Ct 对照组目的基因 -Ct 对照组内参基因),比较mRNA 的相对表达含量。每组实验独立重复3次。
6 生物信息学及统计学分析 利用JASPAR 数据库(http://jaspar.genereg.net)预测PD-L2 基因启动子区域转录因子结合位点。本研究所有数据均采用SPSS 21.0 统计软件进行分析,计量资料以±s表示,两组间量的比较采用两独立样本t检验,多组间差异比较使用多组计量资料的秩和检验(K-W检验),P<0.05 为差异有统计学意义。影响性分析采用直线回归分析,以决定系数r2表示,r2越接近1,引入相关的效果越好。采用GraphPad Prism 8.0 软件进行作图。
结果
1 A/E 阳性AML 细胞系PD-L2 DNA 启动子区特异性位点的甲基化水平及DAC 处理后的水平变化 生物信息学分析显示,在PD-L2 基因转录起始位点上游2 000 bp 及5’端非翻译区可预测到7 个潜在的转录因子AML1 结合位点,启动子序列分析后显示PD-L2 启动子区富含CG 位点(图1),故PD-L2 基因表达可能分别受A/E 和DNA 甲基化调控。为明确PD-L2 基因启动子区是否受DNA甲基化调控,采用BSP 检测对照组(0.1% DMSO)及2.5 µmol/L DAC 处理的Kasumi-1 和SKNO-1-PGK 细胞系中PD-L2 DNA 启动子区特异性位点的甲基化水平,测序结果显示,PD-L2 DNA 启动子区呈高甲基化水平(Kasumi-1 和SKNO-1-PGK 分别为94.3%、88.6%),DAC 处理后DNA 甲基化水平下降(Kasumi-1 和SKNO-1-PGK 分别为90.7%、83.6%),见图2。
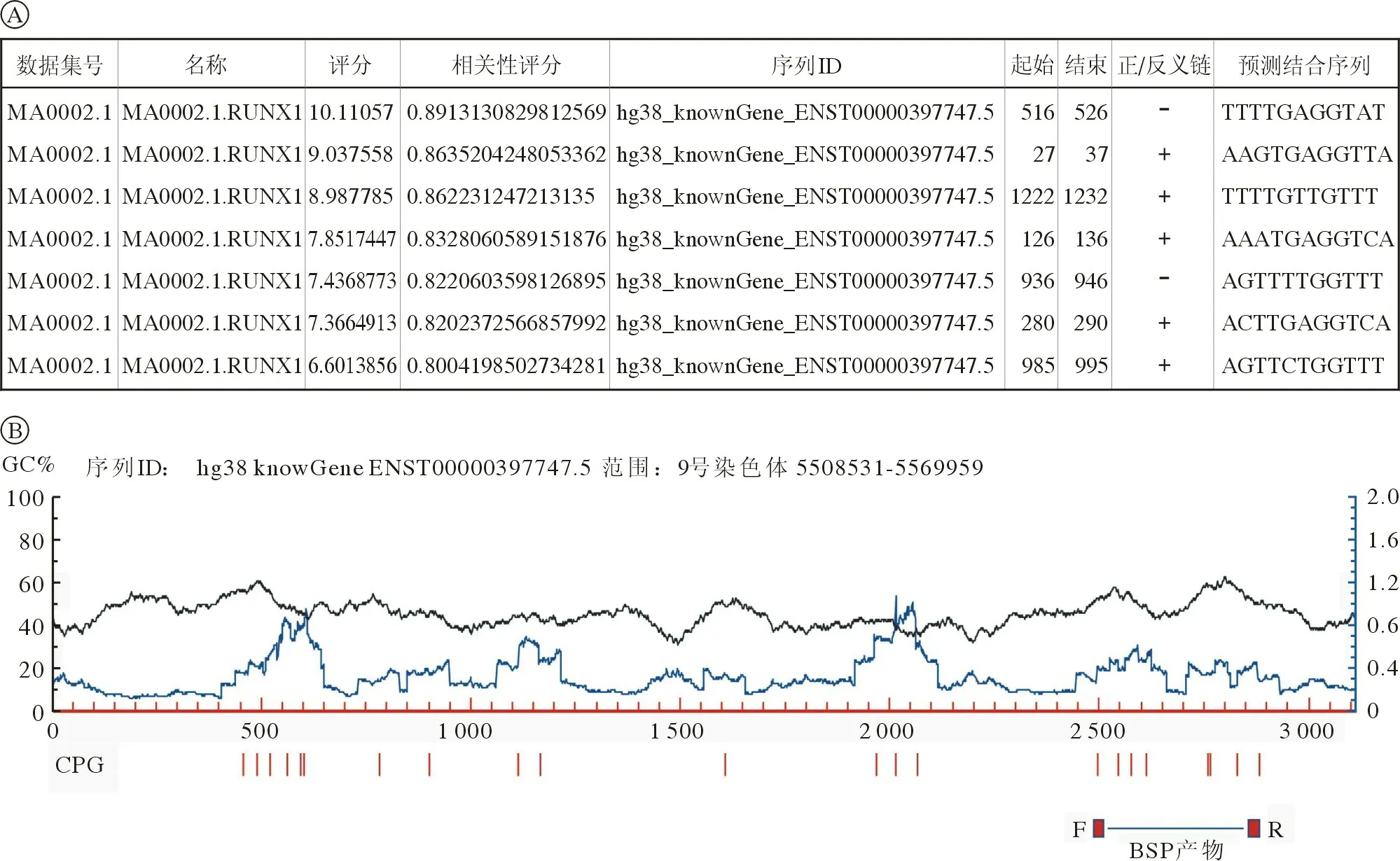
图1 JASPAR 数据库预测PD-L2 基因启动子区存在潜在转录因子AML1 结合位点(A);启动子序列分析显示PD-L2 基因启动子区富含CG 位点(B)Fig.1 JASPAR database predicts the presence of potential transcription factor AML1 binding sites in PD-L2 gene (A);Promoter sequence analysis shows that the promoter region of PD-L2 gene is enriched with CG sites (B)

图2 A/E 阳性AML 细胞系PD-L2 DNA 启动子区特异性位点的甲基化水平及DAC 处理后的水平变化(黑圈和空圈分别代表甲基化和非甲基化CpG 二核苷酸)(A);DAC 处理前后PD-L2 BSP 扩增产物琼脂糖凝胶电泳图(B);DAC 处理前后PD-L2 DNA 启动子区基因组测序序列图(C)Fig.2 Methylation level of PD-L2 DNA promoter region specific sites in A/E positive AML cell lines and changes in the level after decitabine treatment (A);Agarose gel electrophoresis of PD-L2 BSP amplification products before and after decitabine treatment (B);Sequencing of PD-L2 DNA promoter region genome before and after decitabine treatment (C)
2 DAC 对A/E 阳性AML 细胞系PD-L2 mRNA表达的影响 RT-qPCR 检测对照组(0.1% DMSO)及2.5 µmol/L DAC 处理后细胞系中PD-L2 mRNA水平。结果显示,2.5 µmol/L 浓度组PD-L2 mRNA的相对表达水平(Kasumi-1:4.75 ± 1.13;SKNO-1-PGK:3.52 ± 0.87;SKNO-1-siA/E:4.78 ± 0.54;U937-MT:3.09 ± 0.85;U937A/E:29.18 ± 23.90;U937A/E+ZnSO4:1.31 ± 0.22)显著高于对照组(Kasumi-1:1,P=0.007,t=6.623;SKNO-1-PGK:1,P=0.010,t=5.791;SKNO-1-siA/E:1,P<0.001,t=15.656;U937-MT:1,P=0.051,t=4.256;U937A/E:1,P=0.034,t=2.888;U937A/E+ZnSO4:1,P=0.037,t=3.087)。见图3。
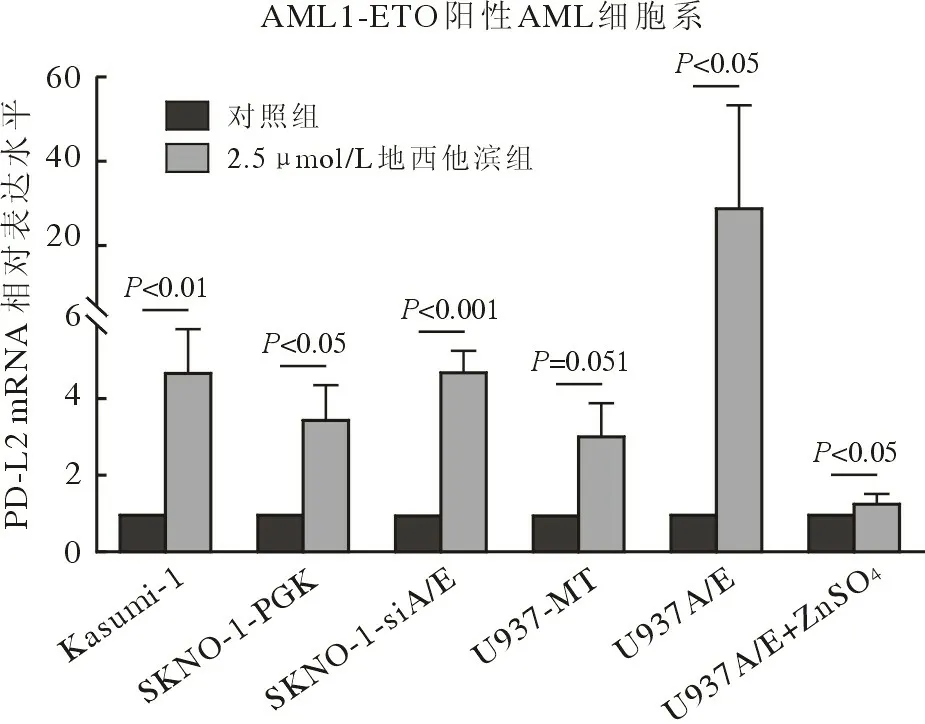
图3 DAC 对A/E 阳性AML 细胞系PD-L2 mRNA 表达的影响Fig.3 Effect of decitabine on PD-L2 mRNA expression in A/E positive AML cell lines
3 沉默或过表达A/E 后DAC 对A/E 阳性AML细胞系PD-L2 mRNA 表达的影响 RT-qPCR 检测SKNO-1-PGK 和 SKNO-1-siA/E 细胞系 PD-L2 mRNA 表达量,结果显示,后者在沉默A/E 后细胞PD-L2 mRNA 表达水平上升(SKNO-1-siA/E 细胞系PD-L2 mRNA 表达量较SKNO-1-PGK 升高129.1%),见图4A。RT-qPCR 检测U937-MT 和U937A/E 细胞系PD-L2 mRNA 表达量,结果显示,后者在表达A/E 后细胞PD-L2 mRNA 表达水平降低(U937A/E 细胞系PD-L2 mRNA 表达量较U937-MT 下降60.9%),见图4B。RT-qPCR 检测对照组(0.1% DMSO)及2.5 µmol/L DAC 处理后的两对A/E 沉默(SKNO-1-PGK,SKNO-1-siA/E)/诱导细胞系(U937A/E,U937A/E+ZnSO4)的PD-L2 mRNA 水平,结果显示,2.5 µmol/L DAC 处理后,SKNO-1-siA/E 细胞中PD-L2 mRNA 相对表达水平上升幅度高于SKNO-1-PGK 细胞(SKNO-1-siA/E 与SKNO-1-PGK 相比上升35.80%),U937A/E+ZnSO4细胞中则显著低于U937A/E 细胞(U937A/E+ZnSO4与U937A/E 相比下降95.51%),即A/E 沉默/低表达细胞中PD-L2 mRNA 的表达水平高于同组A/E阳性/过表达细胞(处理组SKNO-1-siA/Evs处理组SKNO-1-PGK,P=0.031;处理组U937A/E +ZnSO4vs处理组U937A/E,P=0.036),见图5。
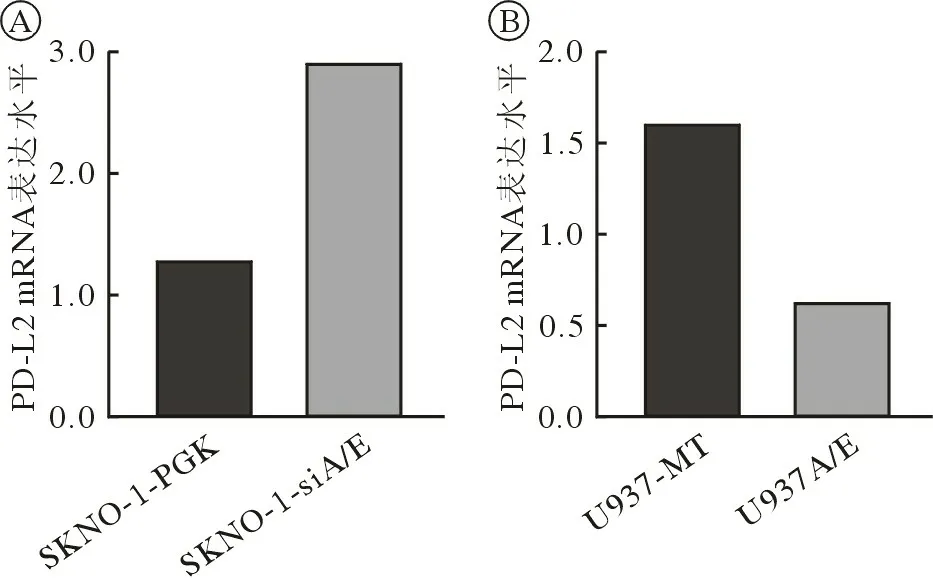
图4 沉默(A)或表达(B)A/E 后细胞PD-L2 mRNA 表达水平的变化(PD-L2 mRNA 表达量=2-△△Ct)Fig.4 Changes in expression level of PD-L2 mRNA after silencing(A) or expression (B) of A/E (PD-L2 mRNA expression=2-△△Ct)
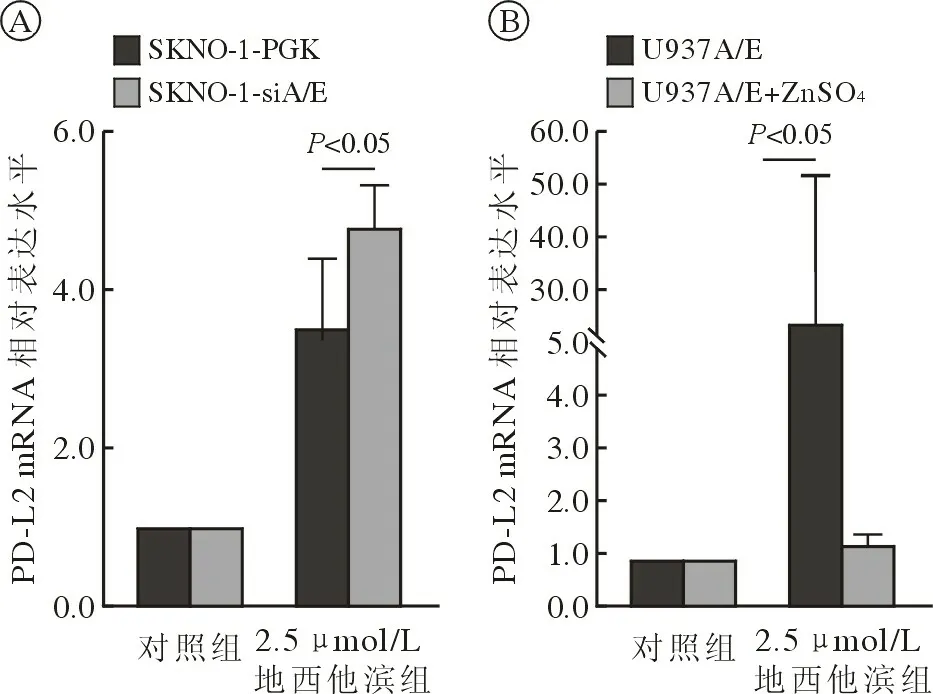
图5 沉默(A)或过表(B)A/E 后DAC 对A/E 阳性AML 细胞系PD-L2 mRNA 表达的影响Fig.5 Effect of DAC on PD-L2 mRNA expression in A/E-positive AML cell lines after silencing (A) or overexpression (B) of A/E
4 不同浓度DAC 对A/E 阳性AML 细胞系PDL2 mRNA 表达的剂量影响 RT-qPCR 检测对照组(0.1% DMSO)及不同浓度(0.25 µmol/L、1.0 µmol/L和2.5 µmol/L) DAC 处理后的A/E 阳性AML 细胞系Kasumi-1、SKNO-1-PGK 中PD-L2 mRNA 水平。RT-qPCR 检测结果显示,在Kasumi-1、SKNO-1-PGK 细胞系中PD-L2 mRNA 的表达水平随DAC浓度增加而升高(Kasumi-1:r2=0.992;SKNO-1-PGK:r2=0.963;SKNO-1-siA/E:r2=0.991),呈剂量依赖性,见图6。由于各独立样本未满足方差分析条件,采用多组计量资料秩和检验(K-W 检验),各组间差异有统计学意义(Kasumi-1:P=0.002,χ2=14.328;SKNO-1-PGK:P=0.002,χ2=14.328;SKNO-1-siA/E:P=0.001,χ2=17.561)。
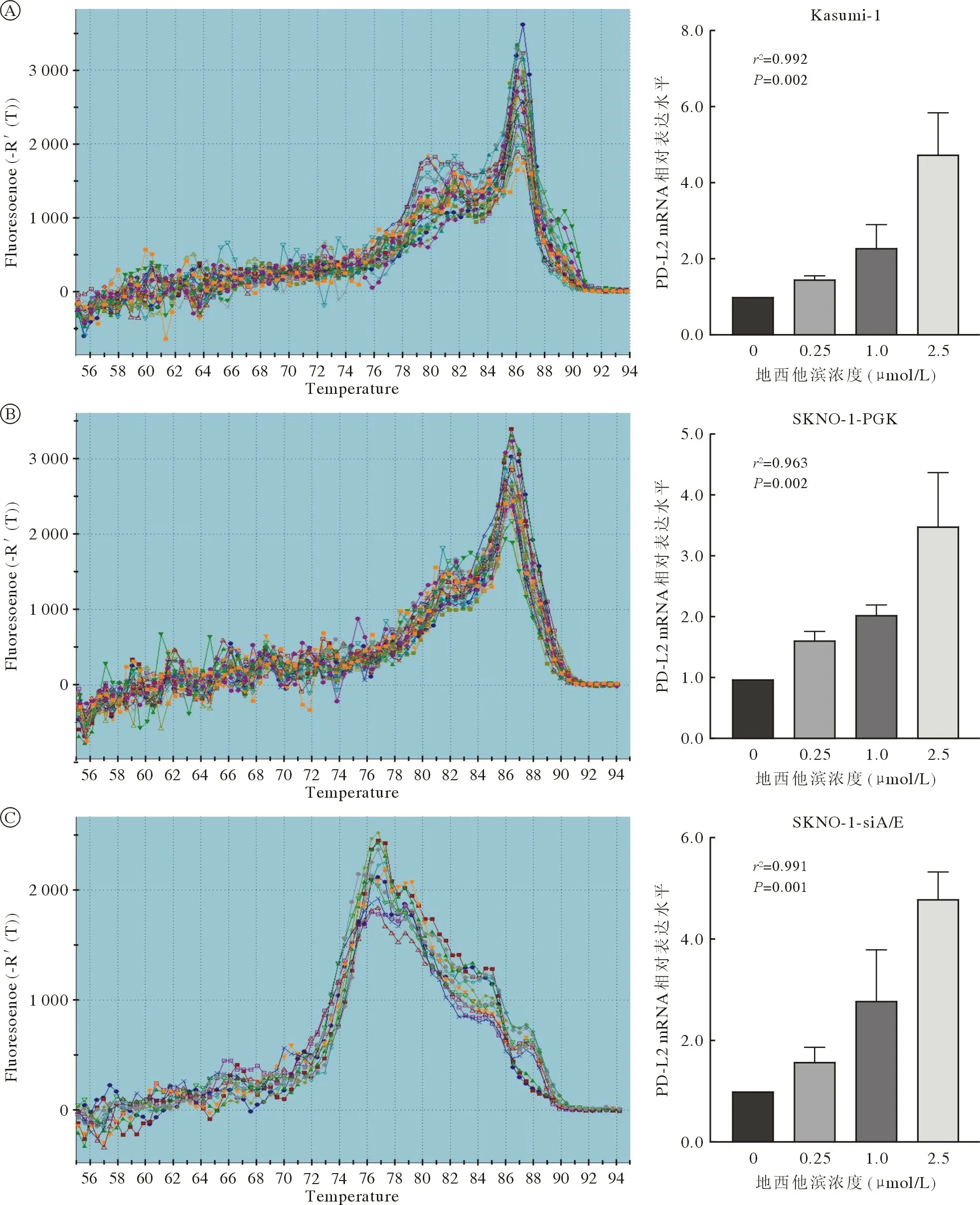
图6 A/E 阳性AML细胞系Kasumi-1 (A)、SKNO-1-PGK (B)、SKNO-1-siA/E (C) PD-L2 mRNA 的RT-qPCR 熔解曲线图及不同浓度DAC 对各细胞系PD-L2 mRNA 表达的影响(各细胞系的各组间差异存在统计学意义)Fig.6 RT-qPCR dissociation curve of PD-L2 mRNA and effect of different concentrations of decitabine on PD-L2 mRNA expression in A/E positive AML cell lines: Kasumi-1 (A),SKNO-1-PGK (B),SKNO-1-siA/E (C) (The differences between the groups of different cell lines were statistically significant)
讨论
t(8;21) AML 是一种具有基因及表观遗传学改变的克隆性疾病,占新诊断AML 病例的7%~12%[9-10],其生物异质性对预后判断和治疗选择至关重要[11]。t(8;21) AML 属于预后相对较好类型,与过去相比,超过80%的患者在强化化疗后获得完全缓解,但仍有约40%达到完全缓解的患者出现复发,复发的中位时间为2.5年[12-13],一旦复发,则预后很差[14-15]。研究显示,单独应用HMA 治疗复发/难治AML 患者的平均应答率不足20%[16-17],且耐药情况比较普遍[5,18]。因此,开发新的HMA 联合用药方案,提高应答率和降低耐药性具有重要临床意义。HMA 通过使DNA 去甲基化,重新激活被DNA 甲基化沉默的抑癌基因,是其发挥作用的关键机制[19-20]。研究显示,白血病患者经HMA 治疗后,白血病细胞表面免疫检查点分子PD-1、PD-L1、PD-L2 和CTLA4 基因表达增加,PD-L2 上调者生存期短[21]。已知免疫检查点抑制剂,如PD-1 抑制剂,可以通过结合免疫检查点分子而抑制PD-1/PD-L1/2 信号通路活化,进而激活细胞毒性T 细胞,起到杀伤白血病细胞的作用[22]。上述机制为将HMA 与免疫检查点抑制剂联合应用于白血病的治疗奠定了理论基础。免疫逃逸是AML 难治复发的重要分子机制,免疫检查点PD-1 与其配体PD-L1/2 相互作用,显著抑制T 细胞增殖和细胞因子产生[23],使肿瘤向T 细胞发出负性信号,诱导T 细胞耗竭[24-26],促进免疫逃逸。近年来,尽管已有将HMA 与PD-1 抑制剂联合用于难治复发AML 治疗的临床研究[6],但应答率仅为30%左右。如果我们能够预测哪一类患者更可能会获益于这种治疗,将有助于指导个体化治疗。
通过BSP 分析,我们证实了在A/E 阳性AML细胞系中,PD-L2 DNA 启动子区的确呈DNA 高甲基化分布,DNA 甲基转移酶抑制剂DAC 可使其去甲基化,提示A/E 阳性AML 细胞中PD-L2基因的表达很可能受DNA 甲基化调控。为进一步证实DAC 对A/E 阳性AML 细胞PD-L2 分子表达的影响,我们检测了DAC 处理前后PD-L2 基因mRNA 表达变化,证实去甲基化处理可使细胞PD-L2 基因mRNA 表达呈浓度依赖性增加,提示A/E 阳性细胞中PD-L2 基因的表达受DNA 甲基化调控。已报道的研究和本项目组的研究结果均显示,A/E 融合蛋白中的AML1 结构域可与野生型转录因子AML1 竞争靶基因上相应结合位点[27],而ETO 通过其锌指结构域募集转录抑制复合物,进而促进DNA 甲基化和组蛋白去乙酰化,导致靶基因表达沉默[28-32]。已报道的临床研究显示,DAC 治疗使AML 细胞PD-L2 基因表达增加,与DAC 浓度呈正相关,DAC 治疗可使MDS/AML 患者PD-L2 mRNA 表达增加,且PD-L2 表达上调者的总体生存率低于PD-L2 表达不上调者,PD-L2的高表达与AML 患者总体生存不佳相关[21,33]。这与我们的实验结果一致,提示去甲基化药物诱导的A/E 阳性AML 中PD-L2 的上调参与了AML 的发展,并可能与AML 患者的HMA 治疗抵抗相关。
为进一步分析A/E 阳性AML 中PD-L2 与DNA 基化调控的关系,我们进一步对比了沉默或过表达A/E 的细胞系对DAC 诱导PD-L2 mRNA表达作用的差异,我们发现沉默A/E 的SKNO-1-siA/E 细胞中PD-L2 mRNA 表达水平更高,过表达A/E 的U937A/E 细胞中PD-L2 mRNA 表达水平较低,提示A/E 可能介导了PD-L2 的DNA 甲基化沉默。此外,对于A/E 表达水平不同的细胞,DAC 处理后其PD-L2 mRNA 的表达水平变化也有所差异,表现在虽然DAC 可诱导多个A/E 阳性AML 细胞系PD-L2 表达上调,但A/E 阴性/低表达细胞PD-L2 mRNA 表达水平上升幅度显著高于同组A/E 阳性/过表达细胞,加之PD-L2 基因存在可能的AML1 结合位点,提示A/E 可能通过募集转录抑制复合物参与介导了PD-L2 基因的DNA 甲基化沉默。文献报道,t(8;21)染色体重排的存在和A/E 融合基因的产生,在白血病中存在预测不同患者结局的特定DNA 甲基化谱[1],其潜在机制涉及A/E 与DNA 甲基转移酶和某些转录因子形成复合物,以抑制目标肿瘤抑制基因[8]。
综上,我们的实验验证了先前的推测,即A/E 阳性AML 细胞中PD-L2 基因的表达受DNA甲基化调控,这为下一步研究A/E 融合蛋白对PD-L2 表达的直接或间接调控作用奠定了基础。阐明A/E 与PD-L2 基因之间的表达调控关系可为未来将HMA 和PD-1 抑制剂联合用于t(8;21)AML 的治疗提供理论依据。
作者贡献李梦月:实验设计者和实验研究执行人,完成数据分析,论文初稿的写作与修改;邵杨柳:提供实验技术督导,参与实验结果分析;李雨晴:在实验材料准备及数据核对方面给予帮助;王莉莉:提供实验环境及实验设备;高晓宁:项目的构思者及负责人,指导实验设计、数据分析、论文审阅。全体作者阅读并同意最终版论文。
利益冲突所有作者声明没有利益冲突。
数据共享声明本研究中生物信息学资料来源于公共数据库(http://jaspar.genereg.net),其余支持研究结果的数据可由相应的作者在合理要求下联系通信作者获得。

