阴道微生态改变与高危型人乳头瘤病毒感染的相关性研究
李莉,马莹,付玉荣,于东渤,王铭洋,郑文瑾,翟青枝
解放军总医院第一医学中心妇产科,北京 100853
女性阴道微生态是由阴道微生物菌群、宿主的内分泌系统、阴道解剖结构及阴道局部免疫系统共同组成的生态系统[1],具有动态变化特征,并受月经、年龄、雌激素水平、性交频率等多种因素影响。正常阴道微生物群能维持阴道正常酸性环境,抑制病原体生长,一旦菌群结构失衡,就会增加生物个体感染各种生殖系统疾病的风险[2]。已有研究表明阴道微生态环境失衡与宫颈鳞状上皮内病变(squamous intraepithelial lesion,SIL)甚至宫颈癌变的发生发展有关[3]。高危型人乳头瘤病毒(high risk human papillomavirus,HR-HPV)持续感染是宫颈发生癌前病变甚至进展为癌变的主要原因[4]。阴道微生态是HPV 入侵宫颈的第一道防线,HR-HPV 感染可能与机体阴道微生态平衡存在一定的相关性。本研究旨在分析阴道微生态指标与HR-HPV 感染的相关性,以期为宫颈癌的防治提供参考。
资料与方法
1 资料 收集2021 年10 月-2022 年3 月于解放军总医院第一医学中心妇产科同时行阴道分泌物微生态及人乳头瘤病毒基因分型检测的病例324例。纳入标准:(1)有性生活史,知情同意并配合者;(2) 24 h 内无性生活、盆浴、阴道灌洗及局部上药等;(3)近两周内未使用过抗生素。排除标准:(1)月经期或不规则阴道出血;(2)妊娠期或哺乳期;(3)合并或继发其他肿瘤、严重妇科疾病及内分泌系统疾病;(4)意识不清及不能配合者。本研究通过解放军总医院伦理委员会批准(No.S2021-168-01),所有研究对象均知情同意,所有检测均在本科实验室完成。
2 阴道微生态检测 标本采集:受检者取膀胱截石位,少量0.9%氯化钠注射液润滑窥阴器后放入阴道内,充分暴露阴道壁和宫颈,用无菌棉拭子在阴道侧壁的上1/3 处刮取适量分泌物,置入试管。
检测方法:采用湖南友哲科技有限公司自主研发的全自动GY66 阴道微生态检测仪及配套的阴道炎联合检测试剂盒(酶化学反应法)进行检测。经过自动加样、自动制片染色、试纸功能学颜色判读、智能聚焦与深度识别分类计数等流程后,得到形态学分析结果及功能学分析结果,经GY6.01 软件进行综合分析最终判读。
3 人乳头瘤病毒基因分型检测 标本采集:体位同前。暴露宫颈,以无菌棉拭子擦去子宫颈口过多分泌物,专用子宫颈刷置于宫颈管内,以顺时针方向转动5 圈的方式在受检者宫颈鳞柱交界处采集脱落上皮细胞,置入装有HPV 保存液的标本瓶中。
检测方法:采用上海之江生物科技股份有限公司生产的HPV 分型核酸测定试剂盒及SLAN-96S实时荧光定量PCR 检测系统,经核酸提取、基因扩增等流程,对15 种HPV 高危亚型(16,18,56,45,35,59,39,51,58,52,31,33,68,66和 82)的特异性DNA 核酸片段进行分型检测。
4 全自动GY66 阴道微生态检测仪结果判读 微生态正常:阴道菌群密集度为++/+++、菌群多样性为++/+++、优势菌为乳杆菌、pH 为3.8~ 4.5、功能学指标(包括多胺、唾液酸苷酶、白细胞酯酶等)阴性、Nugent 评分为0~ 3 分、AV 评分为0~ 2 分;
微生态异常参照阴道微生态评价的临床应用专家共识[1],报告分为阴道微生态正常和阴道微生态异常,异常包括菌群抑制、细菌性阴道病(bacterial vaginosis,BV)、BV 中间型、滴虫性阴道炎(trichomonas vaginitis,TV)、需氧菌性阴道炎(aerobic vaginitis,AV)、外阴阴道假丝酵母菌病(vulvovaginal candidiasis,VVC)、微生态菌群正常存在炎症反应等。
5 SLAN 荧光定量PCR 检测系统结果判读 检测试剂:分为混合液1(16、56、31型+IC)、混合液2(18、52、58、68型)、混合液3(45、82、33、35型)、混合液4(39、51、59、66型)。
检测结果判读:(1)当待检样本经FAM 通道、VIC 通道、610 通道、Cy5 通道检测后Ct 值≤38,且扩增曲线呈典型的S形,则判断为对应型别的阳性;(2)当待检样本在混合液1 的CY5 通道Ct 值≤32,且在混合液1 的其余通道以及其余混合液的各通道Ct 栏都显示NO Ct,检测样本判定为阴性;(3)当待检样本Ct 值为38~40,需重复测定,如仍在38~ 40 范围内,且扩增曲线呈典型的S形,则判断为阳性,若呈非典型的S形,则判断为阴性。
6 分析指标 选取阴道微生态异常指标中样本量大于30 的BV 及BV 中间型组、菌群抑制组、菌群正常存在炎症反应组,分别与微生态正常组的HR-HPV 阳性率进行比较。
7 统计学分析 采用SPSS 26.0 软件进行数据分析。计数资料用例数(百分比)表示,组间比较采用χ2检验;危险因素进行logistic 回归分析。P<0.05为差异有统计学意义。
结果
1 阴道微生态异常组与阴道微生态正常组的HRHPV 阳性率比较 同时行阴道微生态及HPV 检测的324 例患者,年龄21~ 72岁。HR-HPV 阳性71例,阳性率为21.91%(71/324)。阴道微生态异常的146 例患者(年龄21~ 72 岁)中HR-HPV 阳性28例,阳性率为19.18%(28/146),阴道微生态正常的178 例患者(年龄21~ 68 岁)中HR-HPV阳性43例,阳性率为24.16%(43/178),两组差异无统计学意义(χ2=1.162,P=0.281)。见表1。

表1 阴道微生态异常组与正常组HR-HPV 阳性率比较Tab.1 Comparison of positive rate of HR-HPV between the abnormal vaginal microecology group and the normal group
2 BV 及BV 中间型组与阴道微生态正常组的HR-HPV 阳性率比较 BV 及BV 中间型组HR-HPV阳性37例,阳性率40.54%(15/37),显著高于阴道微生态正常组,两组差异有统计学意义(χ2=4.174,P=0.041)。见表2。

表2 BV 及BV 中间型组与阴道微生态正常组HR-HPV 阳性率比较Tab.2 Comparison of positive rate of HR-HPV between the BV/intermediate BV group and normal group and the normal vaginal microecology group
3 菌群抑制组与阴道微生态正常组的HR-HPV阳性率比较 菌群抑制组HR-HPV 阳性32例,阳性率18.75%(6/32),与阴道微生态正常组比较,差异无统计学意义(χ2=0.443,P=0.506)。见表3。
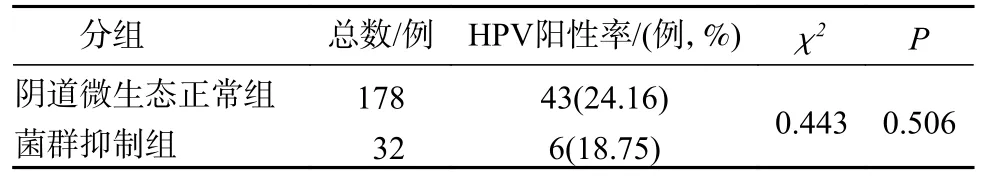
表3 菌群抑制组与阴道微生态正常组HR-HPV阳性率比较Tab.3 Comparison of positive rate of HR-HPV between the flora inhibition group and the normal vaginal microecology group
4 阴道菌群正常存在炎症反应组与阴道微生态正常组的HR-HPV 阳性率比较 阴道菌群正常存在炎症反应组HR-HPV 阳性77例,阳性率9.09%(7/77),显著低于阴道微生态正常组,两组差异有统计学意义(χ2=7.740,P=0.005)。见表4。

表4 阴道菌群正常存在炎症反应组与阴道微生态正常组HR-HPV 阳性率比较Tab.4 Comparison of positive rate of HR-HPV between the normal vaginal flora+inflammatory reaction group and the normal vaginal microecology group
5 HR-HPV 感染作为因变量进行logistic 回归分析 采用logistic 回归(向前LR,进入P<0.05,排除为P>0.10)进行自变量的选择和剔除。回归结果显示BV 及BV 中间型是HR-HPV 感染的危险因素(OR=2.240,P=0.030),阴道菌群正常存在炎症反应是HR-HPV 感染的保护因素(OR=0.329,P=0.009)。见表5。

表5 Logistic 回归分析HR-HPV 感染的影响因素Tab.5 Logistic regression analysis of influencing factors of HR-HPV infection
讨论
女性阴道微生物菌群种类多、数量大,菌群与菌群之间相互制约、相互作用、相互依赖,维持阴道微生态动态平衡[5]。正常情况下,乳杆菌是阴道微生物中的优势菌,可分解阴道上皮细胞内糖原,生成乳酸使阴道的pH 值下降,从而维持弱酸性环境起到保护的作用,还能够产生过氧化氢,使阴道免受病原体和其他非正常定植微生物的感染[6]。HPV 在低pH 环境下难以高效存活,故正常的阴道酸性环境本身就有利于清除HPV 或延缓其复制。
越来越多的研究表明,阴道微生态失衡会继发下生殖道感染,破坏防御屏障会增加HPV 感染概率,而HPV 的持续感染与宫颈上皮内瘤变及子宫颈癌的发生密切相关。中华医学会妇产科学分会感染性疾病协作组推荐采用阴道微生态评价系统对下生殖道感染进行检测[7]。本实验室采用全自动GY66 阴道微生态检测仪统一判读阴道微生态结果,前期研究显示其与传统的人工镜检方法一致性好,还能避免常规镜检因人为主观因素造成的漏检和误判,提高了阴道分泌物分析的效率和质量[8]。
BV 是临床常见的阴道内正常菌群失调导致的混合感染,是由乳杆菌减少或消失,厌氧菌、阴道加德纳菌等增多引起的阴道微生态失调综合征[9]。BV 患者阴道分泌物中存在大量黏蛋白降解酶,导致阴道pH 升高,局部黏膜屏障被破坏后,病毒黏附增加,大量繁殖甚至整合进宿主基因组,从而增加HPV 感染的易感性[10]。此外,HPV 可通过皮肤黏膜微损伤入侵鳞状上皮基底层细胞,阴道内的普氏菌属和类杆菌可产生神经氨酸酶,其作用是协助成熟的病毒颗粒脱离宿主细胞,进而感染新的上皮细胞,造成病毒在患者体内的扩散[11]。研究表明,BV 患者阴道分泌物中的厌氧菌代谢会释放有致癌作用的亚硝基胺,存在高浓度的磷脂酶A2 可增加HPV 的易感性,也就增加了病毒潜伏期和清除难度[12]。本研究中BV 组HR-HPV 阳性率显著高于阴道微生态正常组。BV 所引起的菌群失调增加了HPV 的感染率。前期研究证实,从HR-HPV 感染到各级别宫颈上皮内病变的患者,其阴道分泌物中加德纳菌丰度显著增高,且与疾病进展相关[13]。很多学者的研究发现,HPV 阳性的患者阴道微生态呈现更高的多样性,乳杆菌数量显著降低,多种厌氧菌属过度增殖,进一步加重了阴道内菌群紊乱,两者互为因果,形成恶性循环[14]。
本研究中阴道菌群正常存在炎症反应组的HR-HPV 阳性率显著低于阴道微生态正常组,与黄艳艳等[15]的研究结果一致。阴道细胞在某些致炎因素作用下,本身就可分泌细胞因子,在阴道局部免疫过程中发挥重要作用。IL-8 是一种由巨噬细胞和上皮细胞分泌的细胞因子,对中性粒细胞有细胞趋化作用,可实现对炎症反应的调节;Th1 细胞可激活巨噬细胞和中性粒细胞,增强吞噬杀菌作用,发挥免疫保护功能;IL-17 作为Th17细胞的主要效应因子,能动员、募集及活化感染部位的中性粒细胞,从而有效介导组织的炎症反应,促进抗菌肽β-防御素的释放,维持黏膜细胞的完整性,防止感染[16]。因此可以推测白细胞的增多加强了阴道局部的免疫保护功能,从而抑制了HR-HPV 感染,其详细机制有待深入观察和研究。
阴道微生态异常还包括菌群抑制,是指待检标本内细菌显著减少,表现为无优势菌,菌群密集度≤Ⅰ级,菌群多样性≤Ⅰ级。本研究中菌群抑制组与阴道微生态正常组的HR-HPV 阳性率差异无统计学意义。吴文湘等[17]报道在无阴道不适症状的健康女性中仍有25%~ 40%存在异常菌群情况,说明菌群抑制未必增加HPV 的易感性,分析可能与复杂的阴道菌群中有相互拮抗的因素有关,有待于进一步研究。
阴道微生物受年龄、雌激素水平、饮食生活习惯、性生活方式等内外因素的影响,菌群的构成有所不同,而且各类菌群的生物学特性各异,使得它们在HPV 感染及宫颈病变的发生中会呈现不同的相关性。Ravel等[18]将不同种族育龄期女性未孕时的阴道菌群状态分成5 种菌群类型(community state type,CST),其中4 种以乳酸杆菌为主,包括CST Ⅰ(卷曲乳杆菌)、CST Ⅱ(加氏乳杆菌)、CST Ⅲ(惰性乳杆菌)和CST Ⅴ(詹氏乳杆菌);另外CST Ⅳ以多种绝对或兼性厌氧菌占优势,乳杆菌相对缺乏,主要包括加德纳菌、普氏菌和巨型球菌等。研究发现卷曲乳杆菌ST1 珠对阴道上皮细胞有很强的蛋白依赖的黏附作用,它能竞争性抑制阴道加德纳菌等的依附;还能够产生大量过氧化氢,有利于维持低的阴道pH值,抑制致病微生物的生长[19];能够分解阴道细胞内的糖原,产生乳酸分子激活环磷酸腺苷,促进细胞的自噬作用,清除局部凋亡细胞、氧化应激碎片等,对阴道上皮细胞起到了保护作用[20]。惰性乳杆菌分泌的溶细胞素会使细胞黏膜形成孔洞而利于病毒的侵入,还会消耗大量的还原型谷胱甘肽,造成阴道氧化应激环境,促进HPV 的持续感染及子宫颈癌的发生发展[19]。CST-Ⅳ型菌群中的厌氧菌可代谢获取的色氨酸生成吲哚类化合物,进而诱导免疫抑制,使病原体有效地避开宿主的防御机制导致长期感染[21]。CST-ⅣB型中阿托波菌数量多,可与加德纳菌黏附于上皮细胞构成的胞外聚合物基质形成坚实的三维结构,并最终形成成熟的微生物生物膜,与加德纳菌形成共生关系,促进其进一步发挥作用[22]。乳杆菌分泌的乳酸分为左旋和右旋两种异构体,其中右旋乳酸对维持阴道稳态更有效。CST Ⅲ、CST Ⅳ中左旋乳酸比例较高,可通过上调基质金属蛋白酶8 促进细胞外基质分解,破坏宫颈细胞的完整性,利于HPV 侵入基底角化细胞。CST Ⅰ、CST Ⅱ、CST Ⅴ中右旋乳酸含量较高,能分泌过氧化氢,刺激上皮细胞分泌抗微生物物质,宫颈阴道黏液的黏性较高,可限制病毒颗粒侵入,抑制组氨酸去乙酰化酶,激活阴道局部固有免疫分子的基因转录,从而达到激活免疫清除病原体的目的[23]。本研究中阴道微生态正常组与总的微生态异常组HR-HPV阳性率无统计学差异,推测是因为上述保护及致病因素相互制衡所致,所以在分析阴道微生态与HR-HPV 感染的相关性时要具体分析哪种指标的改变。
综上所述,阴道微生态失衡与HR-HPV 感染之间的关系错综复杂,不能笼统地认为阴道微生态失衡会导致HPV 感染风险的增加,而要再细化到某些指标上来具体分析。健康稳定的微生态是维持宫颈及阴道健康的至关重要的因素,临床上预防或清除HPV 感染的同时也需要关注阴道微生态的改变。
作者贡献李莉:论文设计、构思、撰写初稿;王铭洋、郑文瑾:提供临床咨询和标本采集;马莹、付玉荣:实验检测和数据采集;于东渤:数据分析和研究;翟青枝:监督指导和稿件的审核修订。
利益冲突本文作者声明不存在潜在的利益冲突。
数据共享声明本篇论文的关联数据可依据合理理由从作者李莉处索取,Email:287112717@qq.com。

