CXC 趋化因子受体1/2 在急性白血病中的异常表达及临床意义探析
刘彦权,曾敏娟,殷悦,沈建箴,唐焕文
1 广东医科大学第一临床医学院血液内科,广东东莞 523808;2 广东医科大学基础医学院解剖学教研室,广东东莞 523808;3 福建省血液病研究所,福建医科大学附属协和医院血液科,福建福州 350001
急性白血病(acute leukemia,AL)是一类高度异质性、源自造血干祖细胞遗传突变所致的恶性克隆性非实体肿瘤,AL 通常病情危重、预后差、治疗难度大、复发率高,是一类难以治愈且严重威胁国人生命健康的恶性血液病[1-2]。CXC 趋化因子受体(CXC chemokine receptor,CXCR)及其配体之间的相互作用及其复杂的调控网络对肿瘤的发生、发展产生影响,其中就包括了白血病细胞的激活、增殖和侵袭[3]。CXCR 家族由CXCR1~CXCR7 所组成,CXCR1 和CXCR2 是CXC 趋化因子配体白细胞介素8(CXC chemokine ligand 8,CXCL8)最具亲和力且重要的受体,该“受体-配体”相互作用可诱导白细胞趋化性,进而引起细胞增殖和迁移,并与肿瘤恶性生物学行为调控机制密切相关[4]。目前已知,靶向CXCL8-CXCR1/2 轴在多种实体瘤中具有较大治疗潜力[5-7],但其在AL中的作用却鲜为人知。本研究通过探索CXCR1/2在初诊(new-diagnosed,ND) AL 患者中的表达情况,分析并探讨AL 患者CXCR1/2 表达与临床指标、预后的关系,旨在为AL 的基础研究与治疗靶点探寻提供较为新颖的方向,为改善AL 患者的生存质量、远期疗效及长期预后提供新思路。
对象与方法
1 研究对象 收集2018 年11 月-2020 年12 月福建医科大学附属协和医院血液科住院部、门诊骨髓穿刺室共86 例初诊AL 患者的临床资料及骨髓血标本,其中男性49例,女性37例,年龄17~ 73岁,中位年龄48岁。所有患者均根据临床表现、血常规检查和骨髓MICM 国际分型诊断标准予以分型。同时收集26 例临床诊断无血液病或其他恶性疾病的健康者骨髓血标本作为正常对照组,其中男性17例,女性9例,年龄23~49岁,中位年龄36.5岁。本研究经福建医科大学附属协和医院医学伦理委员会批准(伦理编号:2019KY092),入组本研究的患者均签署知情同意书,临床资料从病历系统资料中获取。入组研究的患者和对照者均在行骨髓穿刺术时留取3~ 5 mL骨髓液,并用肝素抗凝管抗凝。
2 主要仪器与试剂 超净台购于苏州安泰空气技术有限公司,微量移液器购于德国Eppendorf公司,荧光实时定量PCR 仪(7500型)购于美国ABI 公司,恒温水浴箱购于英国Grant 公司,高速台式离心机购于上海金鹏分析仪器有限公司,低温高速离心机购于美国Thermo 公司,-20℃低温冰箱购于中国美的公司,-80℃低温冰箱、生物安全柜购于美国Thermo 公司;15 mL 离心管、10 mL移液管购于美国Thermo 公司,巴氏吸管购于NEST 公司,1.5 mL EP 管、PCR 管、八联管均购于Axygen 公司;PBS 缓冲液购于Hyclone 公司,人淋巴细胞分离液购于厦门鹭隆生物公司,红细胞裂解液购于北京索莱宝生物公司,TRIzol 试剂购于上海Invitrogen 公司,氯仿、异丙醇、无水乙醇均购于上海振兴化工,焦碳酸二乙酯(DEPC)购于上海生工公司,逆转录试剂盒购于南京诺唯赞公司,SYBR GreenMaster (ROX)购于北京康为世纪生物公司。
3 骨髓标本单个核细胞的提取 将骨髓血标本加入等体积淋巴细胞分离液至15 mL 离心管(骨髓液∶分离液=1∶1),等量PBS 稀释骨髓标本,轻柔吹打混匀;将稀释的骨髓缓慢叠加于人淋巴细胞分离液,形成分明的界限;室温下2 000 r/min离心20 min,用移液管吸取上层血浆冻存以备后续ELISA 实验,吸取中间云雾状层单个核细胞层于1.5 mL EP 管中,PBS 洗涤两遍后2 000 r/min 离心5 min,若存在较多红细胞,则加入红细胞裂解液2 mL,4℃裂解20 min,再用PBS 洗涤两遍;吸弃上清,加入1 mL TRIzol 以备后续提取RNA,储藏于-80℃。
4 骨髓单个核细胞总RNA 的提取 在骨髓标本处理后获取的单个核细胞团加入1 mL TRIzol试剂混匀,冰上静置10 min 后加入氯仿200 µL,充分震荡混匀3 min,冰上静置5 min 后于4℃下12 000 r/min 水平离心15 min,离心后吸取上层清液到另一预先对应编号的EP 管中,加入等体积异丙醇,颠倒混匀,碎冰上静置10 min,静置后于4℃下12 000 r/min 水平离心20 min,弃上清,加入无水乙醇1 mL,温和震荡离心管,轻弹管底,使沉淀悬浮,再于4℃下12 000 r/min 水平离心10 min,弃上清,加入适量DEPC 水(10~ 20 µL),56℃水浴10 min,溶解RNA,吸取2 µL RNA于核酸蛋白定量仪中测定浓度和纯度,-80℃冻存备用。
5 实时荧光定量PCR(qRT-PCR)检测CXCR1/2的表达水平 利用TRIzol RNA 提取试剂盒提取总RNA 并检测浓度和纯度后,按照南京诺唯赞逆转录试剂盒说明书逆转录成cDNA,应用ABI 7500型荧光定量PCR 仪和SYBR GreenMaster (ROX)试剂盒进行PCR 扩增,以GAPDH 为内参照,引物序列如下。CXCR1 引物序列:上游引物5’-TTCTCCATAGCTGCCTCAACC-3’,下游引物5’-TGTAGGAGGTAACACGATGACG-3’;CXCR2 引物序列:上游引物5’-TGGGCAACAATACAGCA AACT-3’,下游引物5’-GCACTTAGGCAGGAG GTCTTA-3’;GAPDH 引物序列:上游引物5’-CACCCACTCCTCCACCTTTGA-3’,下游引物5’-TCTCTCTTCCTCTTGTGCTCTTGC-3’。总反应体系20 µL:2 µL cDNA,10 µL SYBR Green (ROX),上、下游引物各0.5 µL,RNase-free ddH2O 7 µL。反应条件如下,第一阶段(预变性):50℃ 2 min、95℃ 10 min,1 个循环;第二阶段:95℃ 15 s (变性)、60℃ 1 min (退火/延伸),共40 个循环;第三阶段(溶解曲线分析):95℃ 15 s、60℃ 1 min、95℃ 30 s、60℃ 15 s,1 个循环;采用Ct 值比较法予qRT-PCR 结果分析,并对比各CXCR 家族mRNA 表达水平,即ΔCt=CtCXCR-CtGAPDH,采用2-ΔΔCT法计算各CXCR 的相对表达量,其中ΔΔCT=(CTCXCR-CTGADPH)实验组-(CTCXCR-CTGADPH)对照组。
6 研究指标 (1)比较初诊AL 患者与健康者骨髓标本中的CXCR1/2 mRNA 表达水平;(2)以CXCR1/2 中位表达水平作为界值,将初诊AL 患者分为CXCR1/2 高表达组和CXCR1/2 低表达组,分析不同CXCR1/2 表达水平与AL 患者临床特征的关系;(3)分析57 例AML 患者CXCR1、CXCR2 表达与临床特征及指标之间的关系。
7 统计学方法 采用SPSS 26.0 软件进行统计分析。计量资料进行正态性检验,正态分布数据以±s表示,两组间比较用t检验(或校正t检验);非正态分布数据以Md(IQR)表示,并进行非参数检验。等级资料采用秩和检验。分类计数资料采用χ2检验。P<0.05 为差异有统计学意义。
结果
1 临床AL 标本分型 如表1 所示,本研究纳入的初诊AL 患者86例,其中急性淋巴细胞白血病(acute lymphoblastic leukemia,ALL)组29 例(T型ALL 约1/4,B型ALL 约3/4),急性髓系白血病(acute myeloid leukemia,AML)组57 例(M2 和M5型占AML 组的73.68%)。

表1 临床AL 标本分型统计(例,%)Tab.1 Classification and statistics of clinical AL specimens (n,%)
2 CXCR1/2 在初诊AL 组与健康对照组中的表达比较 以本研究样本CXCR1/2 水平数据绘制数据图(图1)。其中左两数据簇分别为健康对照组(26 例)和初诊AL 组(86 例)。右两数据簇则为初诊AL 组的两分型组,分别为AML 组(57 例)和ALL 组(29 例)。
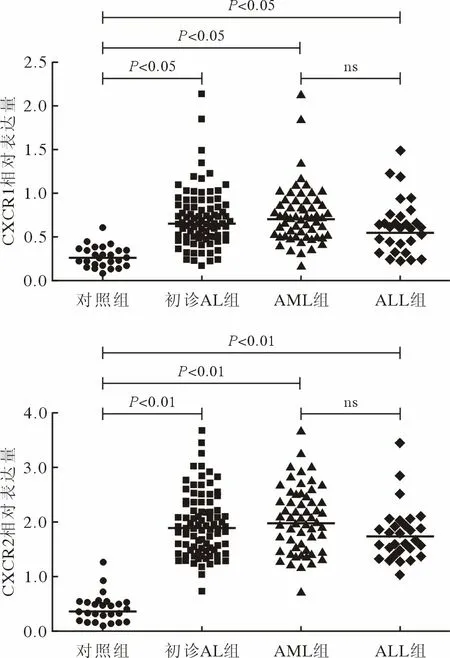
图1 CXCR1、CXCR2 在初诊AL 组(含分组)与健康对照组中的表达比较Fig.1 Differences in the relative expression of CXCR1 and CXCR2 in newly diagnosed AL groups and healthy control group
如图1 所示,CXCR1 在初诊AL 组中的中位相对表达量为0.691(0.176~ 2.14),在健康对照组中的中位相对表达量为0.278(0.088~ 0.613);而CXCR2 在初诊AL 组中的中位相对表达量为1.938(0.729~ 3.681),在健康对照组中的中位相对表达量为0.419(0.079~ 1.268),两者比较差异有统计学意义(P<0.01)。此外,CXCR1、CXCR2 在AML组中的中位相对表达水平分别为0.704、1.965,AML 组与ALL 组的CXCR1/2 表达水平差异无统计学意义(P>0.05)。
3 初诊AL 患者CXCR1/2 表达与临床特征的关系 CXCR1 高表达组(ExpressionCXCR1≥0.691)的白细胞(white blood cell,WBC)、乳酸脱氢酶(lactate dehydrogenase,LDH)、C 反应蛋白(Creactive protein,CRP)等炎症指标均显著高于低表达组(ExpressionCXCR1<0.691)(P<0.05),且CXCR1表达与患者初次就诊时是否发热、皮肤苍白、血红蛋白(hemoglobin,Hb)、血小板(platelet,PLT)、骨髓及外周血原始细胞数等临床特征与指标有关(P<0.05),与患者的年龄、性别、疲劳程度、髓外浸润情况等无关(P>0.05)。见表2。

表2 AL 患者CXCR1、CXCR2 表达与临床特征的关系Tab.2 Relationship between CXCR1/2 expression and clinical characteristics in AL patients
CXCR2 高表达组(ExpressionCXCR2≥1.938)患者WBC、LDH、CRP 炎症指标以及骨髓原始细胞数、外周血原始细胞数均显著高于低表达组(ExpressionCXCR2<1.938)(P<0.05)、Hb、PLT 显著低于低表达组(P<0.05)。此外,CXCR2 的表达与发热、疲劳、皮肤苍白等临床特征密切关联(P<0.05),CXCR2 高表达患者相比低表达患者更易出现髓外浸润(P<0.05)。CXCR2 的表达与患者的性别、PCT、淋巴结肿大等无关(P>0.05)。
4 初诊AL 样本中AML 患者CXCR1/2 表达与临床指标的关系 CXCR1 高表达组(ExpressionCXCR1≥0.704)中M2 和M5 患者居多,占全部AML 分型的80%以上,且CXCR1 的表达与患者贫血程度、WBC、PLT、骨髓原始细胞数目密切相关(P<0.05),与性别、年龄、FAB 分型、髓外浸润情况、细胞遗传学危险分组及分子遗传学特征无关(P>0.05)。见表3。

表3 AML 患者CXCR1、CXCR2 表达与临床指标的关系Tab.3 Relationship between the expression of CXCR1,CXCR2 and clinical indicators in the AML patients
CXCR2 高表达组(ExpressionCXCR2≥1.965)中M2 和M5 亦占全部AML 分型的80%以上,其他分型在高表达组与低表达组之间无统计学差异(P>0.05),CXCR2 的表达与患者性别、髓外浸润情况、细胞遗传学危险分层和分子生物学特征无关(P>0.05),但CXCR2 高表达患者较低表达患者更易出现较差的实验室检查结果(P<0.05)。
讨论
AL 是一类源自淋巴造血系统且高度异质性的非实体性恶性肿瘤,尽管标准诱导化疗联合靶向药物、免疫治疗、骨髓移植等手段可使部分AL 患者改善病情、延长生命,但AL 临床疗效及预后不容乐观,病死率仍居高不下[8-9]。根据世卫组织国际癌症研究机构(IARC)和中国国家癌症中心(NCC)的最新数据,2020 年中国新发癌症人数、癌症死亡人数均位居全球第1,其中白血病死亡人数位居全球所有癌症第10 位;在我国,白血病位居男性癌症发病率的第7位,分别是我国城市地区癌症高发及癌症病死率的第5 位、第4 位恶性肿瘤,且白血病位居我国所有癌症死亡总数中的第9位,是目前严重威胁国人生命健康且难以治愈的恶性疾病[10-11]。为此,积极寻找AL 新治疗靶点,寻求对AL 诊断、治疗及预后评估有价值的分子标志物尤为重要。
趋化因子是一类由基质细胞或肿瘤细胞所产生的可移动趋化的小分子分泌型蛋白,根据其分子结构,学术界将趋化因子分为CXC、CC、CX3C及C 四大类别,而趋化因子受体作为G 蛋白偶联受体超家族的关键成员,基于趋化因子配体可将其分为CXCR、CCR、CX3CR 和CR 这四类[12-14]。趋化因子与其受体相结合后通过激活相关信号通路等在内的生物学机制调控肿瘤细胞的增殖、转移或影响机体免疫反应从而介导肿瘤的发生发展。CXCR1/2 作为G 蛋白偶联受体超家族的关键成员,其亦是CXC 趋化因子配体8(CXCL8)极具亲和力的受体,CXCR1 与CXCR2 彼此具有76%的同源性序列,CXCL8 通过与CXCR1/2 结合共同组成复杂的调控网络在机体免疫、肿瘤微环境等方面扮演着不可或缺的角色[15-16]。既往研究证实,CXCR1/2 在多种恶性肿瘤中异常表达,并在促进肿瘤化疗耐药、转移以及维持肿瘤干细胞特性等方面尤为关键[17-18]。但目前对于CXCR1/2 在血液系统肿瘤的发生发展中是否存在一定的调控关系或作用机制等相关研究甚少,其很有可能成为白血病临床诊疗的新型标志物。
本研究采用qRT-PCR 技术检测86 例ND-AL患者及26 例健康对照者骨髓血标本中CXCR1/2的表达情况,结果表明CXCR1/2 在AL 患者中表达上调,利用CXCR1/2 相对表达量中位数法(Expressionmedian)将所有病例标本分为CXCR1/2 高表达组和CXCR1/2 低表达组,结果显示CXCR1 高表达组WBC、LDH、CRP 以及某些炎症指标均显著高于低表达组,且CXCR1 的表达与患者初次就诊时是否发热、皮肤苍白、WBC、Hb、PLT、LDH、CRP、骨髓及外周血原始细胞数等临床特征与指标有关,与患者的年龄、性别、疲劳程度、髓外浸润情况等无关。而CXCR2 的表达与发热、疲劳、皮肤苍白等临床特征相关,且CXCR2 高表达组WBC、LDH、CRP 炎症指标以及骨髓原始细胞数、外周血原始细胞数均显著高于低表达组,而Hb、PLT 显著低于低表达组,此外CXCR2 高表达患者相比CXCR2 低表达患者更易出现髓外浸润,CXCR2 的表达与患者的性别、PCT 以及淋巴结肿大等无关。上述结果提示,CXCR1/2 高表达与临床不良症状、体征以及较差的实验室结果密切相关,间接提示CXCR1/2 可能参与了AL 的发生发展致病机制,且很有可能与AL 患者的病情发展、疗效欠佳及预后不良等密切相关。
由于AML 是成年人最常见的白血病类型,为了更细致地探索CXCR1/2 在白血病中的异常表达与临床特征的关联,本研究后续将纳入本研究所有临床样本中诊断为AML 的57 例患者数据单独进行研究,探讨AML 患者CXCR1/2 表达情况与各临床指标及特征的关联。结果发现,CXCR1/2 表达在FAB 分型中存在一定关联和特点,在CXCR1、CXCR2 高表达组中均以M2 和M5 患者居多,分别占全部AML(FAB)分型的81.81%、85.72%。此外,CXCR1/2 高表达患者贫血、出血、感染及髓外浸润等风险与低表达患者相比更为严重,表明CXCR1/2 与不良临床指标关系紧密相关,CXCR1/2很有可能作为ND-AL 患者,尤其是AML 患者疗效及预后的重要评估指标。值得关注的是,Tang等[19]亦采用qRT-PCR 技术检测ND-AML 患者体内CXCR2 表达情况,发现AML 患者CXCR2 高表达预示着长期生存率低,是预后不良的独立危险因素,且CXCR2 高表达提示易发生白血病髓外浸润,本研究与该研究结论基本一致。
本研究的创新之处是将基础研究紧密联系临床,并将基础研究成果转化付诸于临床实践。但由于本研究为单中心样本且存在纳入例数少、随访时间短等不足,今后本课题组将更为深入地开展CXCR1/2 在AL 中的致病机制研究,进一步揭示CXCR1/2 在白血病发生发展中的关键作用。总之,本研究证实CXCR1/2 在AL 患者中表达上调,可作为AL 患者诊疗中的重要分子标志物和生物学靶点,检测CXCR1/2 mRNA 表达水平,对评估AL 患者的临床疗效、预后价值等方面具有极为重要的指导意义,依据CXCR1/2 表达水平可对AL 患者进行个体化、精准性的分组治疗,继而最大程度改善患者预后。此外,本研究结果亦在一定层面上提示CXCR1/2 在AL 致病机制中起到关键作用,未来很可能是抗白血病基础研究与临床的重要突破口,并为抗白血病治疗及研究提供重要的理论基础和现实依据。
作者贡献刘彦权:研究设计、实验研究实施与监督、文献查阅与论据完善、撰写或修改论文;殷悦:实验技术支持、实验研究实施与监督;曾敏娟:数据统计分析与核查校对;沈建箴、唐焕文:研究指导与总体把关、经费与行政支持。
利益冲突所有作者均声明不存在利益冲突。
数据共享声明本研究相关数据暂不共享。

