天冬多糖的提取方法研究
楼丽,晏堂,张苏霞,陈思雨,刘永静
(福建中医药大学药学院,福建 福州 350122)
天冬(Radix Asparagi)为百合科植物天冬[Asparaguscochinchinensis(Lour.) Merr.]的干燥块根,气微,味甜、微苦,具有养阴润燥,清肺生津的功效,临床上用于肺燥干咳,顿咳痰黏,腰膝酸痛,骨蒸潮热,内热消渴,热病津伤,咽干口渴,肠燥便秘[1]。现代研究表明,天冬多糖是天冬的重要活性成分之一,具有降糖、增加免疫、抗炎等药理作用[2]。因而,天冬多糖的提取制备是天冬药材相关产品的开发和利用重要的一步,而传统的水提醇沉法提取多糖,不仅耗时久且需要多次提取,操作步骤较为烦琐。
近年来几种新颖的提取多糖的方法涌现,低共熔溶剂(deep eutectic solvents,DES)作为一种绿色溶剂,具有生物可降解性、高增溶作用、低毒性等优势,已经被用于提取黄酮、多酚、多糖[3]。本文将其作为提取多糖的一种方法,探讨DES提取多糖的可能性。
超声波辅助法提取多糖作为新兴提取方法,具有省时、高效、操作简便无污染等优点,酶法是利用生物酶的高效性和专一性,通过破坏植物细胞壁和提高细胞膜的通透性来加速胞内物质溶出,具有反应温和、操作简便等优点[4]。本文目的在于优选出一种较为简便易操作的方法,为天冬多糖能更好地利用奠定一定的实验基础。
1 仪器与试药
1.1 仪器 XS 105 电子天平(梅特勒-托利多仪器有限公司);Q-500E 超声波清洗器(昆山市超声仪器有限公司);UPR-II-5TN 超纯水机(四川优普超纯科技有限公司);100~1 000 μL 移液枪(德国艾本德股份有限公司);85-2 恒温磁力搅拌器(常州国华电器有限公司);UV-9600 紫外分光光度计(北京瑞利仪器分析有限公司);DFY-500摇摆式高速中药粉碎机(温岭市林大机械有限公司);Lab-1A-50E 冷冻干燥机(博医康仪器有限公司);PB-10 PH计(赛多利斯科学仪器有限公司);BHS-2 数显恒温水浴锅(福州泰美实验仪器有限公司);TDL-40B 离心机(上海安亭科学仪器厂)。
1.2 试药 天冬(北京仟草中药饮片有限公司,批号:211124001);无水葡萄糖对照品(上海源叶生物科技有限公司,批号:S21J12I138537,含量>98%);硫酸(分析纯,无锡市龙吉利化工试剂有限公司);苯酚(分析纯,上海阿拉丁生化科技股份有限公司);乙醇(分析纯,国药集团化学试剂有限公司);果胶酶(上海源叶生物科技有限公司,500 U·mg-1)、纤维素酶(国药集团化学试剂有限公司)、木瓜蛋白酶(上海源叶生物科技有限公司,800 U·mg-1);氯化胆碱(分析纯,上海源叶生物科技有限公司);甜菜碱、乙二醇(分析纯,上海阿拉丁生化科技股份有限公司);1,2-丙二醇、丙三醇、乙酰胺(分析纯,国药集团化学试剂有限公司);1,4丁二醇、脲(分析纯,西陇科学股份有限公司)。
2 方法与结果
2.1 药材预处理 将天冬药材在50 ℃干燥6 h,粉碎,过筛(80目),备用。
2.2 天冬多糖的提取方法
2.2.1 水提醇沉法 取干燥的天冬粉末约10 g,精密称定,加入95%乙醇150 mL,70 ℃回流提取,每次提取1 h,共提取3 次,抽滤后加入蒸馏水200 mL,沸水煮提6 h,过滤,残渣再加蒸馏水150 mL,煮提4 h,合并2 次滤液,浓缩至约20 mL,加入适量95% 乙醇,使醇沉量达80%,静置过夜后,离心(8 000 r·min-1,10 min),将沉淀物用水复溶预冻,冷冻干燥,即得天冬粗多糖。
2.2.2 DES结合超声提取法 DES的制备:将一定比例的氢受体与氢供体在锥形瓶中混合均匀,使用磁力搅拌器使其于80 ℃下搅拌,直至形成均一澄清的液体,冷却,备用。
取干燥的天冬粉末约2 g,精密称定,置锥形瓶中,按一定料液比加入DESs溶液100 mL(其中含30%水),混合均匀,恒温超声(功率500 W,频率40 kHz)30 min ,待溶液冷却至室温,将DES天冬多糖粗提液旋蒸除水至约20 mL后,加入95%乙醇使其含量达80%,静置过夜后,离心(8 000 r·min-1,10 min),将沉淀物用水复溶预冻,冷冻干燥,即得天冬粗多糖。
2.2.2.1 DES种类的筛选 DES结合超声提取法中,由于醇沉在筛选DES种类中工作量较大,选择DES天冬粗提液作为供试品溶液,测定其吸光度,以提取液中多糖含量为指标进行DES种类的筛选,尽可能避免由于DES体系给结果带来的偏差。结果见表1。由结果可知,氯化胆碱-脲体系具有明显的优势,所以选择这一体系作为DES提取的体系。
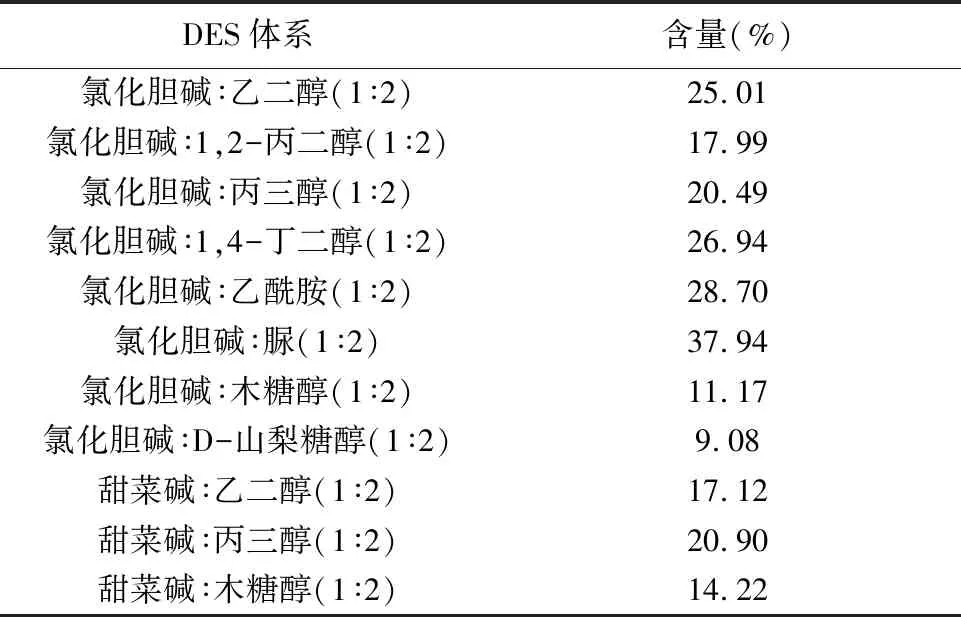
表1 DES体系对多糖含量的影响
2.2.2.2 DES提取条件的优化 分别对氢键供体和氢键受体摩尔比、含水率、超声提取时间及液料比进行了优化,结果见图1。
由图可知,虽然摩尔比为1∶5时多糖含量最高,而选取摩尔比为1∶6时,DES迅速析出形成固体,1∶3、1∶4、1∶5也是一样的情况,无法与天冬粉末混合均匀。由于考虑到后续操作的便捷性所以本试验选取尿素-氯化胆碱摩尔比1∶2作为最佳摩尔比。超声提取时间方面,随着时间的增加,多糖含量有所增加但结果接近,出于节能环保考虑选择超声提取时间为30 min。料液比方面,1∶50 g·mL-1时,含量最高,但此条件下由于DES用量较少,提取时吸取液体已经有一定难度,因此选择1∶50 g·mL-1为最佳。综上,DES提取法的最佳条件为氯化胆碱与脲摩尔比为1∶2,含水率为20%,超声提取时间为30 min,料液比为1∶50 g·mL-1,在此条件下,天冬多糖的提取率为37.85%±0.82%。
2.2.3 超声辅助结合酶法 取干燥的天冬粉末约2 g,精密称定,加入蒸馏水50 mL,调pH为4.5,混合均匀,纤维素酶添加量为0.5%,50 ℃超声提取(功率500 W,频率40 kHz)30 min ,95 ℃下灭酶15 min,待溶液冷却至室温,将天冬多糖粗提液旋蒸除水至约20 mL后,加入95%乙醇使其含量达80%,静置过夜后,离心(8 000 r·min-1,10 min),将沉淀物用水复溶预冻,冷冻干燥,即得天冬粗多糖。
超声辅助结合酶法提取条件优化:分别考察酶的种类、pH值(2.5~7.5)、酶添加量(0.25%~2.5%)、料液比(1∶10~1∶70)对天冬多糖提取率的影响,结果见图2。
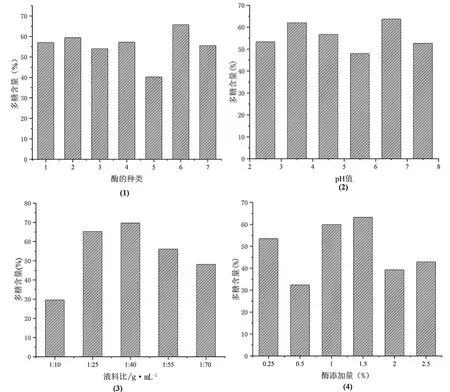
图2 超声辅助结合酶法条件优化
首先对酶的种类进行优化,包括①果胶酶、②木瓜蛋白酶、③纤维素酶,其次对复合酶也进行筛选,包括④果胶酶+木瓜蛋白酶、⑤果胶酶+纤维素酶、⑥木瓜蛋白酶+纤维素酶、⑦果胶酶+纤维素酶+木瓜蛋白酶,此时控制酶添加量不变(0.5%)。⑥木瓜蛋白酶与纤维素酶所组成的复合酶在提取多糖方面具有一定的优势。可能是由于纤维素酶促进天冬纤维素中多糖的溶出,并且木瓜蛋白酶通过将蛋白聚糖中的游离蛋白进行水解[5],而纤维素酶与木瓜蛋白酶之间的相互作用具有协同作用,高于它们任何一种单一酶的含量,因此,选择木瓜蛋白酶与纤维素酶组成的复合酶进行后续试验。
pH值方面,天冬多糖提取率在pH为6.5时达最大值,继续增大pH值至7.5,提取率下降,可能是由于此时的pH造成酶活力的下降,影响天冬多糖的提取[6]。因此确定,pH值为6.5。
料液比为1∶40时多糖提取率最大,可能是由于随着液料比的增加,可以增加溶剂对天冬多糖的扩散速率并且促进溶出。而当料液比>1∶40时提取率下降,推测是随着溶剂的进一步增加,酶与底物相互作用减少,细胞壁降解减慢所致[7]。因此,液料比选择1∶40 g·mL-1。
随着酶添加量的增加,多糖提取率总体呈现先增加后降低的趋势,在酶添加量为1.5%时提取率最高,纤维素酶可破坏天冬的细胞壁,释放多糖;木瓜蛋白酶可水解天冬游离的蛋白质,降低蛋白质对天冬的结合力,促进多糖的释放。而当酶添加量过多时,纤维素酶和木瓜蛋白酶包裹多糖,导致多糖无法进入溶剂,降低提取率。因此,选择酶添加量为1.5%。
综上,超声辅助结合酶法的最佳条件为木瓜蛋白酶+纤维素酶(1∶1),pH为6.5,液料比为1∶40 g·mL-1,酶添加量为1.5 %,在此条件下,提取液中天冬多糖的提取率为56.14%±2.39%。
2.3 提取方法的比较 3种提取方法所得多糖含量见表2,由表2可知,以多糖含量为指标,3种提取法中超声辅助结合酶法具有一定优势,且操作简便,省时省力。因此,本试验选择超声辅助结合酶法作为天冬多糖的制备方法。

表2 3种提取法所得多糖含量
2.4 多糖含量测定及苯酚硫酸法优化
2.4.1 溶液的配制
2.4.1.1 5%苯酚溶液的配制 先配置80% 的苯酚,即称取80.00 g 的苯酚,加20.00 g的水使之在烧杯中溶解。再从80%的苯酚溶液中准确量取6.25 mL转移到100 mL棕色容量瓶中定容,低温保存备用,每次临用前现配。
2.4.1.2 对照品溶液的制备 精密称取50.53 mg 无水葡萄糖对照品,于100 mL容量瓶中用超纯水定容。
2.4.1.3 供试品溶液的制备 ①水提醇沉法:取“2.2.1”项下醇沉后冻干所得天冬多糖10.00 mg,精密称定,置25 mL容量瓶中,用蒸馏水溶解并稀释至刻度,超声(功率500 W,频率40 kHz)10 min,摇匀,即得。②DES超声辅助法:取“2.2.2”项下醇沉后冻干所得天冬多糖5.00 mg,精密称定,置10 mL容量瓶中,用蒸馏水溶解并稀释至刻度,超声(功率500 W,频率40 kHz)10 min,摇匀,即得。③超声辅助结合酶法:取“2.2.3”项下醇沉后冻干所得天冬多糖10.00 mg,精密称定,置100 mL容量瓶中,用蒸馏水溶解并稀释至刻度,超声(功率500 W,频率40 kHz)10 min,摇匀,即得。
2.4.2 苯酚硫酸法及其优化 根据文献[8]并做改动,确定苯酚硫酸法取适量供试品溶液,于具塞试管中,加入浓硫酸7.0 mL,苯酚(5%)2.0 mL,密闭,于沸水浴中加热15 min,冷却至室温,490 nm处测其吸光度。
采用单因素法对苯酚硫酸法进行优化,分别考察浓硫酸用量(4.0~9.0 mL)、5%苯酚用量(0.5~3.0 mL)、加热温度(50~100 ℃)、加热时间(5~30 min)、冷却时间(室温静置10 min~室温静置60 min)、以及浓硫酸、苯酚的先后加入顺序对天冬多糖显色后吸光度的影响,平行做3次,结果见图3。
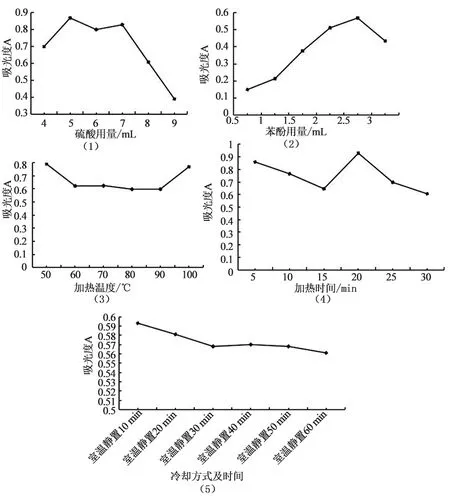
图3 苯酚硫酸法测含量条件优化
根据图3,苯酚硫酸法优化后最佳条件为浓硫酸最佳用量为5.0 mL、苯酚最佳用量为2.5 mL、最佳加热温度为50 ℃、最佳加热时间为20 min、最佳冷却方式为室温下静置10 min。其中由图3的(3)可知,当加热温度为50 ℃和100 ℃时,吸光度相当,而在60~90 ℃时吸光度差别不大,且与50 ℃时相比,吸光度下降,出于节约能耗成本考虑,选择50 ℃为最佳加热温度。另外,在浓硫酸与苯酚的加入顺序方面,先加入浓硫酸组的吸光度A大于先加入苯酚组。可能是由于苯酚含有强致活基团酚羟基,很容易与浓硫酸发生磺化反应,推测浓硫酸与糠醛衍生物竞争苯酚[9]。因此,本试验中采用先加入浓硫酸的方法,使其充分生成糖醛衍生物,再加入苯酚,使产物处于相对稳定的状态。
苯酚硫酸法最佳工艺验证:按上述方法进行工艺验证,每组平行测3次。结果见表3,RSD值为1.44%,说明优化后的该法较稳定。

表3 苯酚硫酸法优化后最佳工艺验证
2.4.3 换算因子的测定 根据文献[10],并做相应修改:精密称取“2.2.1”项下制备的天冬多糖 9.80 mg,配制成100 mL多糖样品液。按照 “2.4.2”项下优化后的苯酚-浓硫酸法测量其吸光度,平行测定3次。并根据标准曲线的回归方程计算出供试液中的葡萄糖含量,按下式计算换算因子:换算因子f=m/(C×D)。(m为称取的天冬多糖质量,mg;C为天冬多糖样品液中葡萄糖的质量浓度,mg·mL-1;D为天冬多糖的稀释倍数)换算因子最终计算为 0.610 7。
2.4.4 多糖含量的测定 精密吸取“2.4.1.3”项下的样品液0.6 mL,于25 mL量瓶中,用蒸馏水稀释至刻度,按照确定的最佳显色条件测定其吸光度,平行测定3次。根据回归方程计算出多糖液中葡萄糖的质量分数C,并按下式计算样品液中多糖的含量:多糖含量=(C×D×f)/W×100%(提取液中多糖含量:W为天冬药材质量,g;f为换算因子;C为样品液中葡萄糖的含量,mg·mL-1;D为样品液中稀释倍数。粗多糖含量:W为粗多糖质量,mg;f为换算因子;C为样品液中葡萄糖的含量,mg·mL-1;D为样品液中稀释倍数)。
2.5 方法学考察
2.5.1 标准曲线的制备与线性关系的考察 精密吸取“2.4.1.2 对照品溶液的制备”项下的对照品溶液 0.5、1.0、1.5、1.8、2.0、2.5 mL于10 mL容量瓶中,加水稀释至刻度,再精密吸取0.6 mL各浓度的对照品溶液,按“2.4.2”项下方法进行显色反应,再精密吸取0.6 mL蒸馏水按同样显色操作为空白,于490 nm处测定吸光度。以吸光值为纵坐标Y,葡萄糖浓度为横坐标X,绘制标准曲线,Y=4.644X+0.020 7,r=0.999 1,在葡萄糖质量浓度在0.025~0.125 mg·mL-1范围内与吸光值之间呈现出良好的线性关系。
2.5.2 精密度试验 分别精密吸取“2.4.1.3”项下“③超声辅助结合酶法”中的样品液0.6 mL于具塞试管中,按照最佳显色条件,重复测定吸光度6次,计算RSD值为0.26%,结果表明该仪器精密度良好。
2.5.3 重复性试验 取同一批醇沉后制得多糖粉末(按“2.4.1.3”项下超声辅助结合酶法制备)约10 mg,精密称定,置100 mL量瓶中,加蒸馏水适量溶解并稀释至刻度,平行制备6份,精密移取0.6 mL的样品液于具塞试管中,按照最佳条件显色,测定吸光度,计算平均含量为39.33%,RSD值为1.98%,结果表明该方法的重复性良好。
2.5.4 稳定性试验 取“2.5.3”项下的显色溶液分别放置5、30、45、60、90 min,并在490 nm处测定吸光度,结果平均吸光度为0.324,计算RSD值为0.71%,表明供试品溶液在90 min内稳定。
2.5.5 加样回收试验 取已知含量的多糖粉末约5 mg置于100 mL量瓶中,精密称取6份,于量瓶中分别加入相当含量的葡萄糖标准溶液0.5 mL(3.72 mg·mL-1),用蒸馏水稀释至刻度,从中精密吸取0.6 ml溶液,按照最佳条件显色,测定吸光度,计算多糖含量、回收率及相对标准偏差。结果见表4,表明该方法准确度良好。

表4 加样回收率试验结果
2.6 多糖样品含量测定 根据“2.2.3”项下的最佳条件制备3个批次的粗多糖样品,按照“2.4.1.3”项下的“③超声辅助结合酶法”用蒸馏水稀释待测多糖样品溶液,并根据最佳显色条件进行显色,分别计算每批次的含量及RSD值,结果见表5,说明测得多糖含量为32.39%~39.71%。
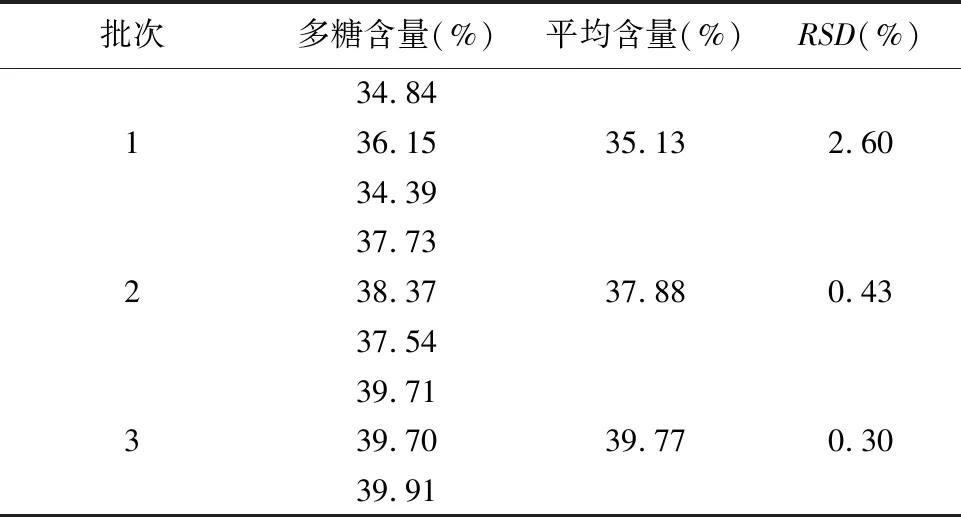
表5 不同批次多糖含量测定结果
3 讨论
本试验中以多糖含量为指标,3种方法结果分别为:水提醇沉法为29.48%±0.14%、DES结合超声提取法为5.18%±0.44%、超声辅助结合酶法为35.85%±0.26%。DES提取法可能是粗多糖中包含大量氯化胆碱,因而造成了得率较高而多糖含量较低的情况。而水提醇沉法提取时需要经过多次煮提,且需要较高温度,不仅费时费力,且高温可能影响所得多糖活性。此外,酶法提取时不仅提取液中多糖含量也显著高于其他两种方法,并且酶法所制得粗多糖纯度较高,由此得出超声辅助结合酶法在3种方法中具有一定的优势的结论,比较适合用于提取天冬多糖。本文同时测定提取液及粗多糖中多糖含量,发现提取液中多糖含量高于粗多糖中含量,可能是由于提取液中有一些单糖及杂质干扰,为后续多糖含量测定方法提供一定的数据支持。

