铜掺杂介孔硅载双硫仑抗肠癌活性研究
熊彬,张思艳,孟奇,魏亮,姜守刚
(1.东北林业大学森林植物生态学教育部重点实验室,黑龙江 哈尔滨 150040;2.东北林业大学化学化工与资源利用学院,黑龙江 哈尔滨 150040)
肠癌不仅为高发癌症之一,并且被发现时多为晚期,手术难度较大,故化疗成了治疗的主要方式[1-3]。近年来,老药新用成为越来越热门的话题。双硫仑,又名戒酒硫,临床主要用于临床治疗酒精依赖症,现在越来越多的研究证实双硫仑(DSF)具有广谱抗肿瘤活性,并且在抗肠癌中也具有一定效果[4]。双硫仑的抗肿瘤活性与铜离子(Cu2+)密切相关,铜离子能明显提高双硫仑的抗肿瘤活性[5]。但双硫仑和双硫仑的铜络合物(CuET)在体内条件下均不稳定,生物利用度低,肿瘤靶向输送能力差。介孔硅具有稳定的骨架结构、无生理毒性、较大的比表面积和孔容量、缓释药物和易于修饰等优点[6]。而铜掺杂的介孔二氧化硅不仅能为双硫仑提供铜离子,也能加速介孔硅的降解,减少对人体的损害[7]。基于DSF的抗肿瘤活性和介孔二氧化硅纳米粒子(MSNs)的易于修饰且低毒的特性,本实验探讨了Cu-MSNs载双硫仑的抗肠癌作用。
1 材料与仪器
1.1 材料 硅酸四乙酯和卡培他滨(麦克林);无水乙醇(富宇试剂);三乙醇氨和5-氟尿嘧啶(阿拉丁);双硫仑(上海源叶生物科技公司);RPMI1640培养基、青霉素-链霉素和胰酶(HyClone);非必需氨基酸(博奥拓达);氨水(25%,天力);DMSO(碧云天生物);胎牛血清(浙江天杭生物科技股份有限公司);结肠癌CT26.WT细胞(北京协和医院细胞中心)。
1.2 仪器 DF-101S集热式恒温加热磁力搅拌器(巩义市予华仪器有限责任公司);手提式压力蒸汽灭菌器XYR2015-N576(浙江新丰医疗器械有限公司);超声波清洗机(洁盟);Scientz-10N冷冻干燥机(宁波新芝生物科技股份有限公司);78HW-1数显恒温磁力搅拌器(杭州仪表电机有限公司);FA1204B分析天平和QP-80型二氧化碳细胞培养箱(济南好宝来医疗器材有限公司);ST40R型离心机(上海实维实验仪器技术有限公司);CX43生物显微镜(南京瞭望光电技术有限公司);SW-CJ-3F型生物工作台(上海沪净医疗器械有限公司);扫描电镜Quanta-200 (荷兰FEI公司);高效液相色谱仪2489(Waters 公司) 。
2 方法
2.1 二氧化硅微球的制备 采用Stober法制备二氧化硅微球[8],将10 mL的去离子水加入到50 mL的乙醇中,然后加入2.5 mL的氨水在55 ℃下水浴搅拌(1 000 r·min-1)3.5 h,期间缓慢滴加1.5 mL的硅酸四乙酯,将生成的白色产物离心收集(12 000 r·min-1),再用去离子水和乙醇分别洗3次白色产物。
2.2 二氧化硅空心微球的制备和铜掺杂 将二氧化硅微球(70 mg)和三水硝酸铜以1∶2.6的质量混合加入到50 mL的去离子水中,期间滴加6 mL的氨水,在室温下搅拌30 min,然后将所得的溶液加入到100 mL的反应釜中,在140 ℃下反应10 h,之后将所得产物分别用水和乙醇洗3次,得到的蓝色产物(Cu-MSNs)[9]。
2.3 双硫仑的载药 将适量双硫仑溶解于20 mL乙醇中,加入50 mg载体。超声1 h后剧烈搅拌过夜。离心收集上清液和沉淀,得到的DSF-Cu-MSNs(DSF-NPs)沉淀冻干后备用。
2.4 CuET检测 将5 mg的DSF-NPs加入到适量氯仿中,超声1 h后离心收集上清液,得到具有溶出介质的上清液。之后用紫外光谱仪全波长扫描,得到溶出介质的紫外图谱。
2.5 形貌观察 本实验采用SEM扫描电镜观察MSNs和Cu-MSNs的形貌以及粒径大小。
2.6 制备工艺的优化 粒径是一个评价纳米粒质量的重要标准,合适粒径的纳米粒会对药物的释放和生物利用度等因素起到重要作用[8,10]。本实验将采用单因素法控制变量,对二氧化硅微球的制备进行优化。主要优化的有氨水和水的量和反应温度,每个条件设置5个梯度3组平行。
2.7 载药量、包封率和体外释放的测定
2.7.1 DSF标准曲线的制备 本实验采用色谱法对双硫仑的标准曲线进行测定。
2.7.2 色谱条件 依利特C18色谱柱(4.6 mm×150 mm,5 μm);流动相为甲醇-水(80∶20),流速为1.0 mL·min-1;检测波长为275 nm;柱温为30 ℃;进样量:10 μL[11]。
2.7.3 标准品溶液的制备 取10 mg DSF标准品加入到10 mL容量瓶中,加入甲醇配制成1 mg·mL-1的标准品溶液,梯度稀释至100、120、140、160、180和200 μg·mL-1。测定吸收峰面积后得到DSF的标准曲线。
2.7.4 载药量的测定 取上清液(见“2.7.3”项下)逐级稀释测定其吸光度,计算其浓度后利用差减法得到载药量[12]。公式如下:

(1)
2.7.5 体外释放 将2 mg的DSF-NPs加入到透析袋(3 500 Mw)中,透析袋置入50 mL PBS缓冲液中(0.01 mol·L-1,pH=7.4,2%SDS),之后放入旋转摇床中孵育(37 ℃,100 r·min-1),按照设定的时间(0.5、1、2、4、6、12,24、48、72 h)每次取出5 mL溶液测定浓度计算累计释放量,并添加5 mL PBS缓冲液[13]。
(2)
(3)
(4)
其中,Ci为每个时间点所取透析液中的DSF浓度;Ci′是相邻两个时间点所取透析液DSF浓度增加的量;V为烧杯中透析液总体积;Vi为每次取透析液体积;M为加载在纳米粒中DSF的质量;Q为DSF的累计释放量。
2.8 体外实验
2.8.1 细胞培养 将冻存的CT26.WT细胞解冻、离心(1 800 r·min-1,7 min)后撇去上清,将细胞用含胎牛血清的RPMI 1640培养液(5 mL)轻轻吹散后移入培养瓶中。CO2培养箱中培养直至长满培养瓶后用胰蛋白酶消化,用培养液轻轻吹打、吹散细胞。以用于后续实验、传代和冻存。
2.8.2 MTT细胞毒性实验 本实验取用对数周期的CT26.WT细胞进行消化,重悬沉淀后稀释至细胞计数2.5×104个/mL。以每孔200 μL加入到96孔板中(边缘孔加入PBS缓冲液以防止边缘效应)。在CO2培养箱中过夜培养。待细胞贴壁后,将DSF、DSF-Cu-MSNs、5-FU以配置好的浓度加入到96孔板中(设置3~5个复孔),培养48 h、72 h后加入20 μL的MTT溶液(5 μg·mL-1,PBS溶解),继续培养4 h后小心弃置上清液并加入150 μL的DMSO溶液,在水平振荡器上振荡5~10 min后在490 nm处测定吸光度[14-15]。根据以下公式计算细胞抑制率:
(5)
3 结果
3.1 二氧化硅微球的工艺优化 如图1所示氨水和水对二氧化硅微球影响不成梯度变化;但随着温度的逐渐增大,粒径也随之减小。在梯度范围内最佳氨水、水和温度为:1.5 mL、12.5 mL和85 ℃。
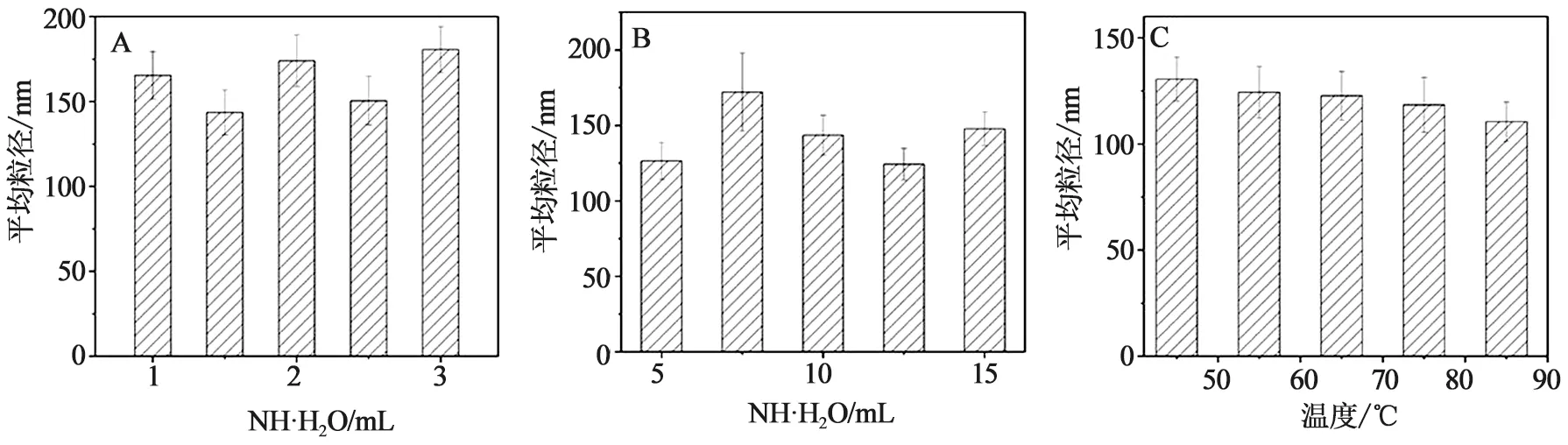
A.氨水;B.水;C.温度图1 不同因素对二氧化硅微球粒径的影响
3.2 二氧化硅的铜掺杂 DSF-NPs在结合能943、968 eV具有吸收峰(见图2),符合Cu2p3/2在结合能934.6 eV处有吸收峰且与其他物质结合后吸收峰会分裂[16]。

图2 铜掺杂介孔硅的XPS能谱
3.3 MSNs和Cu-MSNs的形貌观察 采用SEM对MSNs和Cu-MSNs的形貌进行观察,由图3可以看出MSNs和Cu-MSNs呈现规则的圆球形,且粒径处于120~160 nm之间。

A、C.MSNs;B、D.Cu-MSNs A、B.×50 000;C、D.×200 000图3 MSNs和Cu-MSNs的扫描电镜图像
3.4 载药量的测定
3.4.1 线性关系考察 DSF标准品溶液在梯度范围内与峰面积成良好的线性关系(Y=15.123X-76.142,R2=0.999 1)。
3.4.2 载药量 将供试品溶液(n=3)逐级稀释测量峰面积,直至测出合适的峰面积,代入DSF标准曲线Y=15.123X-76.142中可得上清液中的DSF含量,利用差减法可求得Cu-MSNs中DSF的含量,再利用公式(1)可求得载药量为9.51%±1.04%。
3.5 药物的体外释放 由图4得知,Cu-MSNs包载DSF在48 h内释放量仅为15.5%±1.2%,而72 h时为31.2%±1.8%。说明Cu-MSNs包载DSF具有良好的缓控释效果,DSF能与骨架中的Cu络合形成CuET,增加稳定性减缓DSF的释放。而随着载体骨架的降解释放的Cu2+能与DSF形成CuET,而CuET是主要的杀灭肿瘤细胞的活性物质[17],所以用Cu-MSNs包载DSF能更好的增强抗肿瘤效果。

图4 DSF的体外释放曲线
3.6 CuET的检测 对DSF-NPs溶液超声、离心后的上清液进行全波长扫描后得到图5。有研究证明双硫仑的吸收峰在234 nm处有吸收峰,435 nm处没有吸收峰,而CuET在435 nm处有吸收峰[17]。由图5可知含溶出介质上清液在435 nm处有较强吸收峰,证明生成了CuET。
3.7 体外抗肿瘤活性 本实验采用MTT毒性实验探究不同浓度5-Fu、DSF和DSF-NPs在48 h和72 h对CT.26WT细胞的抑制作用。随着药物浓度和时间的增大,对CT.26WT细胞的抑制作用也越强,呈现出浓度和时间的相关性。在48 h和72 h下,相较于DSF和5-Fu组,DSF-NPs的IC50值更小,进一步证明了DSF与Cu2+络合后具有更强的抗CT.26WT细胞活性。药物组与空白组相比具有显著性差异(n=3,**为P<0.01),结果如表1和图6所示。

图5 DSF-NPs溶出介质的紫外光谱

表1 药物的细胞毒性

A.5-Fu;B.DSF;C.DSF-NPs图6 在48和72 h下5-Fu、DSF和DSF-NPs的体外抗肿瘤活性
4 讨论
本文通过单因素法优化实验条件发现,在一定比例的水和氨水情况下,实验中所制备的二氧化硅微球粒径存在最小值,并且随着温度的增大而减小。将DSF包载于低粒径的Cu-MSNs中,能有效地改良DSF不溶于水的特性,使其能较好地分散于水溶液中,为未来应用于临床提供了可能性,但是低粒径的Cu-MSNs的载药量在未来应用中仍有较大的发展空间;通过MTT法比较各浓度的给药组之间对CT26.WT细胞的抑制作用,发现DSF-NPs的IC50值最小,说明DSF与铜离子结合后有效地提升了抗肠癌细胞的效果,铜掺杂介孔硅能为DSF提供铜离子的同时也能加速MSNs的降解,因此DSF-NPs在抗肠癌中具有优良的潜力。近年来,关于生物安全性高的介孔硅改造的研究越来越多,未来DSF-NPs在抗肠癌临床应用中具有潜力。

