PPAR-γ甲基化、VEGF在乳腺增生患者中的表达水平及意义*
杨东光,李艳平,李海云
1.涿州市医院普外科,河北涿州 072750;2.涿州市中医医院妇产科,河北涿州 072750
乳腺增生是一种女性常见病、多发病,有调查结果显示,70%~80%的女性存在不同程度的乳腺增生,主要表现为单侧或双侧乳房胀痛,或在月经前表现为弥漫性结节胀痛[1]。部分患者疼痛感可能随年龄增长而减轻,但有少数患者可能出现腋下或背部散射疼痛。乳腺增生患者是诱发乳腺癌的高危人群,其发生乳腺癌的风险是健康人群的2~4倍,尤其是乳腺影像报告与数据系统(BI-RADS)分级Ⅳ级及以上患者乳腺恶变风险更高[2]。其中抑癌基因甲基化异常是导致乳腺癌发生的重要机制,对恶性肿瘤的筛查具有重要意义。过氧化物酶体增殖物激活受体-γ(PPAR-γ)是一种由配体激活的核转录因子,活化后对脂肪细胞相关基因的表达、细胞周期、炎症反应等有调控作用,同时其介导的抗肿瘤机制已在结肠癌、胰腺癌等多种恶性肿瘤研究中得到验证[3-4]。乳腺增生、乳腺癌的发生均离不开血管生成,血管内皮生长因子相(VEGF)是一种特异性作用于血管内皮细胞的因子,可刺激血管内皮细胞分裂,促进新生血管生成,增加血管通透性[5],但其表达水平是否与乳腺增生进展为乳腺癌有关尚未明确。本研究通过对比不同BI-RADS分级乳腺增生患者及乳腺癌患者PPAR-γ甲基化水平及VEGF水平,分析二者在乳腺病变进展过程中的变化,旨在为乳腺癌的防治提供指导。现将具体结果报道如下。
1 资料与方法
1.1一般资料 选取2020年1月至2022年3月在涿州市医院就诊的158例良性乳腺增生患者作为观察组,同期确诊的158例早期乳腺癌患者作为恶性对照组,同期158例体检健康者作为健康对照组。所有受试者对本研究知情,并签署同意书。纳入标准:(1)观察组符合《乳腺增生症诊治专家共识》[6]中相关诊断标准,恶性对照组符合《中国抗癌协会乳腺癌诊治指南与规范(2019年版)》[7]中相关诊断标准,健康对照组经检查显示无乳腺病变;(2)观察组、恶性对照组均为初次确诊,未采取治疗措施;(3)女性;(4)年龄>18岁。排除标准:(1)严重心、肺、肝、肾等功能障碍;(2)既往妇科疾病史;(3)乳房整容史;(4)妊娠或哺乳期女性。3组基础资料比较差异无统计学意义(P>0.05),见表1。
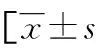
表1 3组一般资料比较或n(%)]
1.2方法 3组均抽取清晨空腹外周静脉血4 mL,常温静置30 min后,3 000 r/min离心10 min,离心半径为10 cm,于-80 ℃冰箱中保存。采用实时荧光定量PCR(RT-qPCR)法测定PPAR-γ基因甲基化情况,甲基化特异引物和非甲基化引物由大连宝生物有限公司提供。采用迈瑞MR-96A全自动酶标仪及配套试剂盒测定血清VEGF水平(参考范围为0~160 ng/L),试剂盒由罗氏诊断产品有限公司提供。
1.3观察指标 (1)比较3组PPAR-γ甲基化水平及VEGF水平。(2)比较观察组不同BI-RADS分级患者PPAR-γ甲基化水平、VEGF水平。(3)分析PPAR-γ甲基化水平及VEGF水平与BI-RADS分级的相关性。(4)比较观察组BI-RADS Ⅳ级乳腺增生患者与恶性对照组患者资料。(5)相关因素的多重共线性检验。(6)分析BI-RADS Ⅳ级进展为早期乳腺癌的影响因素。
2 结 果
2.13组PPAR-γ甲基化水平、VEGF水平比较 观察组PPAR-γ甲基化水平、VEGF水平高于健康对照组(P<0.05),但低于恶性对照组(P<0.05)。见表2。
2.2观察组不同BI-RADS分级患者PPAR-γ甲基化水平、VEGF水平比较 观察组158例患者BI-RADS Ⅱ级49例,Ⅲ级51例,Ⅳ级58例。观察组随着BI-RADS分级增加,PPAR-γ甲基化水平、VEGF水平呈升高趋势,差异均有统计学意义(P<0.05)。见表3。

表2 3组PPAR-γ甲基化水平、VEGF表达比较

表3 观察组不同BI-RADS分级患者PPAR-γ甲基化水平、VEGF水平比较
2.3PPAR-γ甲基化水平、VEGF水平与BI-RADS分级的相关性 经Spearman相关系数分析,PPAR-γ甲基化水平、VEGF水平与BI-RADS分级均呈正相关(r=0.836、0.763,均P<0.001)。
2.4观察组BI-RADS Ⅳ级乳腺增生患者与恶性对照组患者资料比较 恶性对照组体重指数、初产年龄、绝经及乳房周期性疼痛比例高于观察组BI-RADS Ⅳ级乳腺增生患者,每天体育锻炼时间、月经规律及定期体检比例低于观察组BI-RADS Ⅳ级乳腺增生患者,差异均有统计学意义(P<0.05)。见表4。
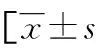
表4 观察组BI-RADS Ⅳ级乳腺增生患者与恶性对照组患者资料比较或n(%)]
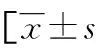
续表4 观察组BI-RADS Ⅳ级乳腺增生患者与恶性对照组患者资料比较或n(%)]
2.5相关因素的多重共线性检验 将PPAR-γ甲基化水平、VEGF水平、体重指数、初产年龄、绝经、乳房周期性疼痛、每天体育锻炼时间、月经规律、定期体检进行多重共线性检验,发现因素容差在0.333~0.670,VIF在1.492~3.002(VIF<5),多重共线可能性低。见表5。
2.6BI-RADS Ⅳ级乳腺增生进展为乳腺癌的多因素Logistic回归分析 以是否发生乳腺病变情况为因变量(赋值:BI-RADS Ⅳ级乳腺增生=0,乳腺癌=1),以PPAR-γ甲基化水平(具体值)、VEGF水平(具体值)、体重指数(具体值)、初产年龄(否=0,是=1)、绝经(否=0,是=1)、乳房周期性疼痛(否=0,是=1)、每天体育锻炼时间(<1 h=1,≥1 h=2)、月经规律(否=0,是=1)、定期体检(否=0,是=1)为自变量;多因素Logistic分析结果显示,校正体重指数、初产年龄、绝经、乳房周期性疼痛、每天体育锻炼时间、月经规律、定期体检因素后,PPAR-γ甲基化水平及VEGF高水平仍会增加BI-RADS Ⅳ级乳腺增生进展为乳腺癌的风险(P<0.05)。见表6。

表5 相关因素的多重共线性检验
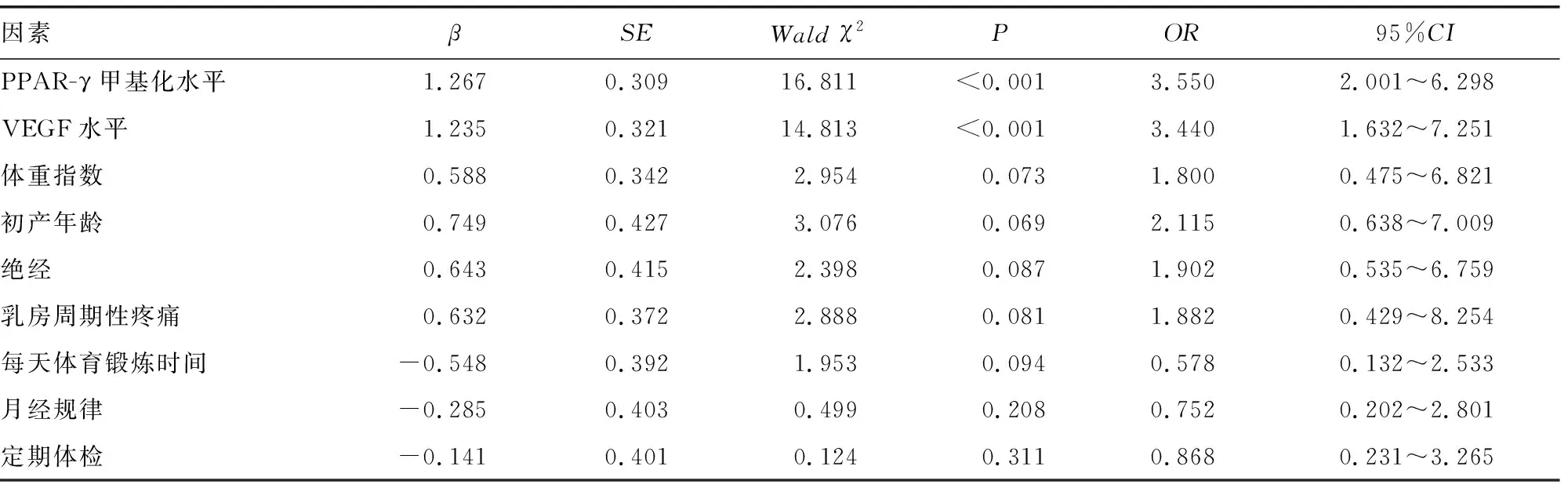
表6 BI-RADS Ⅳ级乳腺增生进展为乳腺癌的多因素Logistic回归分析
3 讨 论
乳腺增生多发于30~40岁女性,主要以乳腺组织中乳小叶结构、乳腺导管及结缔组织异常生长为病理变化。近年来随着人们健康意识的增强及医学影像学检测技术的多样化发展,乳腺增生检出率呈增加趋势。生理性乳腺增生不需要特殊治疗亦可痊愈,但部分病理性乳腺增生随着病情进展则存在癌变风险,严重影响患者身体健康。目前关于乳腺癌发病的危险因素已得到临床重视[8],但区域化差异及个体化差异明显,故如何通过生化检测指标客观判断乳腺增生患者病情恶变风险具有重要意义。
表达遗传学改变是多种疾病发生的重要机制之一。PPAR-γ可通过配体依赖途径对下游基因的转录产生影响,多表达于巨噬细胞、脾脏、结肠、脂肪细胞等。KOSAKA等[9]研究指出,PPARγ低表达与该基因启动子甲基化有关。PPAR-γ作为抗肿瘤靶点亦在多项研究中得到证实[10-11]。本研究结果显示,观察组PPAR-γ甲基化水平高于健康对照组,但低于恶性对照组,差异均有统计学意义(P<0.05),这与韦美德等[12]研究结果相符,表明PPAR-γ甲基化在乳腺病变进展过程中具有重要作用。本研究中,通过对比观察组不同BI-RADS分级患者检出情况并进行相关性分析发现,观察组PPAR-γ甲基化水平与BI-RADS分级均呈正相关(r=0.836、0.763,均P<0.001)。分析其可能原因:PPAR-γ甲基化会激活环氧化酶-2(COX-2)蛋白,促进其表达增加,促进血管生长,同时会作用于乳腺组织中的上皮/基质细胞和细胞外基质,调节原癌基因c-myc、细胞周期蛋白D1、金属基质蛋白酶(MMP)-2和MMP-9等表达,抑制细胞凋亡,增加肿瘤易感性[13-15]。这与既往研究中BI-RADS分级越高恶性病变风险越高的结论相符[16]。由此推测,PPAR-γ甲基化参与乳腺增生的进展过程,可能与其恶变的生理、病理过程有关,或可为临床评估此类患者恶变风险提供参考。
VEGF在乳腺组织细胞中释放后与VEGF受体结合,刺激内皮细胞增殖、生长、迁移[17-18]。王晶晶等[19]研究结果显示,乳腺增生患者血清VEGF呈高表达,经有效治疗后其表达水平降低。郭智慧等[20]对不同群体血清VEGF水平进行检测,发现其在健康群体、乳腺良性病变、乳腺恶性病变中依次升高。本研究中,乳腺增生患者血清VEGF水平高于健康体检者但低于早期乳腺癌患者,与上述研究相似。乳腺良恶性病变均需充足的VEGF为其提供养分,而乳腺癌由于出现细胞无限增殖,组织内新生血管更多,VEGF呈显著高表达,并且VEGF与BI-RADS分级呈正相关,表明随着乳腺增生的进展,患者内皮细胞增殖越活跃,新生血管逐渐增多。但乳腺增生最终进展至乳腺癌是多因素作用的结果,本研究在校正体重指数、初产年龄、绝经、乳房周期性疼痛、每天体育锻炼时间、月经规律、定期体检等混杂因素后,结果发现PPAR-γ甲基化水平及VEGF高表达仍会增加BI-RADS Ⅳ级乳腺增生进展为乳腺癌的风险。因此,针对乳腺增生患者,尤其是BI-RADS Ⅳ级患者应在日常危险因素筛查的基础上加强PPAR-γ甲基化水平、VEGF水平检测,对高度可疑乳腺恶变的患者及时进行病理检查,以达到早确诊、早治疗的目的。
本研究的局限性在于不同乳腺增生患者进展为乳腺癌所需时间差异较大,有的甚至需要约十年,故本研究仅分析了PPAR-γ基因甲基化、VEGF与BI-RADS Ⅳ级乳腺增生进展为乳腺癌的关系,而通过前瞻性研究分析PPAR-γ基因甲基化及VEGF水平预测乳腺增生进展为乳腺癌是否具有可行性仍需进一步验证。
综上所述,PPAR-γ基因甲基化主要与细胞凋亡受到抑制、新血管生长等有关,VEGF是刺激新血管生成的重要因子,二者均参与乳腺增生、乳腺癌的发生发展过程。

