抗苗勒管激素对多囊卵巢综合征的诊断价值:一项系统评价和Meta分析
姜林楹,杨 艳,何 帆
1.重庆医科大学第二临床学院,重庆 400000;2.重庆医科大学附属第二医院妇产科,重庆 400000
多囊卵巢综合征(PCOS)是育龄期女性常见的生殖内分泌代谢性疾病,严重影响患者的生活质量,发病率为5%~10%[1-2]。PCOS的临床特征主要有月经稀发或闭经、高雄激素的临床或生化表现,以及卵巢多囊样改变,部分患者可发生胰岛素抵抗、肥胖或不孕[3]。2型糖尿病、子宫内膜癌和心血管疾病等是PCOS的远期并发症[4-5]。PCOS的临床表现具有高度异质性,故目前对该疾病的诊断标准仍存在争议[6-7]。目前,PCOS的诊断标准有美国国立卫生研究院标准、Rotterdam标准[3]、美国雄激素过多学会标准及原卫生部发布的《多囊卵巢综合征诊断》卫生行业标准(WS330-2011),其中,Rotterdam标准的使用最广泛。抗苗勒管激素(AMH)是转化生长因子β(TGF-β)超家族成员之一[8],由小窦卵泡(直径2~9 mm)和窦前卵泡的颗粒细胞分泌,在卵泡的生长发育中发挥至关重要的调控作用。研究发现,PCOS患者的血清AMH水平是健康女性的2~3倍[9-11],原因在于小窦卵泡和窦前卵泡数量增加,分泌AMH水平增加。在月经周期的不同时期,血清AMH水平稳定,且不受激素、避孕药物等因素的影响[12]。因此,血清AMH水平可能是诊断PCOS的潜在生物标志物。目前,可采用手动检测方法,以及由Roche、Beckman Coulter公司分别开发的Elecsys®、Access全自动化学发光免疫分析仪检测血清AMH水平[13]。与手动检测方法相比,全自动化学发光免疫分析法结果更加准确,操作更简便快捷,近年来在临床被广泛应用。文献报道,通过全自动化学发光免疫分析法检测血清AMH水平诊断PCOS的灵敏度(Sen)为71%~80%,特异度(Spe)为76%~80%[14-16],但研究多为单中心、小样本研究。本研究拟系统评价全自动化学发光免疫分析法检测血清AMH水平用于诊断PCOS的效能。
1 资料与方法
1.1纳入标准 (1)血清AMH水平诊断PCOS的研究;(2)采用Rotterdam标准诊断PCOS;(3)研究对象为育龄期女性;(4)应用全自动化学发光免疫分析法检测血清AMH水平;(5)发表文献语种为英文。
1.2文献检索 检索Embase和MEDLINE数据库,检索时限为建库至2021年11月17日。采用主题词与自由词相结合的方式进行检索。检索词包括Polycystic Ovary Syndrome、PCOS、PCOD、Stein adj3 Leventhal、ovary polycystic disease、polycystic adj3 ovar$、sclerocystic adj3 ovar$、Anti-Mullerian Hormone、Mullerian inhibiting factor、Mullerian$ adj3 substance$、AMH、anti-Mullerian、diagnostic test、sensitivity和specificity。为避免漏检,手工检索相关综述文献和拟纳入文献的参考文献。
1.3文献筛选 两位评价员独立阅读所获文献题目和摘要,在排除明显不符合纳入标准的文献后,阅读可能符合纳入标准的文献全文,以确定是否真正符合纳入标准,并交叉核对纳入文献,对有分歧之处通过讨论达成共识,如讨论后仍不确定,听取第三位研究者的意见。
1.4资料提取 两位评价员根据资料提取表独立提取数据并交叉核对,存在分歧之处,听取第三位研究者的意见。提取的资料主要包括研究的基本情况、研究设计、质量评价和结局指标等。
1.5质量评价 两位评价员采用诊断准确性研究的质量评估-2(QUADAS-2)工具评价纳入研究的偏倚风险和临床适用性。从病例选择、待评价试验、金标准、病例流程和进展情况4个方面进行评价,根据对每个条目的回答“是”“否”或“不确定”,将偏倚风险等级和适用性判定为“低度偏倚和适用性高”“高度偏倚和适用性低”或“不清楚(缺乏相关信息或数据不充足)”[17-18]。存在分歧之处,听取第三位研究者的意见。
1.6统计学处理 应用Meta-Disc 1.4与Stata 17.0软件进行Meta分析。计算 Sen对数与(1-Spe)对数的Spearman相关系数,并绘制综合受试者工作特征(SROC)曲线,检验有无阈值效应。若结果在SROC 曲线平面图上呈“肩臂状”分布,Spearman相关系数为P<0.05,提示存在阈值效应,反之则不存在阈值效应。采用χ2检验或Cochran-q检验检测是否存在由非阈值效应所致异质性,若不存在异质性或异质性较小(I2≤50%,P≥0.10),采用固定效应模型进行Meta分析;若存在异质性(I2>50%,P<0.10),首先检查数据是否正确,再分析异质性来源,在排除临床异质性后,采用随机效应模型进行Meta分析并谨慎解释研究结果。如存在临床异质性,或无法解释的统计学异质性过大时,则进行描述性定性分析。依据相应模型计算纳入文献的合并Sen,合并Spe和合并诊断比值比(DOR),绘制SROC曲线并计算曲线下面积(AUC)。运用逐一排除法进行敏感性分析,如逐一排除1篇文献后的Meta分析结果与之前相比无明显变化,表明结果具有良好的稳健性。当纳入文献≥10篇时,应用Stata 17.0软件绘制Deek′s漏斗图分析发表偏倚,若漏斗图对称则表示无发表偏倚(斜率系数的P>0.05)。
2 结 果
2.1文献检索结果 共检索到相关文献1 883篇。采用PRISMA推荐的流程进行文献筛选,最终纳入10篇文献。文献筛选流程及结果见图1。
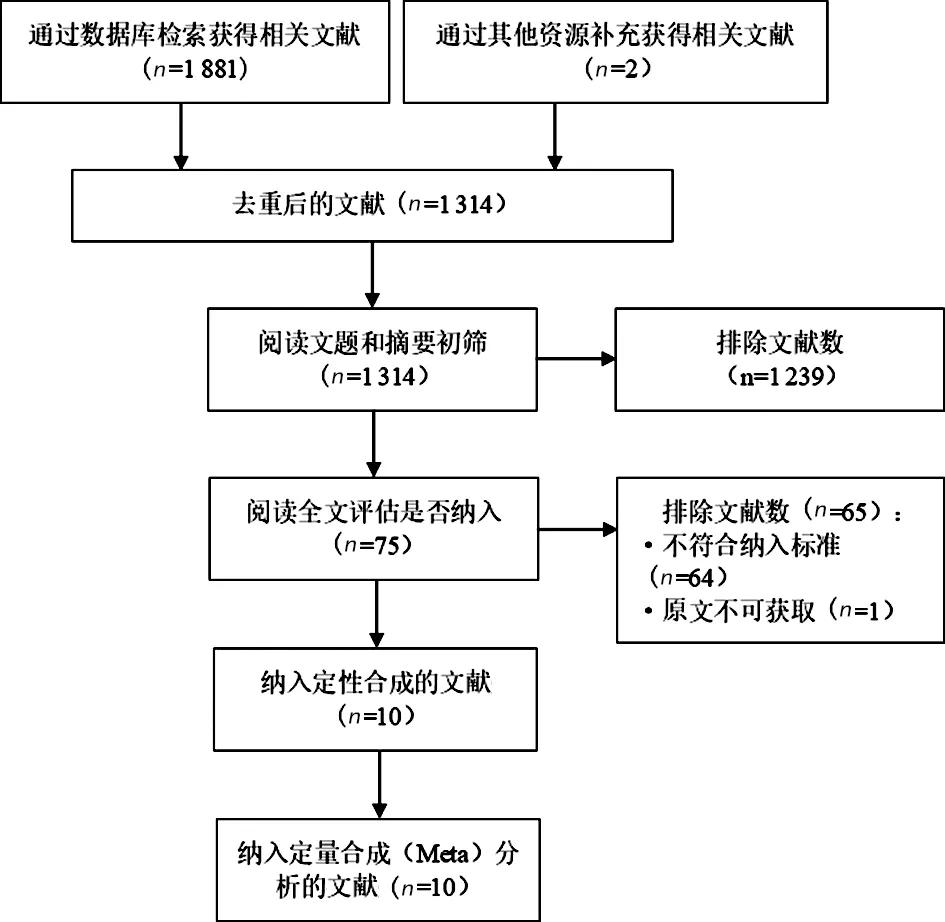
图1 文献筛选流程
2.2纳入文献的基本特征 本系统评价纳入的文献中,8篇文献为横断面研究[14-16,19-23],2篇文献为病例对照研究[24-25]。研究对象共6 437例,病例组2 147例,对照组4 290例。8篇文献[14-16,19,21,23-25]应用Elecsys®(Roche公司)、2篇文献[20,22]应用Access(Beckman Coulter公司)全自动化学发光免疫分析仪检测血清AMH水平。纳入文献的基本特征见表1。
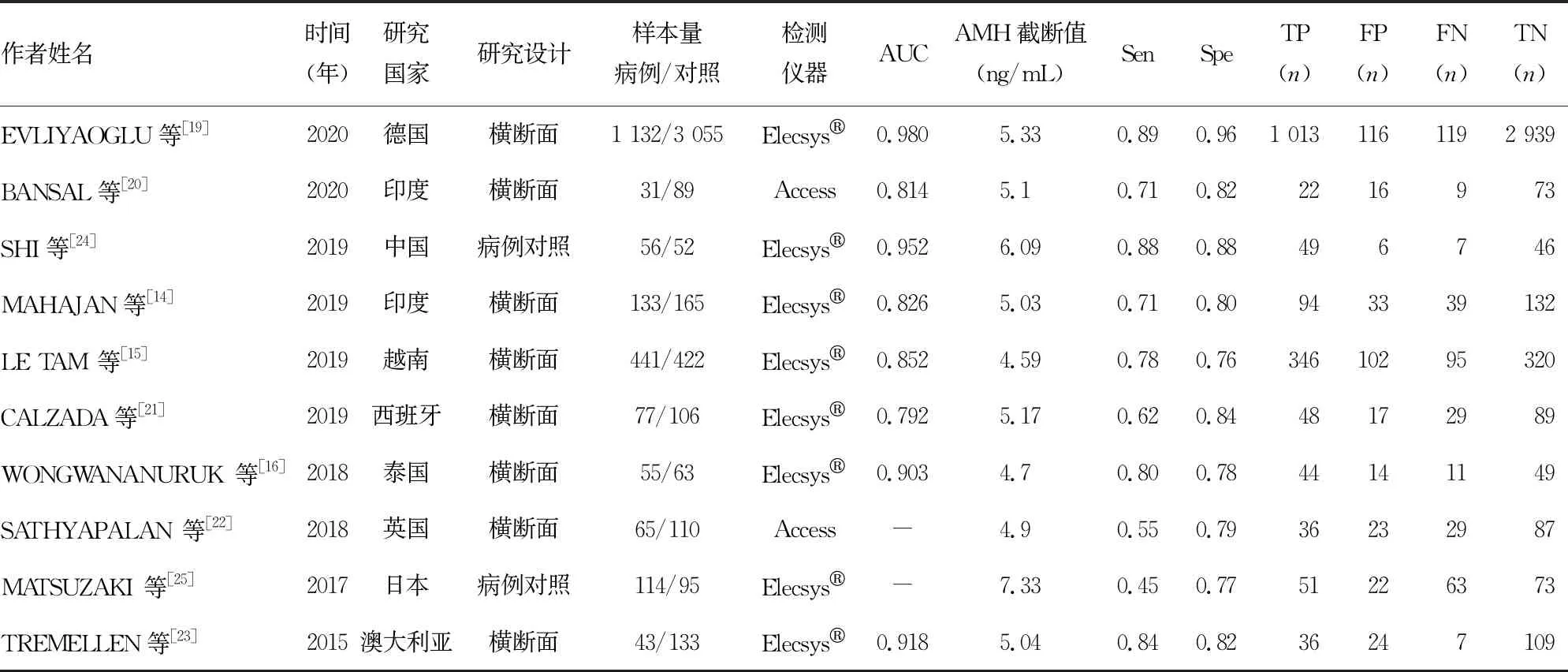
表1 纳入文献的基本特征
2.3偏倚风险和适用性结果 对于偏倚风险程度,在病例选择条目,2篇文献为病例对照研究,评估为“高风险”,其余8篇文献随机纳入病例,避免了不恰当的排除,评估为“低风险”;在待评价试验条目,10篇文献均在明确了最佳Sen和Spe之后确定的AMH阈值,评估为“高风险”;在金标准、病例流程和进展情况两个条目,10篇文献均以目前使用最广泛的标准——Rotterdam标准作为PCOS的诊断标准,且所有病例都纳入了分析,不存在失访或未纳入分析的患者,故评估为“低风险”。对于临床适用性,在病例选择条目,3篇文献的研究对象与本系统评价所针对的PCOS疾病严重程度及研究背景存在差异,评估为“适用性低”,1篇文献未明确描述纳入患者的来源,评估为“不清楚”;在待评价试验条目,2篇文献未完整描述试验实施过程,评估为“不清楚”;在金标准条目,Rotterdam标准易区分目标疾病PCOS,均评估为“适用性高”。偏倚风险和临床适用性评价结果见表2。
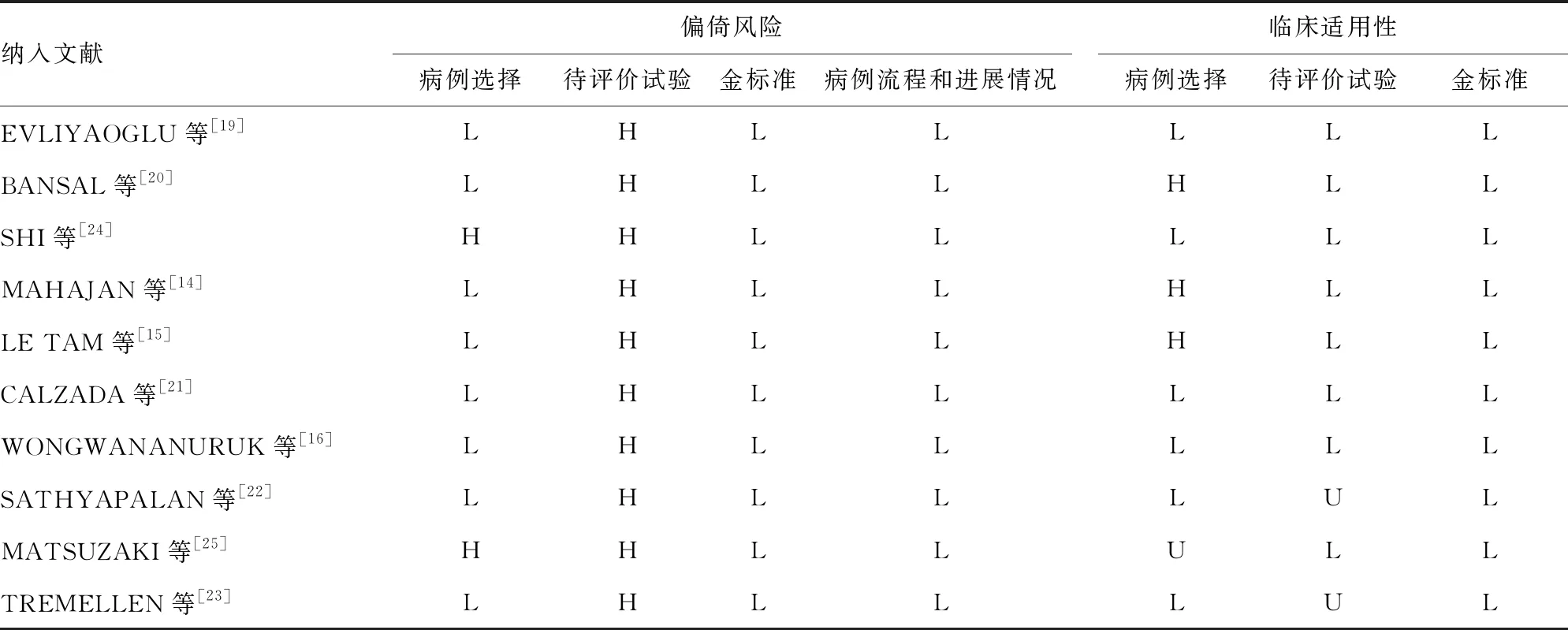
表2 纳入文献的偏倚风险和适用性评价结果
2.4异质性检验 SROC曲线分析结果显示,各研究结果对应点在图上散在分布,而不呈“肩臂状”外观;通过计算Sen对数与(1-Spe)对数的Spearman相关系数为—0.515(P=0.128),表明研究间不存在阈值效应。对纳入的10篇文献进行合并分析,各文献结果间的Sen、Spe、DOR均存在高度异质性(χ2=95.1%、96.9%、97.6%,P均<0.001),表明各文献间存在由非阈值效应引起的异质性,但未发现明显的临床异质性,故采用随机效应模型进行Meta分析。
2.5Meta分析 血清AMH水平诊断PCOS的合并Sen为0.81(95%CI0.79~0.83),合并Spe为0.91(95%CI0.90~0.92),合并DOR为14.77(95%CI4.80~45.47);SROC曲线的AUC为0.88,见图2。
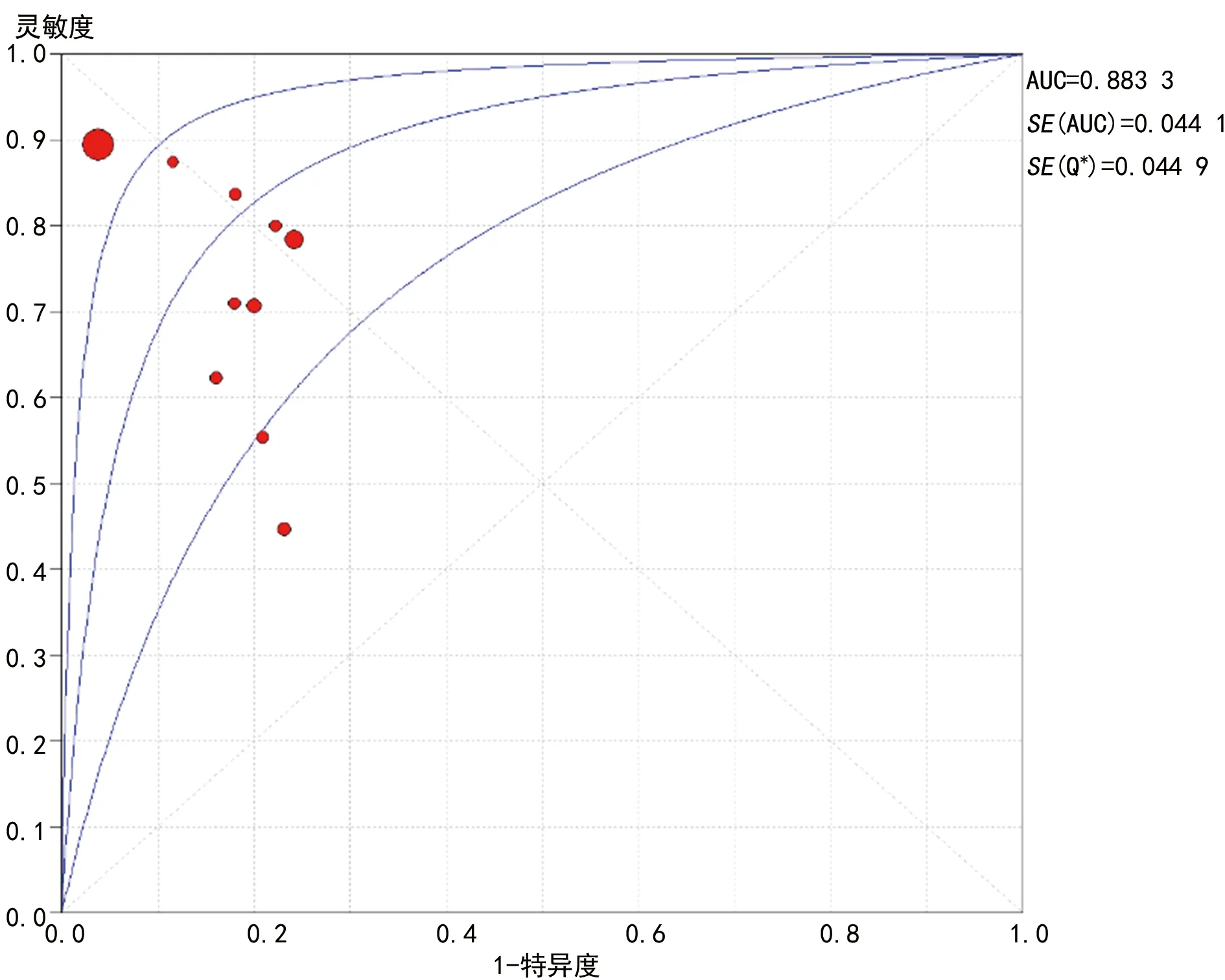
图2 血清AMH水平诊断PCOS的SROC曲线
2.6敏感性分析 逐一排除1篇文献,对剩余文献重新进行Meta分析。结果显示,排除文献后,Meta分析的结果没有明显变化,提示结果较为稳定和可靠,见图3。
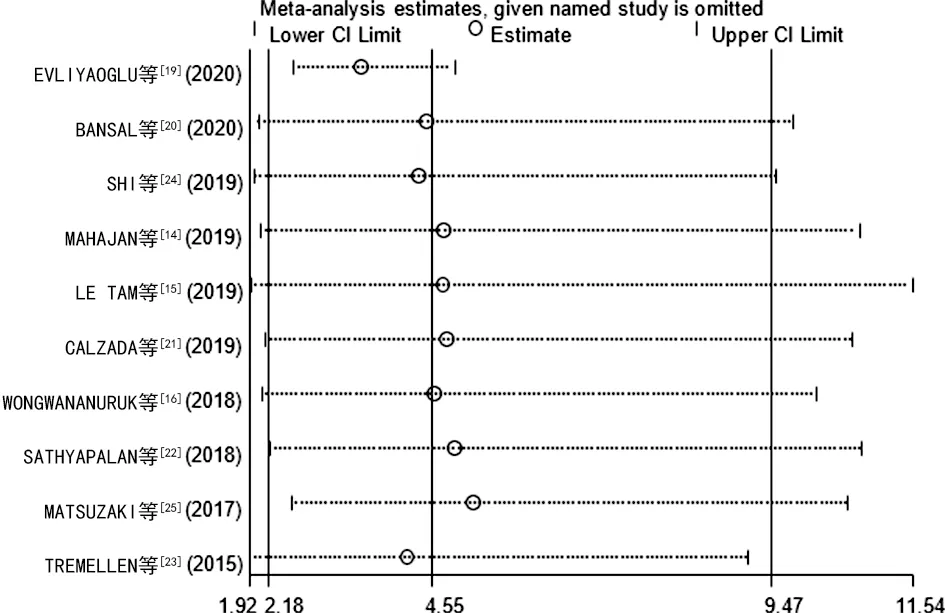
图3 敏感性分析
2.7发表偏倚 应用Deek′s漏斗图进行发表偏倚分析,结果提示存在发表偏倚的可能性(P=0.01),见图4。
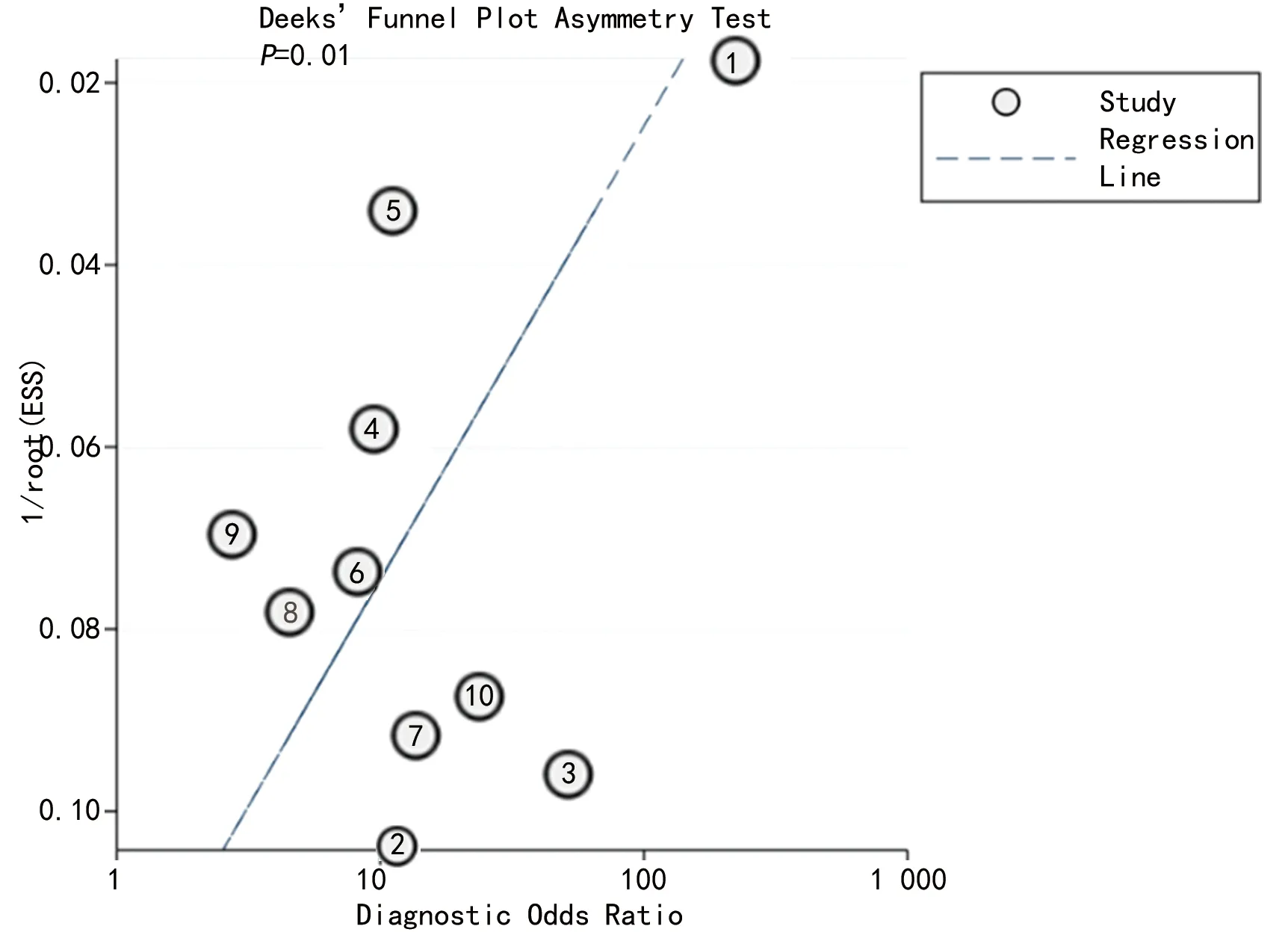
图4 发表偏倚
3 讨 论
本系统评价共纳入10篇文献,评价采用全自动化学发光免疫分析法检测血清AMH水平用于诊断PCOS的效能。结果显示,血清AMH水平诊断PCOS的合并Sen、合并Spe、AUC分别为0.81、0.91、0.88,表明诊断效能良好,漏诊率及误诊率均较低。可能的原因:一方面,Rotterdam标准中卵巢多囊样改变的诊断主要依靠超声检查,而窦卵泡计数受超声设备性能、操作人员技术水平和主观因素影响。无论是超声设备性能不足,还是操作人员技术水平有限,都会增加该诊断的漏诊率。另外,血清AMH水平可反映小窦卵泡和窦前卵泡的数量,而超声检查只能检测卵巢中小窦卵泡的数量,因此,AMH更能准确、全面地反映小卵泡水平。另一方面,在全自动化学发光免疫分析仪问世之前,临床均采用手动检测方法检测血清AMH水平,该方法缺乏统一的检测标准,稳定性较差,且试剂盒之间检测结果也存在差异。全自动检测方法标准化程度的提高减少了检测结果的误差,缩小了由检测技术、方法及检测人员造成的差异。随着检测技术的进步,血清AMH检测Sen和Spe均有所提高。
尽管目前已有3篇类似Meta分析文献分别于2013、2019、2022年发表于国外期刊[26-28],但其纳入标准和纳入的文献均与本系统评价有差异。由于全自动AMH检测技术当时尚未在临床应用,ILIODROMITI等[26]于2013年发表的Meta分析结果提示,手动检测方法检测血清AMH水平诊断PCOS的Sen和Spe分别为0.80和0.83,该方法的Spe低于全自动化学发光免疫分析法的原因可能在于检测技术本身所造成的差异;另外,该Meta分析纳入的文献中,大多数研究对象是来自生育诊所,由于患者间存在潜在差异,这可能会低估或高估血清AMH水平对PCOS的诊断效能。2019年,ZHAO等[27]对ILIODROMITI等[26]的Meta分析进行了更新,纳入了新的文献。尽管当时已有研究表明,基于全自动化学发光免疫分析法的Elecsys®系统是生化分析的最佳标准,但由于相关研究的缺乏,无法得出采用全自动化学发光免疫分析法检测血清AMH水平比其他检测方法对PCOS具有更好的诊断效能的结论。ANAND等[28]则按照AMH检测方法的不同进行了亚组分析(全自动检测方法组和手动检测方法组),结果提示检测方法对AMH的诊断效能无明显影响,但其纳入的文献与本系统评价有较大差异,且纳入文献数量少,目前的证据尚不足以得出该结论。
本系统评价纳入文献使用的阈值均是在明确了Sen和(或)Spe之后确定的,这可能会高估诊断效能。为降低研究实施过程中的各种偏倚风险,建议今后的研究应从以下几个方面进行调整:(1)建立预测模型,确定诊断阈值后再进行验证;(2)纳入足够样本,尽量开展多中心研究;(3)实验设计应按照QUADAS-2所提及的设计要点,确保实验设计严谨和规范,尽可能降低研究实施过程中的各种偏倚风险,提高研究的真实性;(4)发表文章时按照诊断准确性研究报告规范声明进行规范报告,确保信息的全面性和准确性。

