藏红花素与缺氧的关系
张鸿飞,李嘉静,古峻羽,张婷,徐靖宇,谢睿
遵义医科大学附属消化病医院遵义医科大学附属消化内科,贵州 遵义 563000
缺氧是胚胎发育的一个重要因素,但也存在于许多病理环境中,如缺血事件和癌症[1]。缺氧在生物体的细胞和组织中普遍存在,可导致代谢紊乱甚至器官衰竭[2]。藏红花(Crocus sativusL.)是鸢尾科开花植物[3],原产于伊朗、西班牙、克什米尔(印度和巴基斯坦)、希腊、阿塞拜疆、中国等地,在各个方面被长期应用及研究,已成为许多药理学配方的一部分,被列入药用植物目录和欧洲药典[4]。研究表明,藏红花素具有抗炎、抗氧化、抗凋亡、抗肿瘤等活性,在预防缺血、视力保护、免疫调节、抗惊厥、抗抑郁、抗焦虑、降血脂、抗动脉粥样硬化、抗高血压、抗糖尿病和抗癌等疾病的治疗中被广泛应用[5-9]。
缺血再灌注(I/R)损伤是由于器官细胞缺血引起损伤,再灌注后在细胞、器官恢复氧气的过程中会导致损伤加重[10]。这一损伤过程通常易发生在依赖氧的器官中,比如肝脏、肾脏、胃、心脏、大脑和肠道等器官中[11]。在缺血发生时,细胞大分子氧化损伤会导致自由基的产生,从而激活活性氧(ROS)的产生。在局部缺血期间,缺氧伴随发生,缺氧会中断氧化磷酸化,从而诱导细胞ATP 的消耗[12]。有大量研究支持藏红花素可作为I/R 损伤保护剂存在。有实验证明藏红花素可治疗缺氧引起的相关疾病,本文将从缺氧与藏红花素之间的治疗及机制进行综述。
1 藏红花素在消化系统疾病中的作用
1.1 藏红花素与胃癌的关系 胃癌是全世界常见的恶性肿瘤之一,虽然现如今检测方法和治疗手段有了明显的进展,但是晚期胃癌的预后差,且复发和转移发生率高。Krüppel-like factor 5(KLF5)是KLF转录因子家族的成员之一,在许多癌症类型中异常表达,有研究认为其可成为癌基因或肿瘤抑制因子存在[13-14]。HIF-1 是一种特异性转录因子,在缺氧条件下具有活性,缺氧诱导因子1(HIF-1)及其信号通路在代谢适应缺氧应激中发挥重要作用[15]。实体瘤时通常会发生缺氧,这是其标志之一,而缺氧时,机体为了适应这一变化,会激活转录因子缺氧诱导因子-1(HIF-1)。有研究表明,KLF5 在胃癌中频繁扩增[16],而HIF-1α在人胃癌中过表达,并被发现决定胃癌细胞的转移潜能[17]。另有研究表明,KLF5 是结肠癌细胞中HIF-1α的反式激活因子[18]。癌细胞转移时会激发上皮-间质转化(EMT)。有研究表明,藏红花素治疗降低了胃癌细胞中KLF5 的水平,而KLF5 的上调减弱了藏红花素对胃癌细胞的迁移、侵袭和EMT 的作用,因此,藏红花素通过减少胃癌中KLF5 的表达来抑制迁移、侵袭和EMT[19]。miR-320 是胃癌中的肿瘤抑制因子,其在胃癌组织中的表达减少,且可以抑制胃癌的增殖和侵袭[20]。而KLF5 的上调显著增加HIF-1α的表达,经藏红花素治疗后降低了HIF-1α的表达,KLF5 表达与胃癌组织中HIF-1α水平呈正相关,所以,藏红花素主要通过抑制KLF5/HIF-1α信号发挥作用[19]。因此,藏红花素抑制胃癌细胞的EMT、迁移和侵袭,其主要是通过调节miR-320/KLF5/HIF-1α信号传导发挥作用,KLF5 的上调显著增加HIF-1α的表达,而藏红花素降低了HIF-1α的表达,且藏红花素通过增加miR-320水平来降低KLF5的表达,综上所述,藏红花素主要通过抑制KLF5/HIF-1α信号发挥抑癌作用[19]。因此,藏红花素通过抑制缺氧而达到治疗胃癌的作用(图1)。
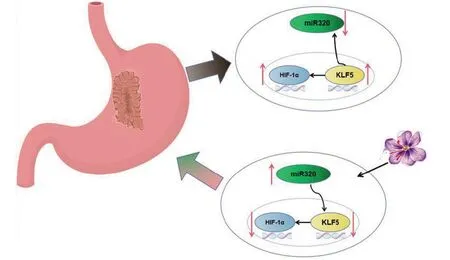
图1 藏红花素抑制胃癌机制图Figure 1 Mechanism of inhibition of gastric cancer by Crocin
1.2 藏红花素与结肠癌的关系 结肠癌是世界常见四大恶性肿瘤之一[21],藏红花素被广泛应用在各种肿瘤治疗中,有研究表明,藏红花素在结肠癌中可诱导细胞凋亡、抗增殖,从而达到抗肿瘤效果[22]。另有研究表明,KLF5 是结肠癌细胞中HIF-1α的反式激活因子[23]。因此可以大胆推测,在结肠癌治疗中,藏红花素可能不仅仅是通过诱导细胞凋亡达到抗癌效果,并且缺氧可能也在其中参与这一过程,这需要进行更深入的研究。
1.3 藏红花素在肝脏缺血再灌注中的作用 肝脏IR 损伤对于肝移植以及创伤和切除手术中起着关键的作用[23],是影响术后器官存活的主要问题[24]。肝脏缺血再灌注损伤后会发生一系列生理生化变化。线粒体的活性因为组织缺氧、营养和缺血期代谢反应的破坏而受到损坏,从而导致肝细胞损伤。近年研究表明,氧化应激是导致损伤的原因之一,氧化应激导致细胞凋亡,进而导致器官衰竭[25]。而抗氧化剂治疗可以改善肝脏微循环和器官功能[26],因此有研究通过用藏红花预处理大鼠,夹闭大鼠门静脉和肝动脉60 min进行缺血再灌注,结果提示内源抗氧化剂水平在IR期间显著降低,藏红花处理可以促进抗氧化酶如过氧化氢酶和SOD1的含量,有助于清除H2O2和其他自由基,因此,在再灌注早期应用外源性抗氧化剂,可以有效地阻止ROS 的产生和分解IR诱导的ROS。藏红花通过维持抗氧化酶的功能和ER稳态在保护肝脏免受IR损伤中具有关键作用[27]。SEE(saffron ethanol extract)可以通过提高抗氧化能力来预防IR 损伤[27]。大鼠缺血时,会导致组织缺氧,藏红花素在逆转氧化应激时,对于缺氧的治疗现暂未有相关研究报告。因此,藏红花素治疗氧化应激时,有没有可能通过调节缺氧相关因子或通过相关通路而达到抗氧化作用,尚需进行更深入的研究。肝脏缺血再灌注后还会引起肾脏损伤,其发生率高达40%~85%[28]。肝脏缺血再灌注后会引起肾组织损伤,其病理生理学变化是由于氧化应激引起的,主要是产生ROS 造成损伤[29],而活性氧产生的自由基可以破坏内皮细胞、肾小管上皮细胞和肾小球膜细胞[30]。肝脏IR 可能通过增加丙二醛水平和降低超氧化物歧化酶(SOD)和过氧化氢酶(CAT)的活性导致肾脏氧化应激,而SOD 和CAT 通过清除细胞内的ROS保护由IR诱导的细胞损伤[31]。有一个假说提示,门静脉高压后可能发生内脏血管扩张,肾内缺血后会导致系统性低血压和肾素-血管紧张素系统激活。最后,缺氧导致肾小管坏死和这个器官的紊乱[32]。有研究表明,藏红花素预处理能有效地抑制了肝损伤后肾组织的破坏作用[33],而藏红花素可能通过增加SOD 和CAT 的抗氧化酶活性而保护肾组织免受缺血再灌注损伤[30]。该研究提示,藏红花素预处理后抗氧化酶(SOD、CAT)的活性都增加了[33]。这表明,藏红花素预处理通过增加抗氧化酶的活性,改善肾功能,并且改善肾脏的组织病理学变化,在缺血再灌注诱导的肝损伤后具有肾脏保护作用。这提示肝脏缺血再灌注后,不仅会导致肝脏损伤,还会损伤肾脏,由于缺血、缺氧,会引发氧化应激,而藏红花素会纠正这一变化,保护肝脏的同时保护肾脏。
2 藏红花素在神经系统中的作用
2.1 藏红花素与中风的关系 中风是导致死亡及长期残疾的主要原因之一[34],其中缺血性中风约占80%[35-37],缺血性中风的最主要原因是由于血栓形成导致血管阻塞、脑部血流中断所导致的[37-38]。有研究表明,藏红花素对于因氧化应激而导致的细胞死亡有提前预防作用[39]。对于中风患者来说,导致病情严重与否的关键是神经行为结果而不是梗死面积,有研究发现,藏红花素显著改善了神经系统预后,同时减少了脑梗死面积[40]。同时发现另一研究发现也支持该结果,建造大鼠局灶性脑缺血模型,并提前一周给予大鼠口服藏红花素,可明显改善大鼠的神经行为[41]。脑缺血后会产生氧化应激和自由基,导致血脑屏障中断和脑水肿的形成[42]。因此有相关研究报道,藏红花素可以增加细胞抗氧化酶的能力和减少自由基的产生,从而保护细胞,使其免受脑卒中后的氧化应激损伤[40]。在脑缺血发生时,缺氧会加重氧化应激,从而加重脑缺血的发生,很多研究都表明藏红花素可以治疗缺氧所致的相关损伤。藏红花和藏红花素的抗氧化作用可以认为是中枢神经系统抵抗缺氧引起的氧化损伤的潜在保护机制[43]。
2.2 藏红花素在脑缺血再灌注中的作用 脑IR
损伤是由于氧化应激和凋亡机制所导致的[44]。有研究发现,藏红花素可有效抑制小鼠全脑缺血后缺血再灌注引起的脑微血管血管损伤[45]。本文前面也提到过,藏红花素可以减少脑梗死面积,而有研究通过建造大鼠缺血-再灌注模型时发现,藏红花素同样也可以减少大鼠缺血-再灌注模型中的脑梗死体积[46]。但是相关机制是怎样的呢?脑组织作为富氧器官,容易受到氧化损伤,且大脑的抗氧化酶活性很弱,因此,减轻氧化应激可以增加脑缺血后神经元的存活率,并为发展神经保护提供策略方法[47]。海马CA1 区域是大脑中最脆弱的区域之一,在短暂脑缺血损伤后会发生该区域的神经元死亡。在I/R 发生时,氧化应激时产生的ROS 会导致神经元丢失[48],并且ROS 积累会增加凋亡细胞死亡的发生率[49]。Caspase 3 是一种白细胞介素转化酶,是凋亡细胞死亡途径中的基本的受体和指示凋亡活性的可靠标志物,多项研究表明其可在脑缺血后增加[50-52]。HIF-1α作为细胞适应缺氧的重要转录因子存在,在缺血、缺氧期间激活各种促凋亡基因的表达参与细胞死亡[53]。有研究表明,HIF-1α和caspase-3诱导之间存在因果关系,HIF-1α可功能性结合到caspase-3 基因启动子[54]。四血管闭塞模型诱导的全脑缺血再灌注损伤的大鼠模型中,藏红花素治疗导致HIF-1α、caspase-3的表达降低,表明施用藏红花素可以保护大脑免于凋亡,可能是通过抑制HIF-1α和caspase-3 通路,而藏红花素治疗可能会减弱细胞凋亡,这可能是通过降低ROS 产生诱导的氧化应激指数和抑制脑缺血后HIF-1α和caspase-3 的蛋白质表达来介导的[55]。
2.3 藏红花素在阿尔兹海默病中的作用 阿尔茨海默病(AD)是最常见的痴呆症,其中神经细胞死亡会导致记忆丧失和认知障碍[43],AD 的病理特征是β-淀粉样蛋白(Aβ)肽在细胞外形成和积聚斑块,Tau蛋白沉积为神经原纤维缠结,以及神经元和突触的丧失[56]。神经元对缺氧非常敏感,因此缺氧情况会加重AD 的发病率[57]。AD 通过分泌酶裂解淀粉样前体蛋白产生的β-淀粉样肽导致神经元死亡和痴呆,缺血等缺氧条件会改变分泌酶的表达,增加β-淀粉样蛋白的积累、增加tau 蛋白的磷酸化、破坏血脑屏障的功能和使神经元变性,并进一步促进β-淀粉样肽的过度产生和聚集,致使脑功能受损[58]。ΒACE1和早老素-1通过连续蛋白水解分裂将β淀粉样前体蛋白(APP)转化为β淀粉样肽(βA),低氧时通过上调ΒACE1 mRNA的水平来增加ΒACE1 的表达和酶活性[59]。HIF-1α作为细胞缺氧的重要转录因子,可以介导ΒACE1 的过度表达[60]。有研究表明,缺氧后会诱导HIF-1α的表达增加,从而导致ΒACE1 的活性增加,而ΒACE1 因HIF-1α的表达增加而增加[61]。并且ΒACE1的活性增加,可以导致APP(amyloid precursor protein)中β-淀粉样蛋白(βA42和βA40)的产生[62-63]。因此缺氧强度是缺氧导致脑功能障碍的重要因素[64]。有研究表明,β-淀粉样蛋白相关基因(ΒACE1 和HIF-1α)的表达随着缺氧强度和持续时间的增加而增加,而经过藏红花素治疗后,可降低这些基因的表达,并改善记忆[64]。因为自由基和抗氧化剂的产生之间的不平衡是导致AD的另一个原因,高效化O2、多不饱和脂肪酸和抗氧化剂低水平,大脑及其容易受到氧化应激的影响[65]。Aβ的积累会诱导氧化应激,而氧化剂增加Aβ的产生[65]。缺氧反应中ROS 的来源是线粒体,有研究表明,藏红花的抗氧化特性可以被认为是保护中枢神经系统神经元免受缺氧导致的记忆障碍引起氧化损伤的一种可能机制,因为藏红花和藏红花素会破坏和消除像ROS这样的自由基[66]。
2.4 藏红花素母体缺氧的关系 在胚胎和成熟动物中,缺氧可能与自由基合成增加、脂质过氧化激活、细胞外钙离子浓度降低以及Na-K-ATP 酶泵活性降低有关[67-70]。缺氧环境是各种神经退行性疾病发病的因素之一,有研究认为,怀孕期间的缺氧会影响婴儿行为并改变海马体功能[71]。产前缺氧是最常见的缺氧形式,可能增加流产的风险,导致胎儿大脑发育异常,并且导致儿童期神经元发育障碍,更有甚者可能会导致青春期后代大鼠的学习和记忆障碍[72-73],且缺氧持续时间、缺氧强度和胎儿年龄可能是引起的暂时性脑功能障碍或永久性脑损伤的重要因素[74]。因此,有研究表明,母体缺氧可能导致记忆缺陷,研究者通过Morris水迷宫发现,缺氧会降低探测阶段目标象限的平均行进距离,而藏红花素预处理组增加了目标象限的行进距离[64]。另有研究发现,母体缺氧通过增加HIF-1α基因的表达增加了后代大脑中ΒACE1 酶mRNA1 的转录,继之促进了β位点APP 向β-淀粉样蛋白的转化,从而导致记忆障碍。而藏红花素治疗通过降低HIF-1α和ΒACE1 基因的表达来改善记忆障碍[43]。通过研究三种不同氧强度的母体缺氧方案中对大鼠子代运动活动和平衡的影响,发现母体缺氧通过氧化应激等不同的机制导致后代的运动损伤,而缺氧的强度和持续时间影响运动损伤的严重程度,藏红花素作为抗氧化剂化合物可以观察导积极作用[70]。
2.5 藏红花素与缺氧缺血性脑病的关系 缺氧缺血性脑病(hypoxic-ischemic encephalopathy,HIE)通常发生在出生前或出生前后,此时大脑的血流量和氧气供应减少,是一种严重的疾病。发生率大概为1.5/1 000 活产,严重时可能导致严重脑损伤、新生儿死亡的发生[75]。HIE 的病理生理中炎症和氧化应激至关重要[76-77]。有研究发现,低温可以减少小鼠HIE 模型中的氧化应激和炎症,而藏红花素能增强缺氧缺血后低温治疗的效果,可作为HIE低温治疗的一种综合治疗方法[77]。
2.6 藏红花素在急性高原缺氧的作用 急性高原缺氧会影响血流及器官的血流分布,并且影响O2利用率。急性高原缺氧最容易损伤大脑,导致头痛、头晕、视力模糊、耳鸣、空间学习和记忆障碍,严重时可能引起病理变化[78-80]。高原缺氧会引起氧化应激,导致大鼠脑海马海马线粒体形态发生快速和严重的损伤,严重影响海马主要神经元的结构完整性,致使锥体细胞数量减少,导致海马依赖性学习和记忆功能下降[81-83]。Sirtuin-1(沉默信息调节因子1)主要存在于大多数细胞类型的细胞核中,Sirt1 去乙酰化并抑制HIF-1α的活性,而HIF-1α抑制线粒体功能和耗氧量,因此有研究认为,Sirt1活性可能通过HIF-1α影响线粒体呼吸功能[84]。线粒体的生物发生是由过氧化物酶体增殖物激活受体Gamma Coactivator-1 (PGC-1)家族的转录共激活因子协调的,而PGC-1α(过氧化物酶体增殖物激活受体γ辅激活因子-1α)是该过程的主要调节剂[85]。Sirt1及其底物PGC-1α通过线粒体调节能量代谢的各个方面[86]。Sirt1 可对PGC-1α的去乙酰化起作用,Sirt1 通过增加胰岛素敏感性、减少循环游离脂肪酸、增加PGC-1α活性以及增加线粒体数量来增加细胞抗应激能力[87]。SIRT1 通过调节PGC-1α的转录表达影响线粒体生物发生,SIRT1/PGC-1α是线粒体生物合成的中心调节因子,上调SIRT1/PGC-1α通路的表达可以增加mtDNA 的表达和线粒体生物发生[88]。有研究发现,藏红花素显著减少了海马神经元损伤;改善海马神经元的组织形态学;藏红花素可修复海马神经元的超微结构和增加海马中Sirt1和PGC-1α的表达,改善了大鼠体内急性低压缺氧诱导的认知缺陷的学习和记忆缺陷[89]。藏红花素可提高急性高原缺氧大鼠的学习记忆能力,并通过调节大鼠海马中的SIRT1/PGC-1α通路在缺氧条件下表现出认知保护作用[90]。
3 藏红花素在心血管系统中的作用
3.1 藏红花素在心肌缺氧中的作用 心血管疾病(CVDs)是全球死亡的主要原因,ROS在许多心血管疾病中起着至关重要的作用,其不受控制的产生与心肌损伤有关[91]。缺血性心脏病中ROS 增加的原因之一是心肌缺血缺氧后,心肌细胞的能量供应不足,三磷酸腺苷降解产物(黄嘌呤和次黄嘌呤)的水平增加,从而在黄嘌呤转化为尿酸的代谢过程中产生大量的ROS[92]。心肌缺血(myocardial ischemia,MI)是由于血液灌注和供氧减少以及心肌能量代谢异常而不能支持心脏正常功能的一种病理状态。高血压、主动脉瓣关闭不全和冠状动脉闭塞是心肌梗死的危险因素。氧化应激是诱发心血管功能障碍的关键因素,它使内皮功能恶化,导致供血不足,这可能是心肌梗死的病理基础。心肌I/R 损伤导致心脏功能障碍、组织损伤和代谢变化[93]。ROS 和脂质过氧化是心肌IR 损伤的原因,会导致细胞大分子(包括膜脂、蛋白质和核酸)发生氧化损伤[94]。有研究表明,藏红花素具有抑制各种氧化应激产生的活性氧的能力[95],藏红花素不仅减轻氧化应激,而且可以作为延缓缺血性心脏病进展的辅助治疗[96]。那么藏红花素治疗心血管疾病、抗氧化的机制是什么呢,缺氧在心血管疾病所致的氧化应激中又扮演着什么角色,起着什么作用呢?HIF-1 是调节细胞对缺氧反应的重要转录因子,在组织细胞对ROS的反应中起关键作用,是调节参与细胞代谢、血管生成、细胞周期调节和凋亡的各种基因[97]。泛素(Ub)是一种蛋白,用泛素标记底物蛋白的过程称为泛素化,泛素化为蛋白质-蛋白质相互作用提供了分子表面。许多生物过程由泛素化调节,包括DNA 修复和复制、基因表达、凋亡、内吞作用和免疫反应等[98]。而ROS 可以诱导蛋白质泛素化的变化。ROS 可导致包括泛素化在内的蛋白质发生严重的可逆和不可逆变化[99]。多项研究表明,ROS 与HIF-1α信号转导有关[100]。氧化还原系统在不同条件下对HIF-1α的调节也有重要作用[99]。在缺氧条件下,ROS 通过多种信号通路激活HIF-1α,达到保护细胞的作用。肿瘤抑制蛋白von Hippel-Lindau (VHL)是E3 连接酶泛素化的成分之一,在常氧条件下,泛素/蛋白酶体途径通过该蛋白降解HIF-1α。由位于氧依赖降解域的氧依赖脯氨酰羟化酶(PHDs)的翻译后羟基化触发这一过程,在缺氧情况下,阻断了HIF-1α的羟基化,在稳定HIF-1 的同时保护细胞免受缺氧损伤[97]。二嗪农(DZN)是一种被广泛用于农业的化学药品,经研究其急性和慢性毒性会诱发氧化应激,产生自由基和抗氧化剂或ROS清除酶的变化,有研究通过使用DZN 诱发氧化应激,增加了大鼠心脏组织中总蛋白的泛素化发生,该研究表明,DZN可以增加HIF-1α蛋白水平,降低HIF-1α泛素化,而藏红花素通过抗氧化特性降低DZN诱导的蛋白质泛素化,并且通过调节细胞氧化还原系统增加HIF-1α的泛素化[100]。因此,藏红花素可通过调节缺氧而达到抗氧化的作用。另有研究表明,HIF-1 在低氧条件下可影响缺氧反应的基因表达[101],使用CoCl2可导致HIF-1α血管内皮生长因子增加,而藏红花素可通过促进缺氧所致的HIF-1α蛋白表达增加,激活其下游的血管内皮生长因子等表达,促进血管再生或扩张,提高心肌对缺氧的耐受力和适应性,且藏红花素可能会减少HIF-1α的表达[100](图2)。
3.2 藏红花素对心肌缺氧细胞保护作用 MiR-210是一种缺氧特异性miRNA,在含氧量正常的内皮细胞中过表达刺激了毛细血管样结构的形成以及血管内皮生长因子(VEGF)驱动的细胞迁移[102],并可诱导缺氧反应,其依赖于HIF 激活并在缺氧后上调[103]。有研究提出,在运动过程中,心肌中可能会出现局部缺氧情况,并且缺氧情况会通过HIF-1α诱导的miR-210 表达引发许多生理反应[104]。有研究表明,藏红花素对心肌细胞缺氧损伤的保护作用是通过升高血管内皮生长因子(VEGF) 作为一种促血管生成因子[105]。因此,藏红花素与自主运动相结合可促进心脏血管生成,这可能与miR-210 的表达有关[106]。藏红花素在心血管相关疾病中可以抑制缺氧产生的损伤,从而达到保护作用。

图2 藏红花素在心脏组织中抗氧化作用的机制图Figure 2 A mechanistic map of the antioxidant effect of crocin in heart tissue
4 藏红花素在眼部疾病中的作用
很多研究表明,在眼部许多疾病中,视网膜缺血是由于不可逆的神经元细胞死亡,比如缺血性视神经病变、糖尿病性视网膜病、发红性青光眼和眼部缺血综合征[107]。有研究报道,缺氧诱导因子(HIF)通路的异常激活是视网膜新生血管形成的根本原因[108]。藏红花素的神经保护作用可能是由于抗炎及抗氧化作用所致的[109],而抗炎及氧化的作用可能是由于抑制不同机制的氧化应激,这其中缺氧所发挥的作用,值得保持长期关注。
IR 损伤发生后,视网膜变性导致视网膜神经节细胞层(GCL)中的神经元大量丢失[110]。有研究表明,藏红花素对视网膜I/R 损伤后视网膜神经节细胞(RGC)有神经保护作用[111]。藏红花素可改善视网膜和脉络膜血流,并促进眼内压(IOP)升高后的视网膜功能恢复[112]。但藏红花在改善血流时,是否可通过逆转缺氧而达到此目的,尚需深入研究。
氧化应激可能是导致视网膜缺血的重要机制,在缺血和再灌注后形成ROS 和自由基会触发膜的脂质过氧化、蛋白质变性和DNA 损伤[113],有研究报道,通过结扎翼腭动脉(PPA)和颈外动脉(ECA)制造视网膜缺血模型,再灌注后口服藏红花素可防止I/R 诱导的视网膜细胞死亡,而藏红花素的该作用可能部分是由其抗氧化作用介导的,为了测试藏红花素对视网膜缺血性损伤的保护作用是否至少部分是由其抗氧化作用引起的,该研究检测了氧化应激标志物,结果表明藏红花素对I/R诱导的氧化应激具有预防作用[114]。
有大量研究表明,缺氧会诱发氧化应激,而藏红花素可逆转氧化应激,因此,研究眼部相关疾病中的缺氧与藏红花素的关系是今后关注的重点。
5 藏红花素在骨骼肌中的作用
骨骼肌的缺血和再灌注损伤影响急性缺血肢体血运重建后的发病率和死亡率,因此在I/R 期间减少或预防肌肉损伤,是现在关注的重点[115]。骨骼肌缺血的许多过程与缺氧诱导的细胞损伤的发病机制有关,因此,抗氧化疗法已被充分证明有助于改善器官功能。有研究通过通过夹闭股总动脉和静脉诱导后肢缺血,缺血2 h 后,取下动物股动脉血管夹,对动物进行1 h 再灌注,再灌注前1 h 腹膜内给予藏红花素,结果表明,藏红花提取物及其成分藏红花素对大鼠肌肉I/R 损伤引起的氧化应激有保护作用[116]。因此可以推测在缺血过程中会导致缺氧发生,而缺氧可能诱发氧化应激,而藏红花素对该损伤有保护作用。因此可以猜测藏红花素逆转氧化应激的机制可能有缺氧参与其中。
6 总结
I/R主要包括缺血后再灌注,在许多疾病的发病机理中起主要作用。缺血是由于阻塞动脉血液供应的栓子引起的组织供氧不足,而再灌注是由于阻塞血流的恢复[24,117]。有研究发现缺血会导致缺氧和炎症信号级联的翻译后激活[24,118]。比如说,由于局部缺血引起的缺氧被发现会导致代谢异常和有害的细胞损伤[117]。有大量研究表明,缺血会诱导血管缺氧,增加血管通透性[119-121]。而再灌注诱导的炎症反应进一步恶化了微血管功能障碍[122]。缺血/再灌注损伤(IRI)是由于缺乏血液供应和随后的再灌注引起的氧化应激,I/R期间产生的氧化应激在IRI中起关键作用[123],其主要原因是产生ROS,而ROS的主要来源之一是线粒体中的电子传输链[124],线粒体是与膜电位、ATP、钙负荷和凋亡途径相关的结构,再灌注过程中会重新引入氧气,而缺血会导致线粒体功能障碍、ROS 快速增加[125]。大量ROS 的产生可通过诱导脂质过氧化直接导致细胞膜破坏[126],而抗氧化剂通过对ROS 产生影响来减少IR 损伤。IRI 多发生于心脏、大脑和肾脏等依赖氧的器官中[117]。由此可以得出结论,I/R发生时,会引起缺氧,而缺氧会产生氧化应激,而藏红花素可逆转缺氧及氧化应激,从而达到治疗效果。而有研究表明,藏红花素的保护作用机制可能与作为对缺氧的反应而激活HIF-1介导的途径有关[105]。
众多研究表明,藏红花素有抑制肿瘤的作用,其机制也很复杂。其中有研究发现,藏红花素可降低p53的表达达到抑癌作用。p53是肿瘤抑制因子之一,主要通过抑制细胞周期和细胞凋亡来发挥作用[127]。氧化应激后发生的损伤,如自由基、活性氧和缺氧可激活p53[128-129]。p53 可发挥保护作用,使肝脏免受IR损伤[130]。有研究表明,藏红花素预处理后可增加抗氧化活性,同时降低了p53蛋白的表达[131]。因此,可以得出一下结论,缺氧会诱发氧化应激,激活p53,而藏红花素的抗氧化活性可降低p53 的表达,逆转缺氧导致的氧化应激,从而发挥抗氧化作用。
藏红花及其代谢产物因其众多的治疗特性而被广泛应用在传统医学中,这篇综述试图从缺氧这一角度探讨藏红花素的治疗机制,也为以后对于藏红花素的抗氧化、抗肿瘤等治疗机制的研究途径提供新的思路。

