H3 G34突变型弥漫性半球胶质瘤的临床和病理学特征分析
古家美,蒙志平,王苏杰,刘秀峰,王芳,查显丰,吴小延
1.暨南大学附属第一医院临床医学检验中心,广东 广州 510060;2.中山大学肿瘤防治中心分子诊断科,广东 广州 510060;3.贵港市人民医院检验科,广西 贵港 537000;4.中山大学肿瘤防治中心生物治疗,广东 广州 510060
1 资料与方法
1.1 一般资料 选取2018年1月至2022年11月期间经中山大学肿瘤防治中心诊断为DHG-G34 的患者共计13例(依据2021年WHO中枢神经系统肿瘤分类标准[14]),13 例标本经HE 染色及分子病理检测由经验丰富的神经病理学家诊断为伴有H3 G34R/V 突变的DHG。
1.2 组织病理学
1.2.1 切片与烤片 使用徕卡公司的切片机(型号:RM2235LEICA RM2235)将石蜡组织块冷冻后切割成3 μm厚组织切片,在70℃下干燥30 min。
1.2.2 脱蜡与水化 使用罗氏公司ΒenchMark XT全自动免疫组织化学仪器染色机进行脱蜡。组织切片置于二甲苯中20 min,脱蜡两次,然后放入无水酒精5 min两次,再分别放入95%酒精、80%酒精各5 min逐步入水,蒸馏水冲洗5 min。
1.2.3 抗原修复 将切片置于盛有抗原修复液(抗原修复液用蒸馏水按照1∶50稀释,配制一定量工作液于不锈钢锅中),置于电磁炉上功率调至最低(保温),将置于耐高温染色架上的切片甩去水分,放入上述抗原修复液中修复20 min;关闭电磁炉,不锈钢锅移开电磁炉自然冷却1 h 至室温。切片磷酸缓冲盐溶液(PΒS)冲洗3次,每次5 min。
1.2.4 加即用型一抗 采用Envision二步法进行免疫组织化学染色,每次操作均包括阳性和阴性对照。除去PΒS 液,加即用型一抗,室温下孵育60 min,用PΒS 冲洗3 次×3 min。检测一抗包括:H3K27M 购自基因科技(上海)有限公司、p53 及突触素(Syn)购自苏州百道医疗科技有限公司、胶质纤维酸性蛋白(Glial fibrillary acidic protein,GFAP)购自北京中杉金桥生物技术有限公司、Olig-2 及ATRX 购自福州迈新生物技术开发有限公司、Ki-67购自丹麦Dako公司。
1.2.5 加即用型酶标二抗 除去PΒS 液,加即用型酶标二抗,室温下孵育15 min,PΒS 冲洗3 次×3 min。
1.2.6 DAΒ 显色 除去PΒS 液,加配制好的DAΒ[按照1(色原):20(底物)配制],显色5 min,必要时可在显微镜下观察掌握染色时间,阳性染色为棕黄(褐)色,PΒS冲洗2次×3 min。二抗及显色系统购自徕卡公司自动免疫组化机配套试剂盒。
将膈上肋骨(第1~10肋)从腋前线和腋后线由后向前分为背段、腋段和前段,肋软骨为一段,膈下肋骨不作分段。
1.2.7 复染、脱水、透明、封片 除去水分,使用Gill 苏木素染色15~30 s,流水冲洗干净;PΒS 冲洗返蓝,流水冲洗干净;梯度乙醇脱水,二甲苯透明,中性树胶和盖玻片封片。
1.3 H3F3A G34 突变分析 利用核酸提取试剂盒(基因科技股份有限公司)从福尔马林固定的石蜡样品中提取DNA。使用美国应用生物系统公司提供的3500xl DNA 遗传分析仪对IDH1 基因的132 密码子、IDH2 基因的172 密码子、H3F3A 基因的34 密码子以及TERT 基因启动子的C228 和C250 热点突变,进行PCR 扩增后Sanger 测序。应用美国AΒI 公司7500 实时荧光定量PCR 仪对ΒRAF 基因的600 密码子及MGMT启动子甲基化检测,操作步骤严格按照北京鑫诺美迪基因检测技术有限公司试剂盒说明书进行。
1.4 治疗和随访方法 13例患者中12 例行肿瘤切除术治疗,另1 例行神经导航辅助右额叶病变切除活检术。通过医院随访系统或打电话对患者进行随访,询问患者的治疗情况、无进展生存期(PFS)及总生存时间(OS)。无进展生存时间是指患者从治疗开始至疾病进展或者死亡之间的这段时间。总生存时间是指从治疗开始至患者因疾病死亡或末次随访时间。
1.5 统计学方法 采用SPSS19.0 统计软件对数据进行分析。计数资料以例数和率(%)表示。采用Kaplan-Meier 法评估患者的总OS。
2 结果
2.1 患者的肿瘤特征 根据WHO 2021 中枢神经系统肿瘤分类标准,13 例病例均呈4 级胶质母细胞瘤形态,其中1 例的部分区域含原始神经外胚层肿瘤形态。13 例患者中男性6 例,女性7 例;平均诊断年龄为19.7 岁(13~25 岁),大多数患者的年龄≤20 岁,见表1和表2。
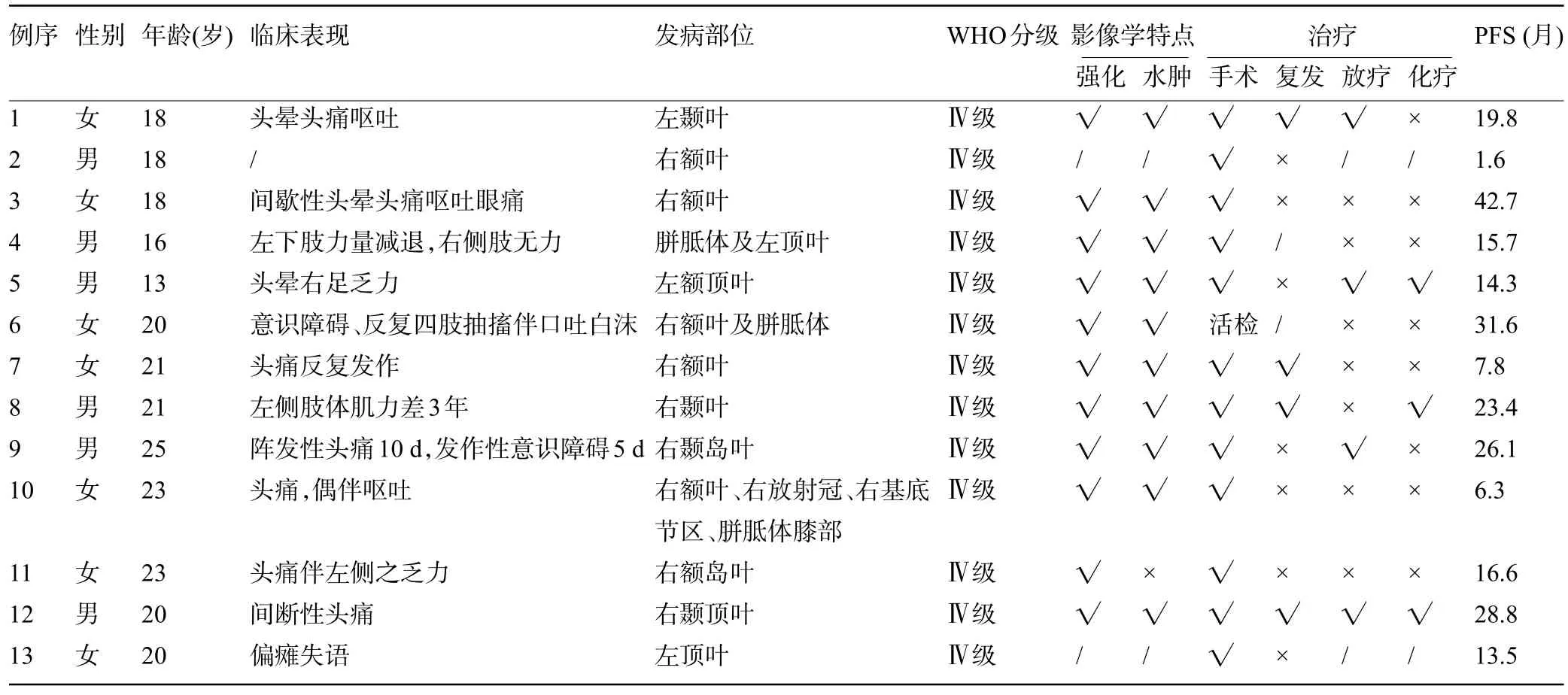
表1 13例H3 G34突变型弥漫半球胶质瘤患者的临床特征及影像学特点Table 1 Clinical and imaging features of 13 patients with H3 G34-mutant diffuse hemispheric glioma
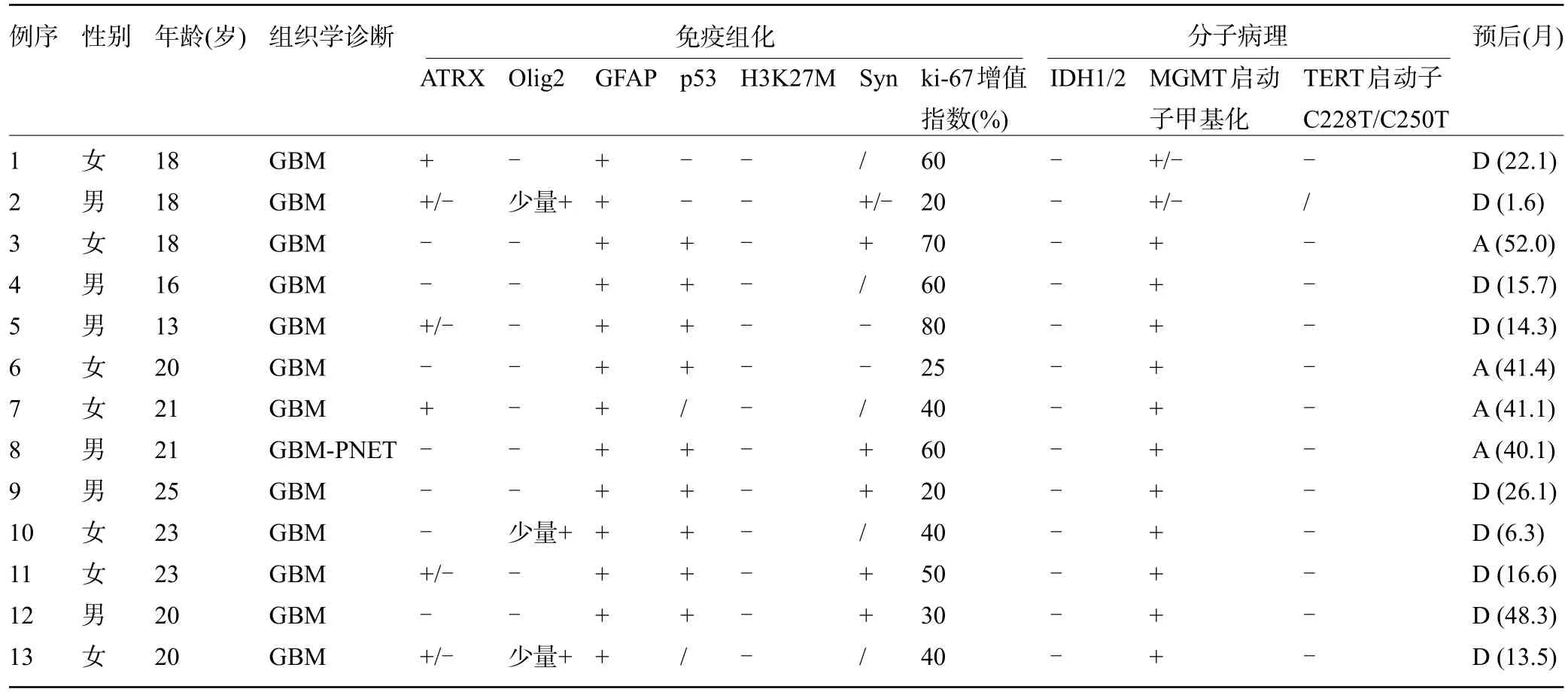
表2 13例H3 G34突变型弥漫半球胶质瘤患者的病理特征及预后Table 2 Pathological features and prognosis of 13 patients with H3 G34-mutant diffuse hemispheric glioma
2.2 组织形态学 13例患者均为胶质母细胞瘤,镜下见异型细胞呈弥漫片状生长,细胞核异型性显著,可见多量瘤巨细胞(图1Β、1E),核分裂象易见,间质小血管增生明显(图1A、1D),可见灶性栅栏状坏死及钙化(图1C、1F);其中1例部分为原始神经外胚层肿瘤,镜下见异型细胞呈巢片状分布,细胞胞浆少至中等,核分裂象易见,可见坏死,间质伴血管内皮增生。
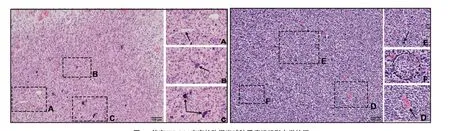
图1 伴有H3 G34突变的弥漫半球胶质瘤组织形态学特征Figure 1 Histomorphological characteristics of diffuse hemispheric glioma with H3 G34 mutation
2.3 免疫组化检测结果 免疫组化示:ATRX 在6/13 例(46.2%)中表达缺失(图2A);GFAP 全部为阳性表达(图2Β);Syn 有不同程度阳性;Ki-67 阳性指数为20%~80% (图2C);Olig2 免疫染色在10/13 例(76.9%)中完全表达阴性(图2D),在3/13 例(23.1%)中少量阳性;TP53 在9/11 例(81.8%)中染色阳性(图2E),所有病例均不表达H3K27M(图2F)。

图2 伴有H3 G34突变的弥漫半球胶质瘤免疫组织化学染色结果Figure 2 Immunohistochemical staining results of diffuse hemisphere glioma with H3 G34 mutation
2.4 基因检测结果 分子检测结果显示:全部13例H3G34 突变型DHG 患者检测到H3F3A 基因34 处密码子突变(图3)。其中,10例患者(76.9%)具有G34R突变(p.Gly34Arg,c.103G>A),其余3例患者(23.1%)具有G34V 突变(p.Gly34Val,c.104G>T)。13 例患者中IDH1/2 及TERT 启动子C228T/C250T 基因全部为阴性,MGMT启动子均发生甲基化。
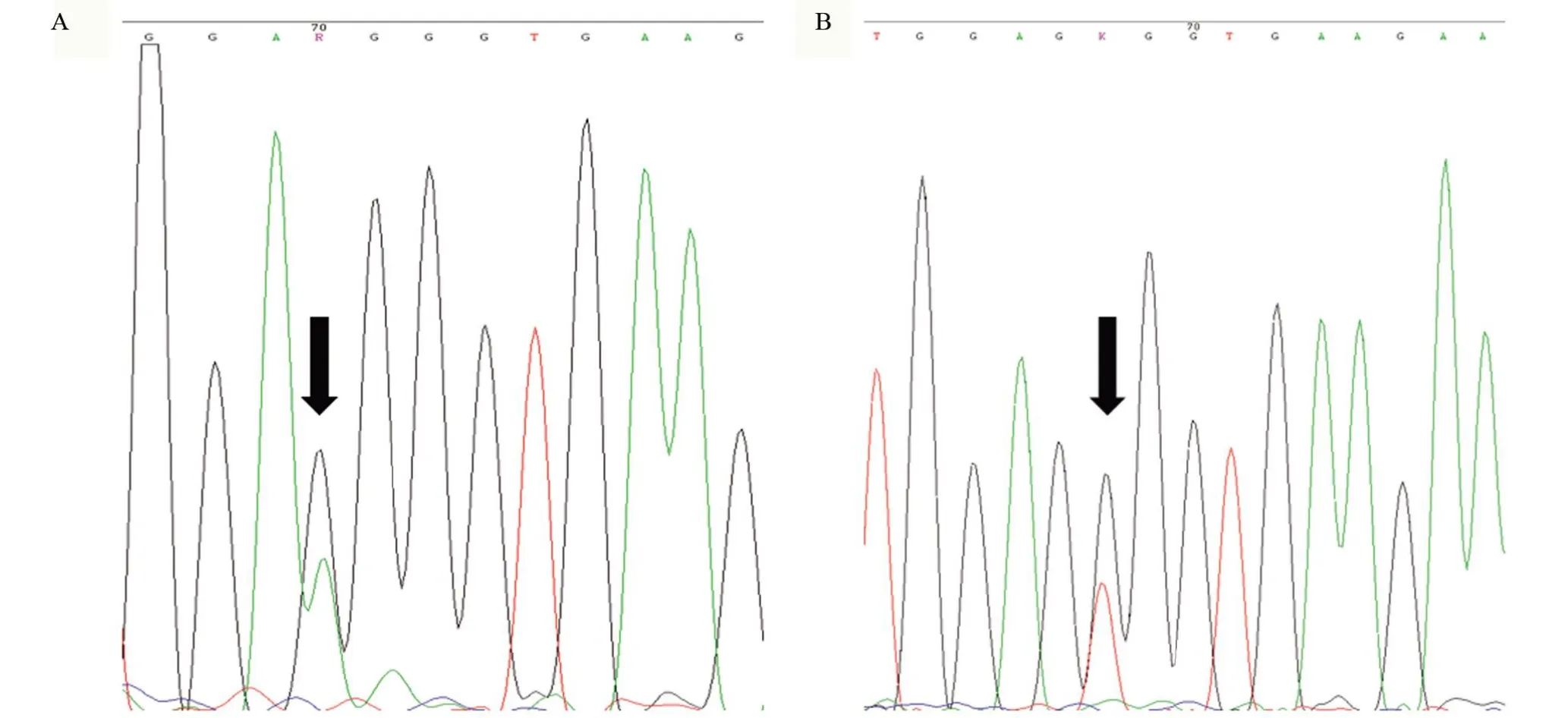
图3 Sanger测序结果Figure 3 Sanger sequencing results
2.5 影像学特征 13 例患者均以头痛头晕或肢体乏力起病。头颅磁共振成像(MRI)检查结果提示,病变位于额叶的患者5例,顶叶1例,额叶及顶叶1例,颞叶2 例,顶叶及胼胝体1 例,额叶及胼胝体1 例,额叶、顶叶及岛叶1例,颞叶及顶叶1例(图4)。
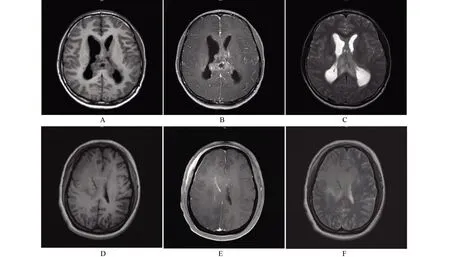
图4 伴有H3 G34突变的弥漫半球胶质瘤影像学特征Figure 4 Imaging characteristics of diffuse hemisphere glioma with H3 G34 mutation
2.6 生存情况 所有患者均于术后随访,随访截止时间2022 年11 月15 日,4 例患者存活,最长随访时间为术后52个月,术后存活最短时间1.6个月,最长存活52 个月,中位总生存时间为22.1 个月,平均26.1 个月。13 例H3G34突变型DHG患者的1、2、3年生存率分别为84.6%、46.2%、38.5%(图5)。
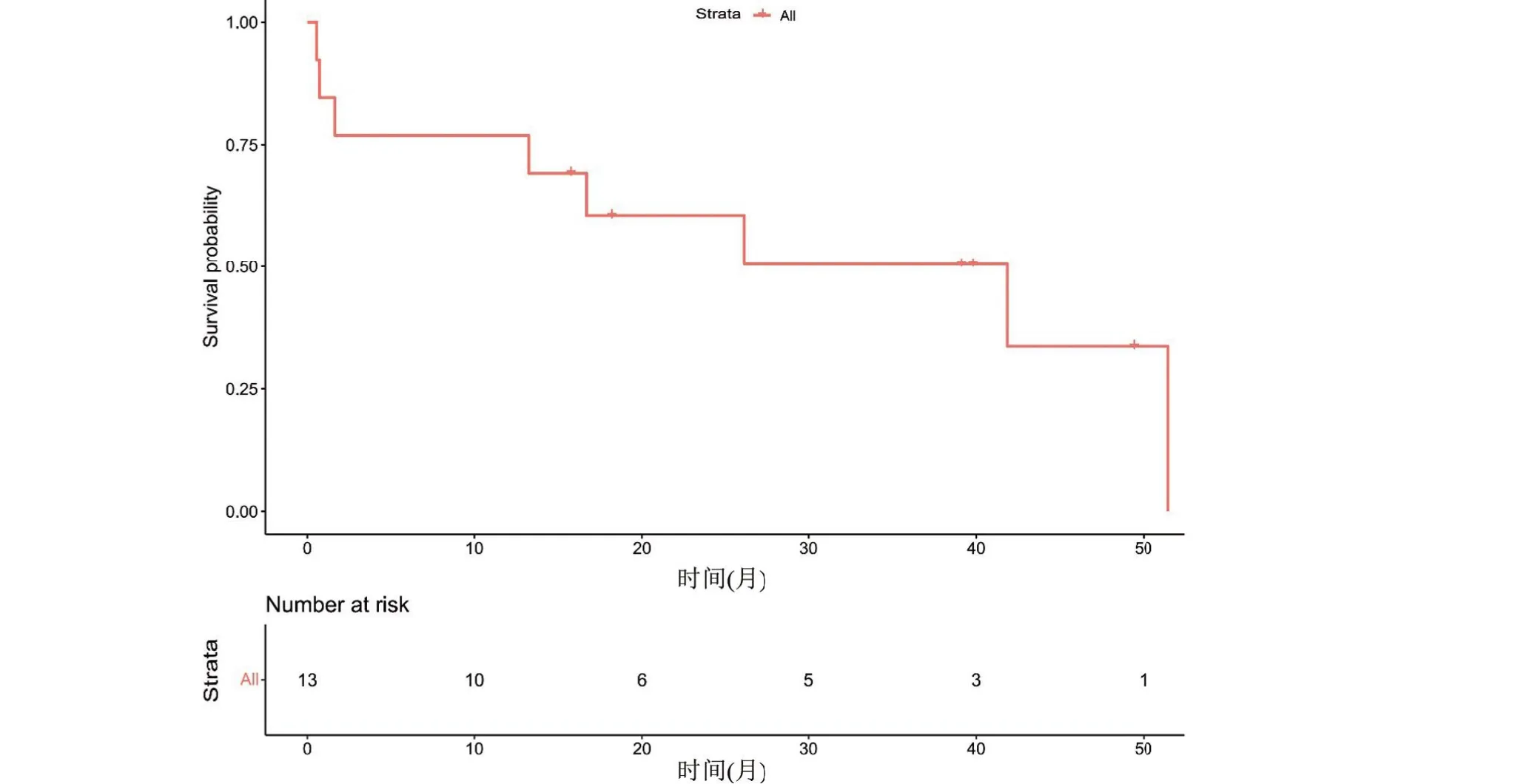
图5 13例弥漫半球胶质瘤患者的1、2、3年生存率分别为84.6%、46.2%、38.5%Figure 5 The 1,2,and 3-year survival rates of 13 patients with diffuse hemispheric glioma were 84.6%,46.2%,and 38.5%,respectively
3 讨论
DHG-G34 是一种罕见的脑肿瘤,通常发生于儿童和青少年[11,17-18]。以往研究表明,发生G34R/V 突变的胶质瘤患者平均年龄略高于发生K27M 突变的胶质瘤患者,G34R/V 突变的胶质瘤患者的年龄为9~42岁,中位年龄为18岁,K27M突变的胶质瘤患者年龄为5~23 岁,中位年龄为10.5 岁[19]。本研究中,13 例DHG-G34 患者的年龄为13~25 岁,中位年龄为20 岁,与以上研究结果一致。
Korschunov 等[13]对81例H3 G34 突变的中枢神经系统肿瘤患者进行研究,发现肿瘤患者最常受累部位为颞叶和顶叶,高达80%。Yoshimoto等[19]也报道G34突变患者发病部位主要为顶叶,可累及基底节。本研究中,所有患者的肿瘤部位都位于大脑半球,其中4例伴有2个或多个脑叶的侵犯,而且病灶多位于额叶或颞岛叶皮质下,影像学显示,T1WI呈等、低信号,T2WI呈等、稍高信号,DWI呈稍高信号,增强扫描明显强化。
本研究表明DHG-G34 患者都显示出统一的分子病理学特征,包括IDH 野生型、Olig2—/ATRX—、p53阳性、GFAP 强阳性,频发O6-甲基鸟嘌呤-DNA 甲基转移酶(MGMT)启动子甲基化,并且缺乏TERT 启动子突变。这些发现与之前报道的结果一致[9,19-24]。另外,转录因子Olig2 低表达与Olig2位点的高甲基化有关,并且在74%~100%的H3 G34突变型胶质瘤中均有报道[11,25]。MGMT是一种DNA修复酶,与脑胶质瘤的耐药性有一定的关系,可以修复O6-MG(O6-Methyguanine),是一种由烷化剂和鸟嘌呤形成的加合物,可能影响患者预后。本研究13例DHG-G34患者中频繁发生MGMT 启动子甲基化,说明DHG-G34 患者的肿瘤细胞对替莫唑胺等烷化剂类药物化疗效果敏感。p53作为抑癌基因会导致肿瘤的发生,本研究81.8%的病例有p53 突变,突变率与之前报道的88%相似[13,26]。本研究13例DHG-G34患者的基因检测结果显示,IDH及TERT启动子基因均未检测到突变,H3F3A 基因中,10 例患者为G34R突变,3例患者为G34V突变。这与以往研究报道的G34R/V 突变中主要突变位点为G34R,而G34V 突变极为罕见(比率8∶1[27])的结论一致。值得一提的是,这些突变类型似乎是有组织特异性的,比如G34W 或G34L 突变在骨巨细胞瘤中极为常见,但罕见有G34R/V突变[28]。
在组织学方面,与具有H3 K27M变异的弥漫中线胶质瘤的形态学相对均一性相反,DHG-G34表现出明显异质性,可呈现PNET样或经典的GΒM样形态[13],这两种肿瘤被认为在临床和生物学上是不同的,并且也接受了不同的治疗策略[29-30]。本研究13例DHG-G34患者中,所有患者的组织呈胶质母细胞瘤形态,其中1例患者的组织含PNET 样形态。虽然DHG-G34 可以呈现不同的组织病理学外观,但均一的分子病理学特征表明其是单一的生物起源。
文献报道,G34R/V突变患者的预后优于K27M突变患者[5,17,31],中位生存期为12~36 个月[11,13,18,32],2年生存率为27.3%[33-34]。本研究13 例DHG-G34 患者的中位生存期为22.1 个月,2 年生存率为46.2%,略高于以上研究。综合以往研究显示,DHG-G34 患者的临床、影像、组织及分子病理学特征与H3K27M突变型弥漫中线胶质瘤、IDH 突变型和IDH 野生型胶质母细胞瘤有很大不同,因此,这些发现都支持DHG-G34 被归类为新的WHO 4级肿瘤类型[35]。
尽管DHG-G34 的发病机制仍然不清楚,但H3G34突变已被证明会导致转录因子MYCN的上调,并通过SETD2 削弱H3 K36 甲基化,从而促进异常的PRC2 活性并推动肿瘤发生[36-38],使DHG-G34 具有靶向治疗的机会。此外,有研究表明,PDGFRA 信号传导在H3G34 突变阻止细胞向神经元分化中起主要作用,PDGFRA 激活突变(主要在细胞外结构域)可以促进DHG-G34向星形胶质细胞样分化并且是有效的致癌驱动因子[31]。综上所述,靶向MYCN、DNA低甲基化[10]、ALT[5,24]和PDGFRA 信号[31]可能是未来DHG-G34的新治疗策略。
总之,本文评估的DHG-G34 显示出一致的分子遗传特征,具有ATRX 阴性、p53 阳性、Olig2 阴性、MGMT甲基化及TERT野生型的高级别胶质瘤的单一生物起源和独特亚型。本研究样本量有限,需要独立的和更大的数据进行验证,及进一步的研究来确认DHG-G34的临床特征和靶向治疗。

