建立动脉性肺动脉高压发展为右心衰的列线图预测模型
吾拉尔·阿德力, 娜孜拉·努尔兰, 阿提开木·吾布力, 麦尔哈巴·雪热提,艾尼娃尔·艾克木, 迪丽努尔·买买提依明
(新疆医科大学1第一附属医院综合心脏内科, 乌鲁木齐 830054; 2公共卫生学院, 乌鲁木齐 830017;3新疆维吾尔医学专科学校, 新疆 和田 848000)
肺动脉高压(Pulmonary hypertension,PH)是一种常见的肺血管疾病,PH发病机制复杂,任何引起肺血流量增加或肺血管阻力升高的结构或功能异常,均能引发PH[1]。中国肺动脉高压治疗与诊断指南(2021版)将PH分为五大类,其中第一大类为动脉性肺动脉高压(Pulmonary arterial hypertension,PAH),包括特发性、遗传性、药物和毒物相关、结缔组织病、先天性心脏病、门脉高压等。PAH中特发性肺动脉高压(Idiopathic pulmonary arterial hypertension,IPAH)为未知原因的肺动脉高压,是PAH中预后差的一类,是指原因不明的肺血管阻力增加引起的肺动脉高压,据文献报道,成人IPAH患病率为百万分之六,是一种罕见疾病,在靶向药物出现之前,IPAH预后极差[2]。结缔组织病相关肺动脉高压中,因我国系统性红斑狼疮(Systemic lupus erythematosus,SLE)患病病例数明显高于其他类型结缔组织病,因此SLE合并PAH更为常见[2-3]。SLE-PAH的发病机制不明确,目前认为可能与自身免疫及免疫失调引起的炎症反应、内皮细胞功能障碍相关的血管活性介质失衡、肺血管病变等因素有关[4],国内一项单中心队列分析结果表明,基线心功能III-IV级为SLE-PAH患者死亡的独立危险因素[5]。PAH患者的死因大约2/3与右心功能障碍有关[6],因此及早识别发展为右心功能不全的PAH患者,及早对其进行干预治疗尤为重要。本文旨在了解IPAH以及SLE-PAH等动脉性肺动脉高压发展为右心衰(Right heart failure,RHF)的危险因素,并建立预测RHF的列线图模型,为临床医师更准确评估PAH患者病情、及早给予治疗提供理论依据。
1 资料与方法
1.1 研究对象收集2014年1月-2021年12月,因IPAH、SLE-PAH就诊于新疆医科大学第一附属医院的患者63例,其中合并RHF26例,不合并RHF37例。
1.2 纳入标准与排除标准
1.2.1 纳入标准 ①临床确诊为SLE-PAH或IPAH。②根据《中国肺高血压诊断和治疗指南2018》[7],采用超声心动图测定肺动脉压力≥30 mmHg的患者。③所有研究对象均知情研究内容,签署同意书;④无精神系统疾病;⑤无全身严重感染;⑥无恶性肿瘤疾病。
1.2.2 排除标准 ①左心疾病引起的肺动脉高压,包括冠心病、高血压、瓣膜性心脏病等。②合并有慢性阻塞性肺疾病。③合并有肺动脉栓塞。④排除其他引起右心衰竭的病因,包括致心律失常性右室心肌病、限制性心肌病、右心室心肌梗死等。⑤检验资料中缺乏N端脑钠肽前体(NT-proBNP)结果的患者。⑥完善心脏超声提示左室射血分数<50%。⑦妊娠期或哺乳期妇女。
1.2.3 相关定义及分组 在《2017 ACC/AHA/HFSA指南:心力衰竭的管理》[8]中,右心衰竭诊断标准为存在右心衰竭的症状和体征,超声心动图发现右心结构和(或)功能异常以及心腔内压力增高。通过阅读相关文献[9],借鉴相关文献的右心功能不全的诊断标准,本文中右心衰竭诊断标准为同时存在右心衰竭症状与体征,NT-proBNP≥465 ng/L[10],且完善心脏超声提示存在右心结构和(或)功能异常。右心衰竭症状包括:胸闷气短、下肢水肿、运动耐力下降、心悸、呼吸困难、胸痛、晕厥、干咳等。心脏超声提示右心结构及功能异常包括:右心室扩张,右心室左心室直径比>0.9,右心室运动功能减退和右房室瓣反流。
1.3 方法
1.3.1 一般资料收集 记录所有研究对象的一般资料,如性别、年龄、吸烟史、女性是否绝经等,记录入院时收缩压、舒张压。
1.3.2 相关实验室检查结果 收集研究对象入院后首次血气分析、NT-proBNP、补体C3、血清铁蛋白、C反应蛋白、淋巴细胞计数、单核细胞计数、血红蛋白、红细胞分布宽度、甘油三酯、总胆固醇、高密度脂蛋白(HDL)、低密度脂蛋白、总胆红素、间接胆红素、丙氨酸氨基转移酶、血清胱抑素C、肌酸激酶、血清凝血酶原时间、D-二聚体、血沉等。
1.3.3 心脏超声检查 由一名经验丰富的超声科医生,在研究对象入院时采用常规超声心动图对心脏各腔室大小进行测量,记录右心房内径、右心室内径、左心室舒张末期内径(LVDD)、左室收缩末期内径、右心室流出道内径、二尖瓣舒张早期血流峰值速度与二尖瓣环舒张早期运动峰值速度比值(MV-E/e′)、心搏出量等。
1.3.4 肺动脉收缩压测定 研究证明超声心动图测量的肺动脉收缩压(PASP)与右心导管测量值之间有显著相关性[11],所以超声心动图目前是PAH患者无创检查的首选检测途径,本研究使用超声心动图测量PASP。完善心脏超声时,在心尖四腔切面,测量三尖瓣的最大反流速度(V)。PASP与右心室收缩压相等。根据简化的伯努利方程,估算右心房与右心室压差(ΔP):ΔP=4V2,右心室收缩压=4V2+右心房压。记录患者PASP。
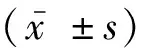
2 结果
2.1 两组一般临床资料比较PAH合并RHF组患者与不合并RHF组相比,年龄差异具有统计学意义(P<0.05),PAH合并RHF组年龄更小。见表1。

表1 两组一般临床资料比较
2.2 两组实验室指标比较PAH合并RHF组患者与不合并RHF组相比较,收缩压、舒张压、血清铁蛋白、甘油三酯、总胆固醇、HDL、低密度脂蛋白、血沉、淋巴细胞计数、单核细胞计数、总胆红素、间接胆红素、丙氨酸氨基转移酶、血清凝血酶原时间差异具有统计学意义(P<0.05);PAH合并RHF组,相较于不合并RHF组,收缩压、舒张压、血清铁蛋白、甘油三酯、总胆固醇、HDL、低密度脂蛋白、血沉降低,淋巴细胞计数、单核细胞计数、总胆红素、间接胆红素、丙氨酸氨基转移酶、血清凝血酶原时间升高,见表2。

表2 两组检验指标比较
2.3 两组心脏超声指标比较PAH合并RHF组患者与不合并RHF组相比较,右房内径、右室内径、右室流出道内径、肺动脉压力、LVDD、左室收缩末期内径、MV-E/e′、心搏出量差异有统计学意义(P<0.05);合并RHF组患者右房内径、右室内径、右室流出道内径、肺动脉压力增大,LVDD、左室收缩末期内径、MV-E/e′、心搏出量减小(均P<0.05),见表3。

表3 两组心脏超声参数比较
2.4 二元Logistic回归分析PAH并发RHF的独立危险因素以年龄、收缩压、舒张压、血清铁蛋白、甘油三酯、总胆固醇、HDL、低密度脂蛋白、血沉、淋巴细胞计数、单核细胞计数、总胆红素、间接胆红素、丙氨酸氨基转移酶、血清凝血酶原时间、右房内径、右室内径、右室流出道内径、肺动脉压力、左室舒张末期内径、左室收缩末期内径、MV-E/e′、心搏出量为自变量,以是否发生RHF为因变量,单因素二元Logistic回归分析显示,年龄(OR=0.960,P=0.032)、舒张压(OR=0.911,P=0.002)、总胆固醇(OR=0.407,P=0.007)、HDL(OR=0.135,P=0.040)、LVDD(OR=0.778,P<0.001)、PASP(OR=1.054,P<0.001)是PAH患者发生RHF的独立危险因素。其中年龄、舒张压、总胆固醇、HDL、LVDD为保护因素,PASP为危险因素。
2.5Logistic回归建立预测模型二元Logistic回归分析要求最小样本量为自变量的10倍,本研究样本量为63例,最多可选择6个独立危险因素构建预测模型。将上述6个独立危险因素作为自变量,以患者是否发生右心功能衰竭为因变量,通过逐步回归,即多因素二元Logistic回归,将P>0.05的独立危险因素逐步剔除,得到PAH患者发生RHF的预测模型,见表4。
2.6 列线图模型的建立与验证基于以上3个独立危险因素,通过R语言(R 4.2.1)软件,应用rms程序包建立构建列线图(图1),列线图将Logistic回归模型可视化,采用C-index评估列线图的区分度,C-index=0.897(95%CI: 0.815~0.979)。采用SPSS构建ROC曲线,计算得ROC曲线下面积(AUC)为0.898,见图2。采用Bootstrap重复抽样1 000次的方法对列线图模型进行内部验证后,得到高质量的预测模型校准曲线,见图3。举例一名PAH患者实例,此患者HDL=1.3 mmol/L,得分50分;LVDD=33 mm,得分50分;PASP=100 mmHg,得分28分;总分为128分,所对应发生RHF风险为0.7,此PAH患者发生RHF的风险为70%。

表4 二元Logistic回归分析PAH发生RHF的影响因素

>注:变量对应的线段标注刻度,代表了每个变量的取值范围;每个变量数值所对应的分值为单项分数,将单项分数相加得出总分,总分对应发生RHF的风险;HDL为高密度脂蛋白,LVDD为左室舒张末期内径,PASP为肺动脉收缩压。


图2 列线图预测模型的ROC曲线(n=63)图3 列线图预测模型校准曲线
3 讨论
国内有研究表明,未经治疗的IPAH儿童平均存活时间仅为10个月,1、3、5年生存率分别为89%、84%和75%[12]。靶向药物改善了患者的预后,但仍未实现治愈该疾病的目标。不明原因的肺血管重构是引起IPAH的主要原因[13],但IPAH患者病情评估、生存质量、生存时间主要取决于右心功能状态。SLE-PAH起病隐匿,病死率高。国内一项单中心队列分析结果表明,SLE-PAH患者1、3、5年生存率分别为95%、86%和72%,基线心功能III-IV级为SLE-PAH患者死亡的独立危险因素[5]。针对IPAH、SLE-PAH这类PAH患者,寻找能预测患者发生RHF的工具尤为重要。更精确评估PAH患者发生RHF的风险,做到及时干预、及时管理,才能减轻患者病情,提高患者生存质量,延长患者生存时间。
目前右心导管检查是评估右心功能的金标准,但此检查为有创检查,可能会发生心律不齐、血栓形成等并发症,极大限制了其临床应用[11]。心脏超声检查主观性强,存在一定局限性。心脏超声检查操作简便、无创、廉价,成为评估PAH患者病情首选检查手段[14],但与PAH患者发生心衰有关的血清学标志物可以从代谢的角度反映机体心功能受损程度。既往研究结果表明,NT-proBNP是通过右心功能受损、组织缺氧和器官损伤这两方面评估PAH患者的预后[15];研究表明,C反应蛋白水平与心功能不全患者心功能分级呈正相关,心功能越差,C反应蛋白水平越高[16];尿酸水平升高,是PAH患者肺动脉高压严重程度及死亡率的独立预测因子[17];红细胞分布宽度、胱抑素C等指标也与PAH的严重程度相关[18]。
本研究结果显示,与PAH不合并RHF组相比,PAH合并RHF组患者年龄小,收缩压、舒张压降低,血清铁蛋白降低,淋巴细胞计数、单核细胞计数升高,甘油三酯、总胆固醇、高密度脂蛋白、低密度脂蛋白降低,总胆红素、间接胆红素、丙氨酸氨基转移酶升高,血清凝血酶原时间升高,血沉降低,右房内径、右室内径、右室流出道内径、肺动脉压力增大,左室舒张末期内径、左室收缩末期内径、MV-E/e′、心搏出量减小。通过二元Logistic回归分析PAH发生RHF的相关因素,发现HDL、LVDD、PASP是PAH发生RHF的独立危险因素。进一步将回归分析结果可视化,建立了动脉性肺动脉高压患者发生右心衰的列线图预测模型,通过各变量在模型中对应的分值不同,可以看出三个影响因素对结果的贡献程度不同,间接反映出三个影响因素的预测价值,内部验证提示C-index= 0.897(95%CI:0.815~0.979),提示本列线图模型具有良好的预测能力,预测效能较高,因此认为HDL、LVDD、PASP能够预测动脉性肺动脉高压患者右心衰的发生。
HDL具有抗氧化、抗炎、抗血栓、抗动脉粥样硬化等血管保护作用。有研究者通过建立低氧性肺动脉高压的小鼠模型,观察发现,低氧可以引起血清HDL水平下降[19];有学者在研究PAH时发现PAH患者存在HDL水平降低,且HDL水平正常的患者死亡率降低,HDL水平降低组死亡率升高[20]。
本研究发现PAH合并RHF组LVDD较不合并RHF组降低。目前研究对原发性左心功能不全导致右心衰或全心衰的机制已有所认识[21],但继发于右心衰的左心功能不全机制了解甚少。有研究表明,右心室在容量负荷和压力负荷的作用下,其心室壁肥厚、扩张,引起室间隔左向移位,导致左心室容积缩小,舒张期充盈受限,最终射血分数下降,左心室舒张末期内径降低,最终发生左心功能受损[14,22]。然而目前PAH发展为RHF,引起左心功能不全的细胞、分子学机制尚不清楚。
本研究显示HDL、LVDD、PASP是PAH发生RHF的独立预测因素,通过建立列线图可直观的显示PAH患者发生RHF的概率。患者入院后完善血脂分析、心脏超声,可以早期发现RHF,改善患者预后,为临床医师评估PAH患者病情提供理论依据。
本研究也存在一定的局限性:①受限于单中心样本量较少,本研究样本量仅63例,有模型过拟合的风险,故此模型需要通过多中心数据的外部验证,进一步调整。②本研究纳入的两种PAH:IPAH及SEL-PAH,研究对象不够全面。③右心导管检查是评估肺动脉压力的金标准,因其是有创检查,本研究选用了心脏超声来评估肺动脉收缩压,但心脏超声受操作医师的主观影响较大,存在一定局限性。

