骨碎补总黄酮对亚硝酸钠模型小鼠学习记忆能力的改善作用*
汪羽墨,李大龙,崔 悦,张晏航,徐红丹,,杨 波,孙慧峰,张 宁
(1.黑龙江中医药大学药学院,黑龙江 哈尔滨 150040;2.东北农业大学园艺园林学院;3.佳木斯大学药学院;4.东北农业大学国际文化教育学院;5.黑龙江中医药大学佳木斯学院)
阿尔茨海默病(Alzheimer’s disease,AD)是一种神经系统退行性疾病[1]。尽管延缓了认知障碍和痴呆的进展,但对这种疾病的成功治疗和预防仍然不足。诱导认知障碍的关键因素是β-淀粉样蛋白(amyloid β-protein,Aβ)沉积,淀粉样蛋白前体蛋白(amyloid precursor protein, APP)被淀粉样前体蛋白β-分泌酶(amyloid precursor protein β-secretory enzyme, BACE1)水解生成Aβ[2]。雌激素水平的降低会导致认知功能下降,患AD会急剧增加,雌激素和雌激素受体与AD发病机制关系密切[3],且能够改善神经系统所诱导的认知障碍,植物雌激素在AD中主要通过雌激素受体(ER)改善学习记忆能力[4]。中医认为,治疗AD的有效方法是补肾益精填髓,补肾药方骨碎补总黄酮富含植物雌激素成分[5],无明显不良反应。研究表明,雌激素作为重要的神经营养因子,在脑内与雌激素受体β(estrogen receptor β, ERβ)结合成复合物,发挥雌激素样作用,使机体代谢发生变化[6]。亚硝酸钠所致记忆障碍模型,作用机制明确且特异性强,可较好模拟AD的行为及病理特征,亚硝酸钠进入机体后,致使脑组织缺血缺氧,记忆能力显著降低。刘新霞等[7]使用亚硝酸钠引起小鼠记忆障碍。因此,可用亚硝酸钠制备记忆障碍模型。实验室前期工作已证明骨碎补总黄酮的有效成分对APP/PS1双转基因AD小鼠神经细胞具有保护作用。鉴于此,本次研究选用亚硝酸钠诱导AD模型小鼠,并观察骨碎补总黄酮对淀粉样蛋白生成途径相关蛋白表达的影响及机制。
1 材料与方法
1.1实验动物 昆明雄性小鼠,3月龄,体重(25.0±4.0)g(购于北京医科利昊技术有限公司SCXK2000-0003),实验流程符合实验管理相关规定。
1.2试剂与仪器 骨碎补总黄酮(实验室自提);亚硝酸钠(01-2512山西磊鑫化工股份有限公司);抗脑衰胶囊(KN16-212502,吉林天药本草堂有限公司);P-Tau396(bs-3446R)、CDK5(bs-10258R)、APP(bs-12503R)、BACE1(bs-11304R)购于北京博奥森;电泳仪(MiniPROTEANTetra Cell,BIO-RAD);CUT5045石蜡切片机(德国Leica公司);β-actin(BC1026,Abclonal公司)
1.3实验分组及给药 将75只小鼠随机分为5组:空白组(Control)、亚硝酸钠模型组(Sn)、抗脑衰胶囊组(Kns)、骨碎补总黄酮组(Drf)、骨碎补总黄酮+ICI182780组(Drf+ICI182780)。第1~21 d Kns组定量灌胃抗脑衰胶囊(585 mg/kg·d),Drf组定量灌胃骨碎补总黄酮97.5 mg/(kg·d),Drf+ICI182780组先定量灌胃ICI182780(0.072 mg/kg·d),再给予骨碎补总黄酮97.5 mg/(kg·d),其余组每天注射等量双蒸水。造模时间为第22~28 d,除空白组外,其余小鼠组进行腹腔注射亚硝酸钠100 mg/(kg·d)。造模结束后不再给药。
1.4行为学检测 造模结束后开始实验,参照文献[8-9]进行新物体识别实验、Morris水迷宫实验。
1.5取材 将小鼠麻醉后处死,置于冰面上取脑,分离两侧海马组织,储存于-80 ℃冰箱备用。
1.6HE染色 参照文献[10]进行HE染色,观察海马区神经细胞损伤形态,通过组织脱水、切片(厚度设置为5 μm)、染色,对小鼠海马区神经细胞的形态学状况进行评价,镜下采集图像。
1.7Western blot 参照1.5项下方法提取海马区组织,在低温条件下匀浆,取各组蛋白上清液,进行SDS-PAGE,注入电泳液检查电泳槽封密性,煮沸时间为5 min,PVDF膜转印,封闭2 h,其中一抗APP、BACE1、过度磷酸化tau蛋白(over-phosphorylated tau protein, P-Tau396)和细胞周期素依赖蛋白激酶5(cyclin-dependent protein kinase 5,CDK5)稀释比例为1∶500,二抗孵育浓度为1∶2 000,上述过程中均用TBS洗3次,加ECL化学发光液至覆盖均匀,扫描观察灰度值。
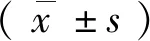
2 结果
2.1各组小鼠新物体识别能力比较 与Control组相比,Sn组小鼠识别指数减小(P<0.01);与Sn组相比,Kns组和Drf组小鼠识别指数增加(P<0.01);与Drf组相比,Drf+ICI182780组小鼠识别指数减少(P<0.01)。见图1。

图1 Drf对Sn小鼠新物体识别实验的影响
2.2各组小鼠Morris水迷宫水平比较 前2 d为训练期,各组小鼠均呈现下降趋势;观察第3、4 d时,Sn组小鼠潜伏期增加(P<0.01),穿越平台次数和靶象限停留时间减少(P<0.01);观察第4 d时,与Sn组相比,Kns和Drf组小鼠潜伏期减少(P<0.01),穿越平台次数和靶象限停留时间增加(P<0.01);与Drf组相比,Drf+ICI182780组小鼠潜伏期减少(P<0.01),穿越平台次数和靶象限停留时间降低(P<0.01)。见图2、图3。
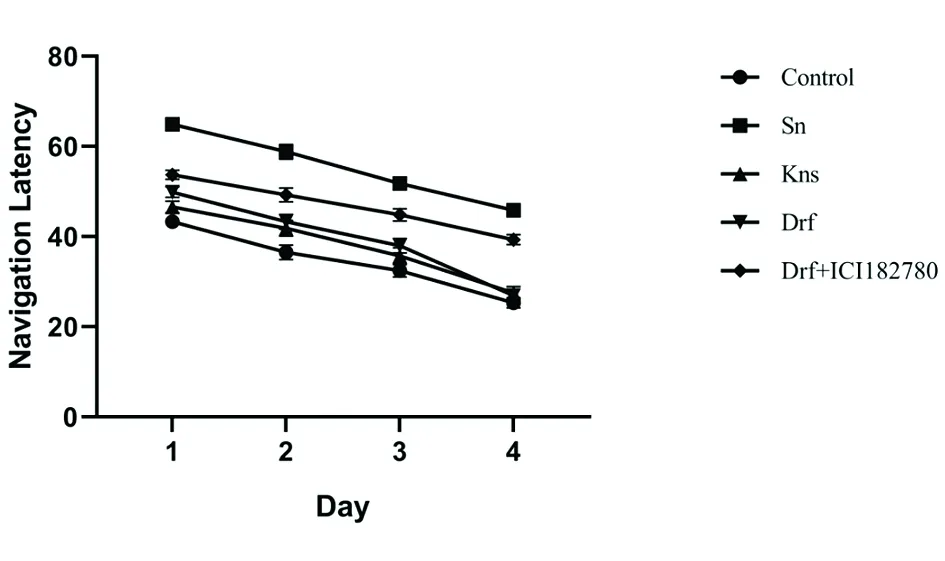
图2 Drf对Sn模型小鼠定位航行潜伏期
2.3各组小鼠病理结果比较 Control组海马区椎体细胞结构完整,且细胞核及核膜明显,未出现核固缩现象;Sn组小鼠海马区细胞排列紊乱,可见明显海马区锥体细胞坏死、核固缩、完整神经细胞数较空白组明显减少;Drf及Kns组,完整神经细胞数较多,细胞形态接近空白组,没有明显核固缩现象;Drf+ICI182780组部分细胞缩小、核固缩、胞体变形。见图4。

图3 Drf对Sn模型小鼠空间探索的影响
图4 各组小鼠海马区神经细胞病理形态(HE染色,×200)
2.4骨碎补总黄酮对亚硝酸钠模型小鼠海马区相关蛋白表达的影响 与Control组相比,Sn组APP、BACE1、CDK5、P-Tau396蛋白表达增加(P<0.01);与Sn组相比,Kns和Drf组APP、BACE1、CDK5、P-Tau396表达减少(P<0.01);与Drf组相比,Drf+ICI182780组小鼠海马中APP、BACE1、CDK5、P-Tau396表达增加(P<0.01)。见图5。

图5 Drf对Sn小鼠海马APP、BACE1、CDK5、
3 讨论
本实验中所采用的亚硝酸钠诱导AD小鼠表现出记忆缺陷,侯悦等[11]使用120 mg/kg亚硝酸钠致AD模型。本研究给予骨碎补总黄酮干预,通过HE染色观察海马区神经细胞损伤有所减轻,进一步证实该模型能够模拟老年性记忆障碍脑内异常病理改变。Morris水迷宫实验表明,亚硝酸钠模型组小鼠潜伏期增加,穿越平台次数减少,表明模型小鼠出现严重的记忆衰退;同时经骨碎补总黄酮治疗后模型小鼠潜伏期减少,穿越平台次数增加,证实骨碎补总黄酮可以增强模型小鼠的学习记忆能力。
骨碎补的化学成分以黄酮类为主,主要作用体现在抑制Aβ沉积[12]。骨碎补总黄酮可降低APP、BACE1、P-Tau396、CDK5的表达,调节APP转运减少Aβ的产生。给予ICI182780阻断剂反向进行验证,发现骨碎补总黄酮保护作用显著降低。Aβ促使多种蛋白激酶诱导Tau蛋白磷酸化,如通过CDK5可以磷酸化P-Tau396[13]。张兆旭等[14]使用CDK5抑制剂能够减轻Aβ诱导Tau蛋白磷酸化。淀粉样蛋白生成途径(APP-BACE1-Aβ)是AD发病重要病因之一,BACE1在胞外区被CDK5磷酸化调节BACE1的胞内转运并增加其活性[15]。胞外结构域上的CDK5对BACE1进行磷酸化,调节BACE1在细胞内的转运,提高其活性,被这种磷酸化过程阻断后,BACE1的活性降低[16]。
研究表明,由于年龄的增长致使雌激素水平下降,雌激素通过调节APP代谢产生sAPP,诱导sAPP堆积,拮抗β-淀粉样蛋白毒性[17-18]。CDK5介导sAPPα的下游信号转导,其活性和表达受sAPPα调控,sAPPα发挥神经保护作用[19]。Jaffe等[20]使用雌激素水平较高的癌细胞,给用药9 d后呈现出sAPP水平升高。CDK5异常调节干扰淀粉样β蛋白前体(APP)的蛋白水解过程,并通过影响淀粉样β蛋白前体(Aβ)的三种酶调节APP的水解[21]。本实验结果表明,骨碎补总黄酮通过与ER结合降低APP、BACE1、CDK5、P-Tau396蛋白表达,还可以增加ERβ表达,减少P-P38/P38比值,发挥神经保护作用,进而抑制淀粉样蛋白生成途径,促进认知功能改善。

