磁共振T1WI及波谱成像在新生儿急性胆红素脑病的临床应用价值⋆
庄 毅 蒋昊翔 孙 磊 陈宏伟
1.南京医科大学附属无锡儿童医院影像科(江苏 无锡 214000)
2.南京医科大学附属无锡人民医院影像科(江苏 无锡 214000)
新生儿高胆红素血症(Neonatal Hyperbilirubinemia,NHB)是指新生儿时期血清胆红素(Total Serum Bilirubin,TSB)浓度增高,超出正常范围[1]。重症高胆红素血症可导致新生儿胆红素脑病(Neonatal Bilirubin Encephalopathy,NBE),未及时治疗可出现视听障碍或智力障碍等一系列后遗症[2],甚至死亡[3]。氢质子磁共振波谱(proton magnetic resonance spectroscopy,1H-MRS)能够无创性对活体组织进行相关代谢物的检测,是目前唯一的无创性影像检查。常用的代谢物有NAA、Cho、Cr、mI、Glx等[5],对NBE脑部损伤的早期诊断、预后判断,1H-MRS都有很大的发展潜力[6-7]。同时对于影像学特征性表现的基底神经节苍白球区T1WI高信号[8],目前临床工作中主要依靠目视判断,主观性较强,无法进行定量分析。本研究旨在探讨急性胆红素脑病患儿两侧苍白球与壳核T1WI信号比值以及1H-MRS代谢物的变化特征,以期对于NBE病程进展进行无创性判别,有助于临床诊疗方案的制定。
1 资料与方法
1.1 一般资料回顾性收集2020年4月至2021年12月在我院临床诊断为新生儿急性高胆红素脑病(neonatal hyperbilirubin encephalopathy,NBE)的新生儿40例,男22例,女18例,年龄2-29天,平均(11.63±5.36)天。根据新生儿神经行为评分评定(neonatal behavioral neurological assessment,NBNA),将≥35分的患儿作为轻症组共21例,<35分作为重症组共19例,同期选取18例正常或生理性黄疸的新生儿为对照组,男10例,女8例,年龄4-27天。
1.2 设备与方法采用Siemens MAGNETOM Aera 1.5T超导型磁共振,患儿仰卧位,8通道头部相控阵线圈,成像范围覆盖全脑。行常规轴位T1加权成像(T1WI)、T2加权成像(T2WI)、T2液体衰减反转恢复成像(T2-FLAIR)及1H-MRS成像。其中T1WI扫描参数:TR 200ms,TE 5ms,层厚4mm;1H-MRS扫描参数:采用化学位移自旋回波序列,TR 1500ms,TE 135ms,并进行水脂抑制。
1.3 图像处理在西门子syngoMMWP后处理工作站平台选取双侧苍白球及壳核最大显示层面测定苍白球区的肌酸(Cr)、天门冬氨酸(NAA)、胆碱(Cho)、谷氨酰胺(Glx)、肌醇(mI)等代谢产物峰值图,并以Cr作为基准参照物,与各代谢产物作相对定量计算比值(图1)。在同层面T1WI序列上,以波谱VOI区域为基准手动勾画ROI,获得苍白球(globus pallidus)与壳核(putamen)T1WI信号强度值并计算其比值G/P(图2)。所有数据均测量3次,最终结果取3次结果的平均值。最终统计结果取两侧数值的平均值。
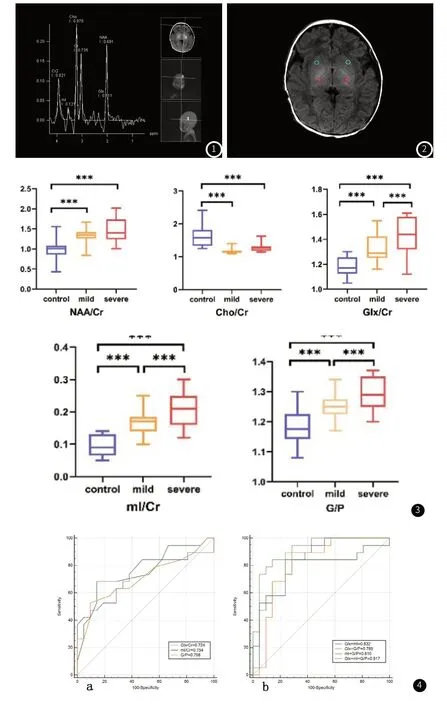
图1 患有NBE的新生儿,MRS测量的感兴趣区域由白色矩形标记。图2 苍白球G(红色圆圈)和壳核P(蓝色圆圈)T1WI信号强度测量示意图。图3 轻症、重症及对照三组间NAA/Cr、Cho/Cr、Glx/Cr、mI/Cr及G/P差异存在统计学意义;Glx/Cr、mI/Cr及G/P在轻症及重症组内存在统计学差异。图4 在轻症组与重症组之间,Glx/Cr、mI/Cr及G/P的诊断效能AUC值分别为0.724,0.754,0.708;两两联合时,诊断效能进一步提高;三者联合诊断时,AUC值达到0.917。
1.4 统计学方法采用SPSS 26.0软件进行数据分析。符合正态分布的计量资料以均数±标准差()表示,3组间比较采用单因素方差分析(one-way ANOVA),组内进一步两两比较采用Bonferroni校正检验。采用受试者操作特征曲线(Receiver Operating Curve,ROC)评价各指标的诊断效能。P<0.05表示差异具有统计学意义。
2 结果
2.1 各组间的MRS代谢产物及G/P值比较轻症、重症及对照三组间NAA/Cr、Cho/Cr、Glx/Cr、mI/Cr及G/P值差异(P<0.05)存在统计学意义(表1)。其中轻症组及重症组的Glx/Cr、mI/Cr及G/P均高于对照组,组内差异(P<0.05)存在统计学意义(图3)。

表1 轻症、重症及对照三组间MRS代谢产物比值及T1WI苍白球区信号比较
2.2 MRS代谢产物及T1WI信号比值的诊断效能在轻症组与重症组之间,Glx/Cr、mI/Cr及G/P的诊断效能AUC值分别为0.724,0.754,0.708;两两联合时,诊断效能分别为0.832(Glx+mI),0.789(Glx+G/P),0.810(mI+G/P);当三者联合诊断时,AUC值达到0.917(Glx+mI+G/P)。
3 讨论
当TSB浓度超过白蛋白的结合能力,或血脑屏障未成熟及受损时,胆红素可进入大脑,尤其是早产儿和低出生体重儿,胆红素神经毒性损伤大脑的特定区域,特别是苍白球、丘脑核团、下丘脑核、黑质等脑区[9-10]。由于新生儿高胆红素脑病的致残率较高,严重威胁新生儿的生命安全,所以早发现早诊断早治疗就尤为关键,对于提高患儿的预后具有非常重要的意义。目前临床上新生儿相关脑病的诊断主要依靠临床症状及实验室检查等,诊断依据缺乏特异性,给诊断工作带来的一定的困难。
目前唯一能做到非侵入性观察活体组织代谢及生化变化的技术是1H-MRS技术,可以在分子水平检测脑组织能量代谢异常、细胞内酸中毒和神经元坏死等情况[7,11]。同时对患有胆红素脑病的婴儿的尸检也显示,基底神经节有中度到显著的神经元丢失、脱髓鞘和胶质细胞增生[12-13]。本研究在显示双侧苍白球、壳核区域最清晰的层面进行图像处理,这些区域对胆红素神经毒性的影响最为敏感[8]。磁共振T1WI信号异常的病理基础可能是星形胶质细胞的细胞反应、神经细胞内胆红素的积累以及胆红素神经毒性引起的神经细胞膜损伤[14]。本研究统计分析显示,轻症组及重症组的NAA/Cr、Glx/Cr、mI/Cr值均高于对照组,考虑到Glx对于神经细胞具有高度的兴奋作用,这种改变可能是神经细胞组织缺血缺氧状态下的机体代偿所致[15]。而Cho/Cr则呈下降区域,考虑到新生儿特有的脑部发育情况,在持续高胆红血症的情况下,局部神经元功能障碍,代谢活动减弱,从而使得磁共振波谱Cho/Cr降低[16]。我们的MRS结果与此前研究的疾病病理一致,进一步证实了1H-MRS技术在新生儿胆红素脑病中的重要作用。
虽然国内外学者的研究一直认为基底节区T1WI高信号是持续性胆红素脑病的特征性表现[17],但是对于T1WI高信号的判断都是基于影像科医师的主观判断,所以需要量化标准来进行诊断[18]。本研究采用G/P进行半定量测定,同时也消除了新生儿正常发育过程中髓鞘化带来的影响[19],尽可能降低疾病以外的因素带来的影响[20-21]。同时在诊断效能方面,G/P信号比值在鉴别轻重症的AUC值达到0.704,而将G/P比值与Glx/Cr及mI/Cr进行三者联合诊断时,AUC值达到0.917,说明T1WI联合波谱成像对于神经症状轻微及不典型体征的胆红素脑病患儿具有较高的诊断价值。
本研究尚存在一定的局限性:①单中心研究;②样本量相对较少③手动勾画ROI,相较使用标准解剖模板进行分割测量误差稍大。未来在扩大样本量的基础上,将进一步优化扫描参数,采用高分辨率成像序列进一步探究特定脑区的改变。
综上所述,NBE脑部损伤是一种可逆的疾病,早期诊断及治疗对于患儿的预后具有重要的作用。新生儿早期症状缺乏特异性,T1WI的G/P值测定联合MRS代谢产物比值,这种无创性检查方法对于了解NBE病程进展程度具有较高的诊断效能。

