BRD9调控NLRP3炎性小体激活在急性肾损伤的作用和机制研究
陈秋菊 徐振健 周鑫 罗广轩 徐安平
急性肾损伤(acute kidney injury,AKI)是住院患者常见的急重症之一,主要特点是肾功能的急剧下降[1],其常见病因是肾脏缺血或肾毒性物质损害肾脏等。医院内获得性AKI 病死率可高达50%。目前,透析是AKI 目前唯一有效的干预措施。因此,深入探索AKI 的发病机制,寻找新的有效治疗方法,对改善患者临床预后至关重要。
各种测序技术及数据挖掘工具的出现,为全面理解AKI 的发病机制提供了机会。其中,加权基因共表达网络分析(weighted gene co-expression network analysis,WGCNA)和随机森林算法(random forest algorithm,RFA)可以实现基因与疾病性状的良好结合,实现关键基因的识别。同时,单细胞测序技术的出现,实现了基于细胞层面的功能注释和分子机制研究。尽管这些技术在肿瘤、阿尔茨海默病、糖尿病肾病等已经得到了很好的实践[2],但在AKI 中的应用较为缺乏。
本研究通过对Gene Expression Omnibus(GEO)下载的AKI 测序数据集GSE139061 和GSE139506 进行二次分析,发现BRD9 可能是AKI发病过程中的关键基因,并且高表达于巨噬细胞。同时在AKI 中,巨噬细胞生物学功能富集于炎症信号及炎性小体激活相关通路。基于LPS 诱导的巨噬细胞极化模型发现,抑制BRD9,减弱了NF-kB 蛋白的表达,同时抑制了NLRP3 炎性小体的激活和炎症因子的释放,提示BRD9 可以作为AKI 治疗的潜在靶点。
1 材料与方法
1.1 数据获取及差异基因筛选从GEO 数据库筛选并下载人的AKI 数据集:GSE139061;以及小鼠肾脏组织单细胞测序数据集:GSE139506。使用edgeR 包分析GSE139061 数据集中正常与病变组织中的差异基因,筛选标准是adjustedP<0.05,|log FC|>1;使用“ggplot2”包绘制火山图;“clusterProfiler”包完成GO 和KEGG 富集分析。使用“Seurat”包对单细胞数据集GSE139506 进行分析。
1.2 基因共表达网络分析通过“WGCNA”包完成数据集GSE139061 基因共表达网络构建,将表达模式近似的基因归属于同一个模块。同时计算每个模块与疾病状态(是否发生AKI)的关联程度,将关联性最强的模块用于后续hub 基因的筛选[2]。通过Draw Venn Diagram 软件,将与疾病性状关联性最强的hub 基因与DEGs 取交集,用于后续分析。
1.3 随机森林筛选关键基因通过“randomForest”包对WGCNA 分析hub 基因和DEGs 的交集数据,进行基因重要性评估。
1.4 细胞培养巨噬细胞RAW264.7 购于中国科学院细胞库,使用普赛诺公司的RAW264.7 专用培养基,放置于37℃、5% CO2的细胞培养箱进行培养。使用脂多糖LPS 1000 ng/μL 刺激细胞24 h 诱导Raw264.7 细 胞M1 分 化;LPS 刺 激 前1h 使 用BRD9 选择性抑制剂GSK602 对细胞进行预处理。
1.5 RNA 提取及RT-qPCR 检测使用PBS 洗涤2 遍细胞后,采用Trizol Reagent 法提取总RNA,并按照说明书完成逆转录;随后采用RT-qPCR 法测定抑制剂GSK602 对BRD9 的抑制效率。
1.6 Western Blot 检测去除细胞培养基,PBS洗涤2 次,加入RIPA 试剂后,按照标准操作流程完成蛋白提取、浓度测定、蛋白电泳、转膜及抗体孵育,最后使用ECL 法显现目的条带。
1.7 统计学方法使用SPSS 25.0 及Graphpad 9.0进行统计数据分析。组间比较采用方差分析,以P<0.05 表示有统计学差异。
2 结 果
2.1 差异基因筛选及功能富集分析GSE139061数据集获得397 个DEGs,其中247 个上调,150 个下调(图1A)。GO 富集分析结果提示,分子功能主要富集于肾脏发育、内皮细胞趋化、急性炎症反应、RNA 剪切及乙酰辅酶A 代谢等(图1B);KEGG富集分析结果提示,差异基因主要富集于钙离子信号通路、HIF-1 和Hippo 信号通路以及三羧酸循环通路等(图1C)。

图1 差异基因筛选及功能富集分析。A:差异基因的火山图。B:差异基因的GO 分析。C:差异基因的KEGG 分析。
2.2 基因共表达网络构建基于数据集GSE139061,使用WGCNA 法,首先筛选最佳软阈值,结果如图2A 所示,当软阈值取7 时可获得较好的连接关系。将基因进行模块化富集分析,结果如图2B 所示。将不同模块与疾病性状关联,得到结果如图2C 所示。选择关联性最强的MEblue 进行分析,提取其中的46 个基因作为hub 基因。
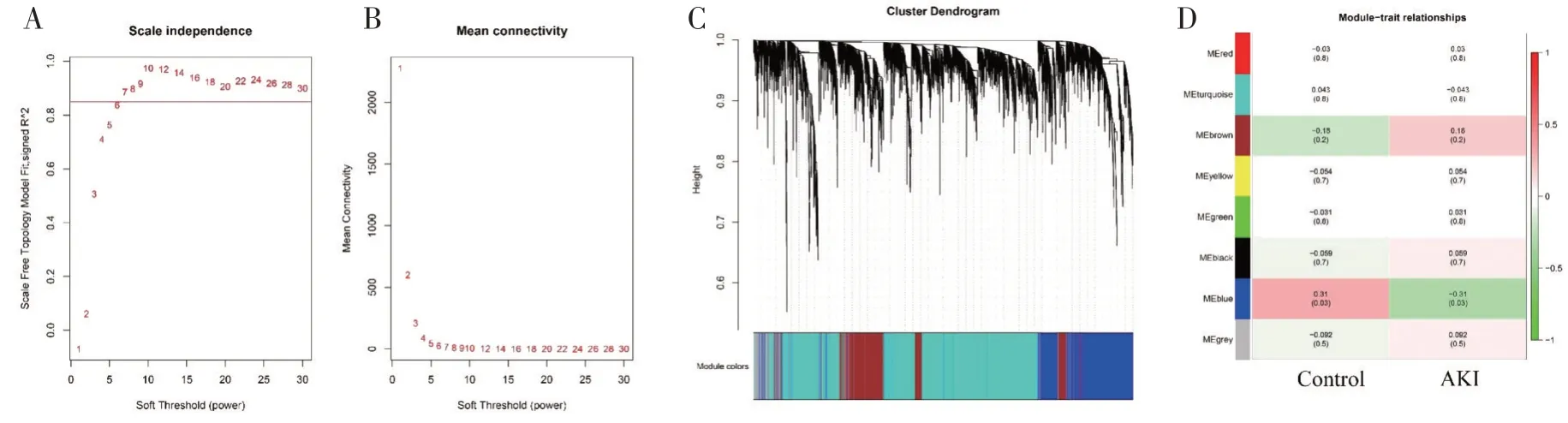
图2 基因共表达网络构建。A:无标度拟合指数分析和平均连接性分析。B:基因簇树状图。图中每个分支代表一个基因,下面的每种颜色代表一个共表达模块。C:模块-特征关系的热图。蓝色模块与AKI 显著相关。
2.3 关键基因筛选将DEGs 结果与WGCNA 所得hub 基因,用Draw Venn Diagram 软件取交集,得到28 个关键基因(图3A)。采用RFA 法对28 个关键基因进行重要性排序,得到结果如图3B 所示。我们发现,其中BRD9 排序靠前,并且与巨噬细胞炎症因子的释放调控紧密相关[3,4]。

图3 筛选关键基因。A:韦恩图。B:随机森林关键基因筛选。
2.4 单细胞数据分析为了进一步探索AKI 发病过程中BRD9 的角色,我们分析了小鼠来源的AKI单细胞数据集GSE139506。UMAP 聚类得到包括巨噬细胞在内的12 群细胞(图4A),我们发现,AKI发生后,BRD9 高表达于巨噬细胞,且随着时间的推移,表达逐渐增加(图4B)。针对巨噬细胞进行GO 富集分析发现,生物学功能主要富集在白介素反应、趋化因子介导的反应、ERK1 及ERK2 级联反应、巨噬细胞迁移、肿瘤坏死因子的分泌等(图4C);KEGG 富集分析结果显示,主要参与趋化因子信号通路、IL-17 和肿瘤坏死因子相关信号通路、Toll 样受体信号通路、NOD 样受体和NF-kB 信号通路(图4D)。
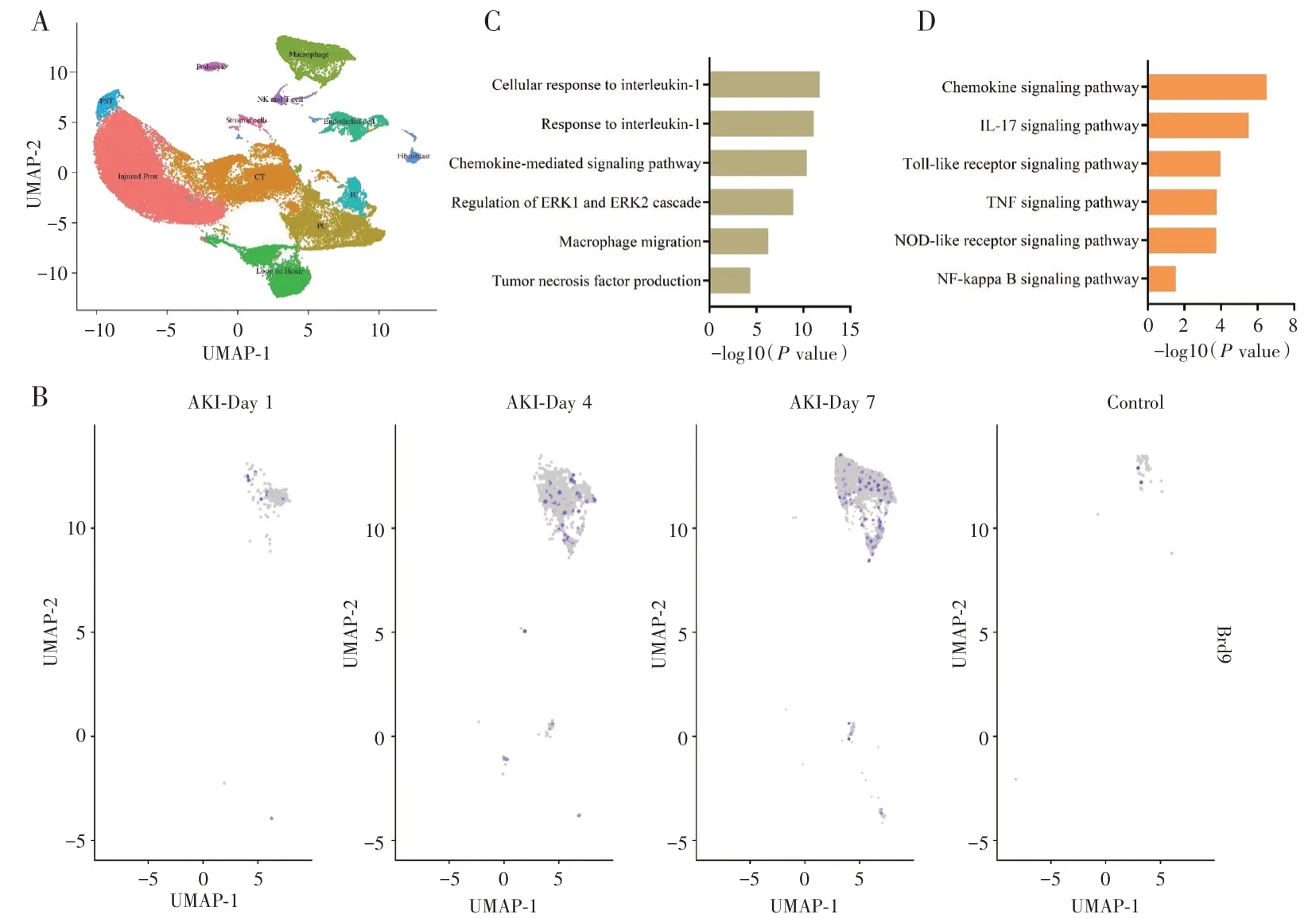
图4 单细胞数据分析。A:UMAP 可视化。B:BRD9 在巨噬细胞的表达量分析C:GO 富集分析。D:KEGG 富集分析。
2.5 BRD9 通过NF-kB 影响NLRP3 炎性小体的激活,调节炎症因子的释放使用BRD9 选择性抑制剂GSK602 0.5 μM 预处理LPS 刺激的Raw264.7细胞,蛋白免疫印迹结果显示,抑制BRD9 蛋白的表达显著降低p65、NLRP3、IL-1β 和IL-18 的蛋白表达水平(图5A-B)。

图5 BRD9 通过NF-kB 影响NLRP3 炎性小体的激活。A:BRD9 的mRNA 表达水平(n=3)。B:蛋白免疫印迹检测NLRP3 炎症小体激活相关蛋白表达的代表图(n=3)。
3 讨 论
尽管人们对于AKI 的认识不断加深,但治疗手段仍然非常有限,由此带来的急性肾衰竭以及随之而来的高致死率亟待解决。本研究通过对数据 集GSE139061 进 行DEGs 分 析、WGCNA 分 析 和RFA 分析,同时结合对单细胞数据集GSE139506的分析,发现了AKI 干预新的潜在靶点;机制上,BRD9 通过NF-kB 影响巨噬细胞NLRP3 炎性小体的激活调节炎症因子的释放,从而影响AKI 的疾病进程。
肾小管损伤、炎症反应、氧化应激和代谢紊乱、是AKI 发病过程中的关键环节[5]。在AKI 的早期阶段,坏死的肾小管上皮细胞形成了一个富含DAMP 的间质微环境,可以促进巨噬细胞极化为促炎表型,导致大量促炎巨噬细胞募集在损伤的肾脏中,加重肾脏损伤[6]。IL-1β 和IL-18 是促炎巨噬细胞的标志,可进一步激活巨噬细胞并促进无菌性炎症[6]。NLRP3 炎性小体在巨噬细胞激活并分泌炎症介质IL-1β 和IL-18 的过程中发挥了重要作用[6]。因此,阻断NLRP3 的激活可能会抑制巨噬细胞的激活,减少AKI 早期的炎症坏死。同时,现有研究表明,通过不同的手段抑制NLRP3炎性小体的异常激活可以极大增强线粒体呼吸链的功能,降低巨噬细胞IL-1β 的产生,从而有效缓解小鼠AKI 的发生发展[7]。
BRD9 属于溴结构域蛋白大家族,是SWI/SNF(BAF)染色质重塑复合物的关键组成部分,能够与乙酰化和/或丁酰化的组蛋白结合,依赖ATP 的方式改变核小体内的DNA-组蛋白接触,使染色质结构发生改变,在肿瘤细胞增殖、多能性和炎症调节等方面发挥重要作用[8]。Hargreaves 等人也发现[3],在未受刺激的巨噬细胞中,BRD9 与BRD4 结合,并在受到刺 激 后BRD9 与STAT1、STAT2 和IRF9 共同招募至干扰素刺激基因的启动子,促进干扰素的表达;BRD9 可能成为抑制干扰素相关炎症的潜在靶点。本研究中,我们进一步验证BRD9是否通过调节巨噬细胞NLRP3 炎性小体功能参与AKI 的发生发展。体外细胞模型结果表明,BRD9抑制剂处理后,p65、NLRP3、IL-1β、IL-18 的蛋白表达水平显著下降,提示BRD9 干扰可以抑制巨噬细胞炎性小体异常激活及限制下游炎症因子的释放,进而缓解AKI 的发生发展。

