腰腿痛宁胶囊通过调控炎症因子途径对兔膝骨关节炎的影响
金美英,张伟冬,王婉霖,李泉锋,赵文海,沙里泉*,崔镇海*
(1.长春中医药大学附属第三临床医院,长春 130117;2.长春中医药大学,长春 130017;3.长春中医药大学附属医院,长春 130021)
膝骨关节炎(knee osteoarthritis,KOA)是以关节软骨退变、软骨下骨硬化、骨赘形成和滑膜增生为特征的骨疾病[1]。研究[2-3]发现炎症机制在介导生物力学失调的影响方面起着核心作用,会造成关节组织生物力学的紊乱。在KOA 炎症的过程中,巨噬细胞会释放出IL-1β、IL-6 和TNF-α 等细胞因子子[4]。这些细胞因子会诱导基质金属蛋白酶(matrix metalloproteinases,MMPs)表达,干扰细胞外基质(extracellular matrix,ECM),促使II 型胶原蛋白(collagen type II)降解,进而损伤关节软骨,加剧KOA 的发展[5]。目前,KOA 的治疗可大致分为减少诱发的危险因素、物理方式、关节内治疗、手术治疗和替代治疗[6]。非甾体抗炎药(NSAIDs)和对乙酰氨基酚(Paracetamol)通常被认为是治疗骨关节炎的首选药物[7]。然而非甾体抗炎药应谨慎用于胃肠道疾病患者,有造成消化道出血、穿孔等风险[8]。因此,安全性高、副作用小的中草药是防治骨性关节炎的较好选择。本团队在前期临床试验中已经验证腰腿痛宁胶囊治疗KOA 的确切疗效。此次研究旨在观察木瓜蛋白酶(papain)诱导的兔早期 KOA 模型中炎症因子的水平,研究腰腿痛宁胶囊对木瓜蛋白酶诱导的兔早期 KOA 的保护作用。
1 动物与材料
1.1 动物
新西兰大白兔20 只,体质量(2.01±0.15)kg,购于哈尔滨市道里区骏琦养殖场[生产许可证编号:SCXK(黑)2021-004]。由黑龙江省实验动物质量监督检验单位检测,实验场地在长春中医药大学动物实验中心。饲养室条件:温度16 ~26℃,湿度40%~70%。饲养时间:上午8:30,下午3:30。实验过程中严格遵守善待动物规定,最大限度减少动物的痛苦,减少动物使用数量。本实验经过长春中医药大学动物伦理委员会审核批准(动物伦理审批号:2020226)。
1.2 药物及试剂
腰腿痛宁胶囊(吉药制备字:Z20200131000,长春中医药大学附属医院),处方成分:熟地黄、鸡血藤、乳香、狗脊、薏苡仁、乌梢蛇、骨碎补、黄芪、牡蛎、鹿角霜、伸筋草、龙骨1、五灵脂、延胡索、地龙、冰片、当归、蜈蚣、天麻、牛膝。木瓜蛋白酶(BS190-25g,Biosharp),L- 半胱氨酸(BS181-25g,Biosharp),速眠新Ⅱ[ 兽药字(2010)070031582,圣达动物药品有限公司],舒泰50[(2015)外兽药证号43 号,Virbac China],仙灵骨葆胶囊(国药准字:Z20025337,同济堂制药有限公司),ELISA 试剂盒 :IL-1β(SP25549,Saipei Biotech Co)、IL-6(SP25495,Saipei Biotech Co)、TNF-α(SP25520,Saipei Biotech Co)。
1.3 主要仪器
动物跑步机(宇晟YS-J100),电子秤(Electronic SF-400),恒温摇床(BLabotery ZHPW-250),染色机(DIAPATH Giotto),X 射线摄像系统(苏州唯特锐医疗器械有限公司 VDR-1800),脱水机(DIAPATH Donatello),组织包埋中心 (Tissue-Tek TEL),正置光学显微镜(Nikon Eclipse E100)。
2 实验方法
2.1 分组及模型制备
20 只实验兔随机分为空白组、模型组、仙灵骨葆组和腰腿痛宁组,每组5 只。模型组、仙灵骨葆组和腰腿痛宁组进行KOA 造摸。具体操作步骤:兔子保定后,剔除左膝关节局部兔毛,碘伏消毒液和75%酒精依次进行消毒,屈曲膝关节75°,定位外膝眼为进针点,诱导剂由Papain(4%)和L-Cysteine(0.03 mol·L-1)配伍,注射量0.5 mL·kg-1。在造模第1 天、第3 天、第7 天各注射1 次。同时,每日定时强迫兔在跑步机活动,早晚各1 次,每次时长为15 min,连续驱赶14 d。造模21 d 后,出现左膝关节肿胀,屈伸障碍,X 线提示膝关节结构改变,判定为KOA 模型成功。
2.2 干预方法
按照以往实验方案进行等量换算,腰腿痛宁胶囊剂量为0.177 g·kg-1,仙灵骨葆胶囊剂量为0.099 g·kg-1。腰腿痛宁胶囊和仙灵骨葆胶囊去除胶囊外衣后,所得药粉均用10 mL 的纯净水配成溶液,每日1 次,连续灌胃28 d。空白组和模型组无需特殊处理,常规饲养即可。
2.3 标本采集
实验结束后,兔右后肢肌肉注射麻醉,麻醉剂(舒泰50 和速眠新Ⅱ,配比 6:1),0.35 mL·kg-1。关节腔内注入0.8 mL 无菌生理盐水,屈伸关节15 次,抽取膝关节液 0.5 mL,耳缘静脉处取血 5 mL,均注入无菌 EP 管中离心,设置参数为3000 r·min-1,运转10 min,吸取上清液后置于-20 ℃ 冰箱中待测。采用空气栓塞法进行安乐死,打开左膝关节腔,用咬骨钳夹取股骨远端和胫骨近端,放入4%多聚甲醛固定液中保存。
2.4 检测指标
2.4.1 兔左膝关节活动度测量 观察各组治疗前后左膝关节活动度改变情况。在治疗前(OA 模型建立后)和治疗结束后,用量角器测量兔左后肢膝关节活动角度,评估关节被动活动范围。量角器的轴心放置在膝关节的中心,量角器的静止臂与股骨平行固定,移动臂跟踪胫骨的运动。分别记录膝关节处于最大伸展和屈曲状态时的角度(°)。膝关节活动范围的计算方法是最大伸展角度减去最大屈曲角度。
2.4.2 X 线片影像 观察各组拍摄X 线片,观察膝关节情况。兔置于固定器上,用眼罩遮住双目,待到呼吸平顺,被动延展兔双后肢,保持在适度拍摄体位。正位片拍摄方法:1)兔取仰卧位,被动屈髋30°,髋外展15°,尽量伸直膝关节,保持髌骨位于正前方,放射球管距离拍摄部位110 mm;2)拍摄侧位片时取侧卧位,左后肢伸直置于前侧,右后肢被动屈髋70°、屈膝30°置于后侧,放射球管距离拍摄部位110 mm;3)设置检验参数:工作电压45 kVP,照射电流160 mA,照射量为5.02 mAs,曝光时间31 ms。
2.4.3 软骨组织病理观察 所有实验兔左侧胫骨关节面处进行软骨取材,用锋利骨凿凿至深达软骨下骨层,软骨获取后需要修剪成大小合适组织块,放入4%多聚甲醛固定液中保存。经过脱水脱钙等一系列处理后,用光学显微镜对软骨组织情况观察拍照。
2.4.4 软骨损伤程度评价 采用Mankin 评分标准判定软骨的损伤程度。
2.4.5 血清和关节液中炎症因子水平测定 采用ELISA 法测定血清和关节液中 IL-1β、IL-6、TNF-α的水平,具体检测操作方法严格按照ELISA 试剂盒说明书上进行。
2.5 统计学方法
应用GraphPad Prism 9.00 对数据进行处理,用One-Way ANOVA 检验方差齐性的数据,采用配对t检验法进行组内比较,LSD-t 法进行组间比较。以P<0.05 为差异有统计学意义。
3 结果
3.1 各组左膝关节活动度变化比较
见表1。
表1 各组左膝关节活动度变化比较(±s,n = 5) °

表1 各组左膝关节活动度变化比较(±s,n = 5) °
注:与空白组比较,# P <0.05;与模型组比较,△P <0.05;与治疗前比较,▲P <0.05
组别治疗前治疗后空白组138.40±1.67140.00±3.00模型组 91.40±3.85#100.80±4.38腰腿痛宁组 88.20±5.67#128.40±6.39△▲仙灵骨葆组 90.00±7.52#130.20±4.32△▲
3.2 各组左膝关节X线影像学比较
各组X 线片结果显示,空白组兔膝关节双侧髁间隙距离等宽,胫骨平台轮廓清晰,未见骨赘;模型组外侧髁间隙明显变窄,胫骨平台关节面粗糙不平,可见髁间隆起变锐,软骨下骨骨质硬化,骨赘形成;仙灵骨葆组外侧髁间隙窄于内侧,髁间隆起变锐,骨赘形成;腰腿痛宁组关节间隙未见明显异常,髁间隆起稍变锐,骨赘形成。见图1。

图1 各组左膝关节X线影像学比较
3.3 各组病理组织HE 染色结果
HE 结果显示,空白组软骨组织染色均匀,表面光滑,细胞形态结构正常、排列规则,潮线完整;与空白组比较,模型组软骨组织显示局部软骨细胞排列不规则,有多处裂隙,出现陷窝,符合骨关节炎病理改变,提示造模成功;仙灵骨葆组关节软骨中可见裂隙,软骨欠光泽,关节面稍不平整,但情况好于模型组;腰腿痛宁组显示关节软骨中可见少量裂隙,关节表面较光滑平整,结构改善。见图2。
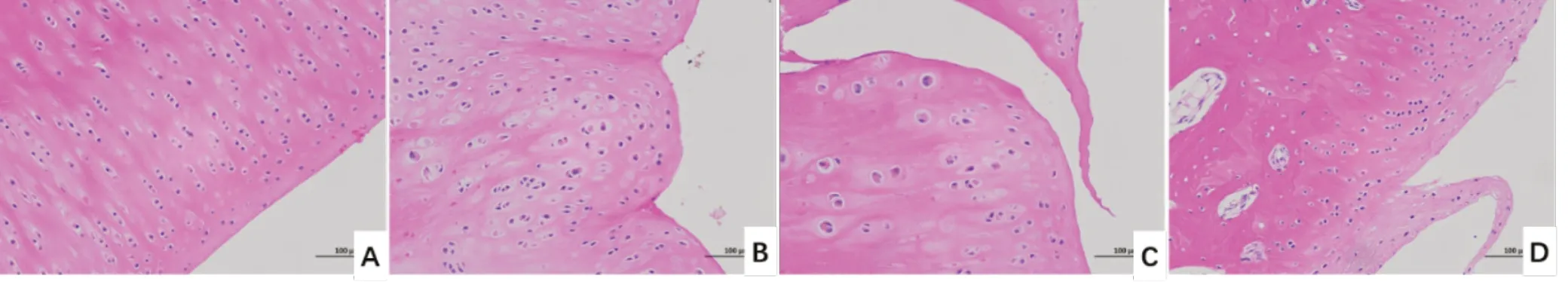
图2 各组病理组织HE 染色结果
3.4 各组治疗后左膝关节软骨Mankin 评分比较
见表2。
表2 各组治疗后左膝关节软骨Mankin 评分比较(±s,n = 5) 分

表2 各组治疗后左膝关节软骨Mankin 评分比较(±s,n = 5) 分
注:与空白组比较,# P <0.05;与模型组比较,△P <0.05
组别评分空白组0.00±0.00模型组5.00±0.71#腰腿痛宁组2.20±0.84△仙灵骨葆组2.40±1.14△
3.5 各组治疗后血清中炎症因子水平比较
见表3、图3。
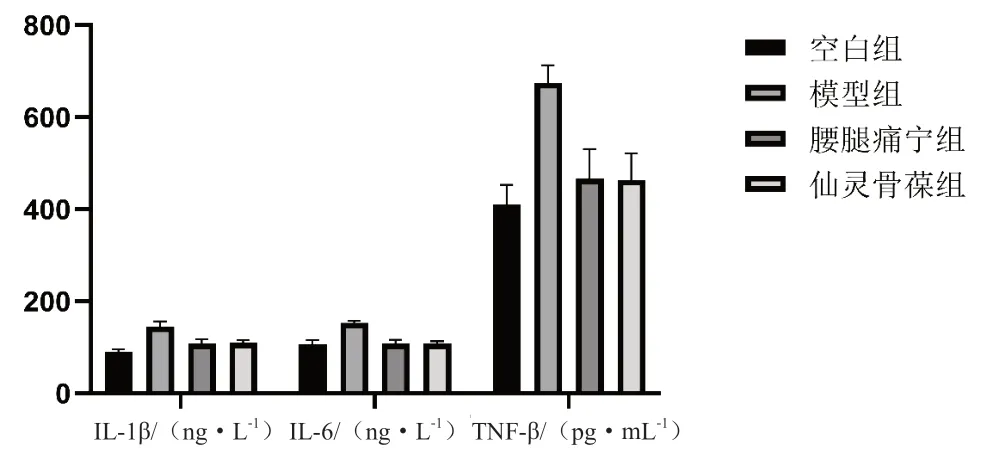
图3 各组治疗后血清中炎症因子水平比较
表3 各组治疗后血清中炎症因子水平比较(±s,n= 5)

表3 各组治疗后血清中炎症因子水平比较(±s,n= 5)
注:与空白组比较,# P <0.05;与模型组比较,△P <0.05
组别IL-1β/(ng·L-1)IL-6/(ng·L-1)TNF-α/(pg·mL-1)空白组106.18±9.80 106.18±9.80410.25±43.05模型组152.75±4.03# 152.75±4.03# 674.42±38.30#腰腿痛宁组108.09±8.50△108.09±8.50△ 466.57±64.49△仙灵骨葆组108.64±4.19△108.64±4.19△ 463.47±57.85△
3.6 各组治疗后关节液中炎症因子水平比较
见表4、图4。
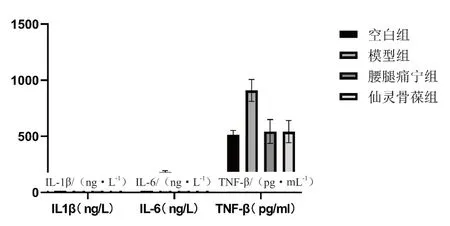
图4 各组治疗后关节液中炎症因子水平比较
表4 各组治疗后关节液中炎症因子水平比较(±s,n= 5)
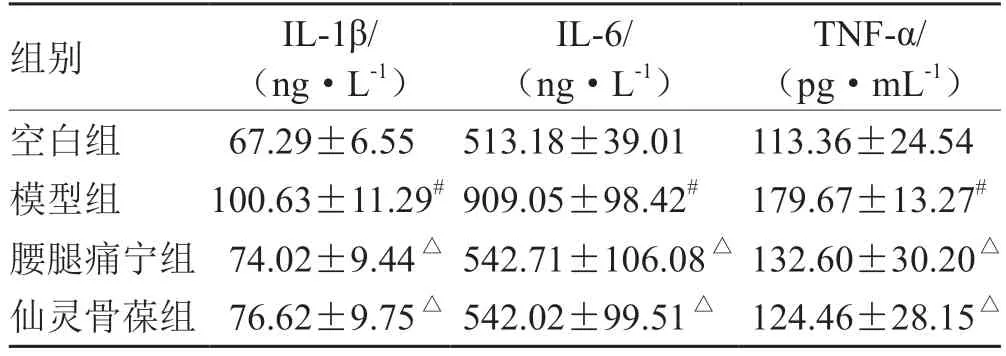
表4 各组治疗后关节液中炎症因子水平比较(±s,n= 5)
注:与空白组比较,# P <0.05;与模型组比较,△P <0.05
组别IL-1β/(ng·L-1)IL-6/(ng·L-1)TNF-α/(pg·mL-1)空白组 67.29±6.55 513.18±39.01113.36±24.54模型组100.63±11.29# 909.05±98.42# 179.67±13.27#腰腿痛宁组 74.02±9.44△542.71±106.08△132.60±30.20△仙灵骨葆组 76.62±9.75△542.02±99.51△ 124.46±28.15△
4 讨论
骨关节炎与肾气亏损致血瘀痹阻有关,患者伴有膝部疼痛,关节屈伸不利,甚则僵硬。本人经过数十载的临床经验总结出了“益肾填精、活血除痹”的独特诊治思路,研制出腰腿痛宁胶囊。此方药具有益肾填精之效,可濡养骨骼强健经筋。方中选用鹿角霜,取其补肾阳亦强筋骨之用,在配伍熟地黄滋阴,益精填髓,二者同用平调阴阳,壮其筋骨。骨碎补能活瘀血,续断伤,传统中医药在治疗骨折疾病时大量应用,有破血止血,补伤折之说。当归可活血、亦补血;狗脊强筋骨,能止痛;黄芪补气血,驱病邪。地龙,乌蛇,蜈蚣配伍,增强活血通络之功,气血聚处,祛邪以无痕。诸药共用,周流气血,通畅经脉,其病可愈。仙灵骨葆胶囊在诊疗指南(2020年版)[9]中为膝关节炎推荐用药,临床证实能有效改善膝骨性关节炎患者的各项指标[10]。将其作为阳性对照组药物,能与腰腿痛宁胶囊组形成良好对照。
团队前期实践证明腰腿痛宁胶囊在治疗 KOA 临床疗效显著[11],此次研究设计动物实验主要探讨其作用机制。木瓜蛋白酶能直接作用于兔关节软骨,引起细胞外基质中蛋白多糖的降解[12]。蛋白多糖的缺失会相对增加胶原蛋白的暴露,促炎因子和基质金属蛋白酶对基质的破坏也会加强,导致软骨基质的大量流失[13]。然而,软骨细胞新分泌的胶原蛋白等基质成分的性能较差,软骨基质的生物和机械性能发生变化,软骨失去正常的弹性和抗压能力,最终导致骨关节退化[14]。这种方法可以避免手术引起的关节腔内出血、结构破坏等并发症的干扰,适用于研究软骨的病理变化和药物对早期KOA 的治疗效果。兔造摸后,左下肢均出现不同程度肿胀,皮温升高情况。驱使兔被迫运动,可见兔左后肢因疼痛无法触及地面,出现跛行。同时,抽取患肢关节液时,呈浑浊状态,以上改变与早期KOA 病理发展基本一致,说明兔KOA 模型建立成功。
研究[15]发现,软骨组织中IL-1β、IL-6、TNF-α等细胞因子的增加是骨关节炎的主要特征,炎症在骨关节炎的发生发展中起核心作用。在骨关节炎的早期阶段,分解代谢活性增加,这与炎症介质、软骨降解蛋白和应激反应因子的表达增加有关[16]。这些改变导致软骨细胞丢失,从浅层的纤颤到更复杂和更深的裂隙[17]。IL-6 可以促进成纤维细胞的产生,并通过增强KOA 中IL-1β 和TNF-α 等细胞因子的破坏作用而加速软骨基质的降解[18-19]。同时,TNF-α也可诱导 IL-1、IL-6 等的释放,它们之间相互影响,共同作用于骨关节炎发生、发展的各个环节[20]。给药28 d 后,药物治疗组胫骨软骨表面粗糙度减弱,软骨细胞排列更加整齐,同时血清和关节液中的炎症因子明显减少。驱赶兔被迫运动时,治疗组后肢蹬地有力,而模型组仍有不同程度跛行。实验中兔关节损伤程度基本与炎症因子水平呈正相关,说明通过抑制血清和关节液中1L-1β、IL-6、TNF-α 水平可以延缓KOA 病情发展。
本研究结果显示,经腰腿痛宁胶囊干预后,兔早期KOA 模型血清和关节液中1L-1β、IL-6、TNF-α 的水平均明显降低。说明腰腿痛宁胶囊能延缓软骨的退化,其作用机制可能与降低炎症因子水平有关。由于腰腿痛宁胶囊是中药复方制剂,且KOA 发病机制复杂,所以其药物有效成分和作用靶点需进一步深入研究。

