唾液乳杆菌在类风湿性关节炎疾病进展中的作用
袁 飞,黄暖琴,黄 莹,萧韵健,李 丽,杨彩红
(南方医科大学附属东莞医院;东莞市人民医院,广东 东莞 523058)
类风湿性关节炎(rheumatoid arthritis,RA)是一种慢性全身性自身免疫性疾病,主要侵犯全身各处关节,呈多发性和对称性,由此引起关节软骨和关节囊的破坏,最后导致关节强直畸形[1].RA在临床上是一种常见慢性的炎症性疾病,初期主要表现为关节僵硬(尤其是晨僵)、关节肿胀疼痛,甚至关节出现畸形[2-3].目前,RA的发病机制尚不明确.
众所周知,多种微生物在人体内共生,对人体的免疫功能发挥着重要调控作用[4].有研究[5]表明,多种细菌与RA的发生发展存在相关性.肠道是人体最大的微生物寄居地,肠道微生态系统是由上皮细胞、肠道固有菌群、肠黏膜免疫系统组成的[6],肠道内种类繁多的微生物和谐共生.有研究[7]表明,机体免疫功能受肠道微生态平衡的影响,参与免疫应答,肠道内黏膜可阻止有害物质进入,其不仅是保护屏障,也是主要的抗体分泌和免疫球蛋白的“工厂”[8],因此,肠道菌群失调可导致多种疾病的发生.已有研究[9]发现:RA发病与大肠埃希杆菌、奇异变形杆菌、结核分枝杆菌等细菌感染相关;在RA患者关节中亦检测到细胞壁肽聚糖成分和肠道细菌降解的DNA,同时,人肠道细菌的细胞壁可诱发实验动物产生关节炎[10];许多肠道细菌的其他成分亦能激发类风湿因子抗体的分泌,这表明肠道细菌可能影响RA发病[11].
有研究[12]通过测序技术发现肠道菌群在调节机体免疫能力方面发挥着重要作用.肠道菌群紊乱将导致肠道菌群多样性发生变化(致病菌增加,有益菌群减少),进而导致RA的发生和发展[13].唾液乳杆菌属于乳杆菌科、乳杆菌属,广泛地存在于人和动物的肠道中,是肠道菌群的重要成员之一,在多种疾病发生和发展中发挥着重要作用,但其在RA中的作用研究较少.本研究主要探讨唾液乳杆菌在RA进展中的作用,旨为RA的预防和治疗提供新的思路和方向.
1 材料与方法
1.1 唾液乳杆菌和甲氨蝶呤制备
唾液乳杆菌(ATCC11741,北京北纳创联生物技术研究院)配制:在厌氧环境下培养48 h,活菌计数,采用无菌生理盐水配制菌液为1010CFU/mL.甲氨蝶呤(上海上药信谊药厂有限公司)配制:取8片甲氨蝶呤片(共20 mg),加入少量0.5%羧甲基纤维素钠(CMC-Na)混悬液研磨,待充分研磨后,继续加0.5% CMC-Na混悬液至26.3 mL,得0.76 mg/mL的甲氨蝶呤混悬液.
1.2 动物实验
1.2.1 动物准备及饲养
SD大鼠(广东省医学实验动物中心,动物使用许可证号:SYXK(粤)2018-0002)饲养条件:检疫期间4只大鼠/箱,群养;试验期间4只大鼠/箱,饲养温度为20~26 ℃,湿度为40%~70%,采用12 h∶12 h昼夜交替照明,自动抽风;自由进食和饮水,饲料为全价颗粒饲料(广东省医学实验动物中心),饮水为广东省医学实验动物中心制备的纯净水.本实验经广东省医学实验动物中心实验动物伦理委员会批准(13202109-4).
1.2.2 动物分组及预防性给药
选用32只雄性SD大鼠,采用先预防给药,再造模,将其随机分为唾液乳杆菌组、甲氨蝶呤组,胶原诱导型(collagen-inducedarthritis,CIA)模型对照组、健康对照组,每组8只.分组结束后,测量所有动物双后肢足趾体积2次,测量完成后,各组开始给药.健康对照组直接灌胃细菌培养基1 mL/(次·只),3次/周;CIA模型组亦直接灌胃细菌培养基1 mL/(次·只),3次/周;唾液乳杆菌干预组灌胃给予唾液乳杆菌(1010CFU/mL)1 mL/(次·只),3次/周;甲氨蝶呤组灌胃给予甲氨蝶呤(7.6 mg/kg),1次/周,连续2周.分组及给药情况见表1.
1.2.3 模型建立
本实验在预防灌胃给药2周后测量所有动物双后肢足趾体积2次,记为第零天的情况.第1天开始首次造模,除健康对照组外,其余3组动物使用Hamilton注射器在动物尾根部2 cm处皮下进针,距尾根部0.5 cm处皮下注射乳化剂(胶原-弗氏完全佐剂混合乳化后),每只200 μL.第8天加强造模,除健康对照组外,其余3组动物使用Hamilton注射器在动物尾根部3 cm处皮下进针,距尾根部1.5 cm处皮下注射乳化剂(胶原-弗氏不完全佐剂混合乳化后),每只200 μL.造模成功后,对应各组持续给药4周.实验结束时,处死动物,留取左侧踝关节,中性甲醛固定,行组织病理学检查.

表1 各组给药情况(♂)Tab.1 Administration of each group (♂)
1.2.4 造模评分
D15(第15天),测量所有动物四肢足趾体积2次,并依照表2进行评分.

表2 CIA大鼠模型关节炎评分标准Tab.2 Arthritis scoring standard of CIA rat model
1.3 检测指标
1)一般观察:每天观察动物状态,并进行记录.
2)各组体质量测量:实验期间,每周测量体质量1次.
3)各组CIA评分:造模开始后每周依照表2进行双人独立关节炎评分1次.
4)足跖体积测量:造模开始后,每周测量双后肢足肿胀体积3次.
5)各组粪便采集及粪便菌群DNA检测:第2周、第5周、第8周分别采集无菌采集动物粪便1次,每只动物2粒(冻存),初次免疫后的第13天进行粪便菌群DNA检测.根据大鼠粪便DNA提取试剂盒操作步骤提取粪便菌群DNA.取各组粪便样品200 mg,置于预冷的离心管内,加入300 mg玻璃珠、400 μL裂解液和20 μL蛋白酶K,混匀10 min,70 ℃水浴20 min,期间3次颠倒混匀,15 000 r/min离心5 min;取上清于另一离心管内,加入200 μL萃取分离液,混匀20 s,孵育5 min,15 000 r/min离心5 min;取上清250 μL至离心管内,加入250 μL含无水乙醇的结合液,混匀,15 000 r/min离心2 min;弃去管内液体,并将离心柱置于新的管内,并加入500 μL漂洗液,15 000 r/min离心2 min;弃去管内液体,再将离心柱置于新的管内,加入750 μL洗涤液,15 000 r/min离心2 min;弃去管内液体,15 000 r/min离心4 min;转移离心柱于离心管内,加入200 μL洗脱液后,室温条件下温育4 min,然后15 000 r/min离心2 min;得到肠道菌群DNA,-20 ℃以下低温保存.采用乳杆菌属特异性引物进行荧光定量PCR,检测肠道乳杆菌属种类及数量.
6)HE染色实验:HE染色主要用于观察足跖病理学变化,结果显示,大鼠足跖组织损伤程度加大;处死各组大鼠,分离膝关节,应用4%多聚甲醛固定24 h,然后转移至70%酒精中,进行石蜡包埋、切片、HE染色,最后用光镜进行观察.
1.4 统计学分析

2 结 果
2.1 大鼠病理组织学观察
健康对照组送检8例踝关节进行组织学检查,结果未见异常变化.CIA模型对照组送检8例踝关节,结果重度关节炎3例,表现为滑膜纤维化、单核细胞浸润、局部出现坏死、关节软骨侵蚀、骨组织受累,且与周围组织粘连,关节腔狭窄或消失;中度关节炎2例,表现为滑膜上皮及小血管增生、形成血管翳、滑膜上皮及间质单核细胞浸润、局部可见单核细胞聚集;轻度关节炎3例,表现为滑膜上皮细胞增生、滑膜血管增生/淤血、滑膜上皮及间质单核细胞浸润.
唾液乳杆菌干预组送检8例踝关节,其中轻度关节炎7例,1例未见异常变化;甲氨蝶呤组送检8例踝关节,4例可见与CIA模型对照组相似病变,其中重度关节炎1例,中度关节炎1例,轻度关节炎5例,1例未见异常变化.各组大鼠病理组织学变化结果显示,唾液乳杆菌干预可明显改善RA大鼠组织病理状态.
2.2 体质量指数变化
本研究结果显示,各组大鼠每周体质量变化情况见表3,各组体质量比较差异无统计学意义(P>0.05),说明体质量在关节炎病程中并不是关键因素.
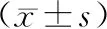
表3 各阶段各组大鼠体质量情况Tab.3 Body mass of rats in each stage
2.3 关节炎程度(CIA)评分
本研究结果显示,除健康组以外,其他3组大鼠进入CIA建模阶段后,在无干预情况下关节炎程度明显更高(模型组关节炎评分最高),与健康组相比,模型组关节炎评分显著增高(P<0.01);与模型组比较,唾液乳杆菌干预组和甲氨蝶呤组大鼠的关节炎程度评分均显著下降(P<0.01).见表4.
2.4 足跖容积测量分析
足跖容积测量分析结果显示,前足跖容积(见图1 a)、后足跖容积(见图1 b)及前后足跖综合容积(见图1 c)唾液乳杆菌干预组均显著低于模型组(P<0.05),且与甲氨蝶呤组足跖容积水平相似.足跖容积测量分析表明,唾液乳杆菌可显著改善CIA模型大鼠的肿胀程度.结果见图1.
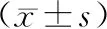
表4 各组大鼠CIA模型后关节炎程度评分Tab.4 Arthritis degree scores of rats in each group after CIA model

图1 各组大鼠足跖容积变化趋势Fig.1 Change trend in plantar volume of rats in each group
2.5 HE染色分析
本研究结果显示,健康对照组大鼠(图2 a)踝关节组织结构未见异常变化;CIA模型组大鼠(图2 b)可见踝关节组织结构有重度关节炎;唾液乳杆菌干预组大鼠(图2 c)踝关节有轻度关节炎;甲氨蝶呤组大鼠(图2 d)踝关节有中度关节炎.与模型组比较,唾液乳杆菌干预组大鼠踝关节关节炎明显减轻,说明唾液乳杆菌可改善CIA大鼠的关节炎.各组大鼠足跖HE染色情况见图2.
2.6 唾液乳杆菌多样性分析
唾液乳杆菌多样性分析结果见表5,与健康对照组相比,CIA模型组的相似度、丰富度(S)、均匀度(E)和Shannon-Wiener指数(H)均显著降低(P<0.05);与CIA模型组相比,唾液乳杆菌干预组和甲氨蝶呤组的相似度、丰富度(S)、均匀度(E)和Shannon-Wiener指数(H)均显著升高(P<0.05);而唾液乳杆菌干预组与甲氨蝶呤组指标比较差异无统计学意义(P>0.05).

a.健康对照组;b.CIA模型组;c.唾液乳杆菌干预组;d.甲氨蝶呤组.图2 各组大鼠足跖HE染色情况Fig.2 HE staining of rats’ toes in each group

表5 4组唾液乳杆菌的多样性Tab.5 Diversity of Lactobacillus salivary bacteria of four groups
3 讨 论
类风湿性关节炎是一种影响关节的慢性自身免疫性疾病,临床上肠道微生物群在RA免疫功能障碍中发挥着至关重要的作用.然而,肠道微生态失调导致RA的机制尚不完全清楚.目前,RA发病机制有一种假设:由于黏膜免疫系统和异常的局部微生物群之间的相互作用,疾病开始于黏膜部位,然后转移到滑膜关节.确诊的RA患者肺部、口腔和肠道微生物菌群组成的变化表明,黏膜微生态失调在RA的发展和持续中发挥作用,来自RA小鼠模型的数据也支持这一观点[14].几种广泛用于治疗RA的治疗方案均与肠道微生物群的改变有关,表明调节肠道微生物群和/或肠道屏障功能可能有助于预防或治疗RA[15].已有研究[16-17]表明,粪便微生物群移植、活体生物治疗或针对微生物群的饮食干预可能是自身免疫性疾病(包括RA)的一种治疗新方法.
肠道是人体最大的微生物寄居地,是由上皮细胞、肠道局部黏膜大量固有的菌群免疫系统组成的肠道微生态系统[6],多种微生物在人体内共生,对人体的免疫功能发挥着重要的调控作用[4].乳杆菌是人体肠道中最具代表性的益生菌属之一,在维持及调节机体肠道菌群稳态中发挥着关键作用[18].已有研究[19]发现,通过乳杆菌移植能够调控肠道微生物群稳态,可以达到治疗疾病的目的;植物乳杆菌DP189可以通过调节肠道微生物群,改善帕金森病小鼠的神经退行性变.唾液乳杆菌是乳杆菌的一种,是从人体肠道中分离出来的益生菌菌株,在2010年4月22日卫生部关于印发《可用于食品的菌种名单》之中,乳杆菌是一种可食用的益生菌,已经应用于多种疾病的预防和治疗中[20].在哮喘模型中,唾液乳杆菌灌胃可以减轻哮喘小鼠的临床症状、气道炎症,改善哮喘小鼠Th1/Th2失衡[21].本研究结果显示,在胶原诱导的关节炎模型中,唾液乳杆菌灌胃可以减轻关节炎模型大鼠的病理状态.
大鼠足跖肿胀是筛选和研究抗炎药物的经典方法,对肿胀程度的精确跟踪检测是实验成败的关键,在断足称重、周径测量、千分尺厚度测量和溶剂法中,以足跖容积测量方法最为灵敏和稳定,且操作简便.本研究结果显示,各组大鼠病理组织学变化显示唾液乳杆菌干预可明显改善RA大鼠组织病理状态.本研究对肿胀程度的数据显示,唾液乳杆菌干预组和甲氨蝶呤组大鼠的关节炎程度评分均有显著下降(P<0.05).各组大鼠足跖进一步行HE染色,结果显示唾液乳杆菌干预组的大鼠踝关节处关节炎情况明显减轻,唾液乳杆菌多样性分析表明其多样性程度与RA严重程度具有一定相关性.有研究[22]显示,接受甲氨蝶呤治疗的RA患者肠道微生物菌群发生了变化.
综上所述,唾液乳杆菌对RA可能有类似于甲氨蝶呤(治疗RA的常用药物)的治疗效果和作用.下一步我们将从炎症细胞因子水平入手,深入探讨唾液乳杆菌对RA干预的作用机制.

