纳米药物重编程肿瘤相关巨噬细胞增强抗癌效果
陈明娃 王俊侠
华南理工大学附属第二医院,广州市第一人民医院(广州 510180)
癌症进展由肿瘤细胞及肿瘤微环境(tumor microenvironment,TME)共同决定。TME是由多种细胞和非细胞成分组成的有机整体,包括肿瘤细胞、细胞外基质、血管/淋巴管、成纤维细胞、免疫细胞以及各种分泌因子[1]。浸润性免疫炎症细胞是TME的重要组成部分,而肿瘤相关巨噬细胞(tumor associated macrophages,TAMs)是其中重要的一类细胞,占肿瘤细胞总数的50%以上[2]。TAMs主要来源于外周血中的单核细胞,可通过癌细胞释放的多种炎症信号募集到原发或转移的肿瘤中[3-4]。TAMs能刺激肿瘤血管生成,促进肿瘤免疫逃逸和耐受,促进肿瘤细胞的增殖、扩散和继发性转移肿瘤的建立[5-7]。
巨噬细胞主要分为两个亚型:经典激活的M1型和选择性激活的M2型巨噬细胞[8]。经典激活的M1型巨噬细胞具有促炎功能,并显示出强大的抗病原体和吞噬肿瘤细胞的功能。除了高吞噬能力外,M1巨噬细胞还能分泌促炎细胞因子包括IL-12、IL-23和TNF-α,促进白细胞的募集和激活。在肿瘤发展进程中,TME会释放因子如IL-4、IL-13等使得M1型巨噬细胞向M2型巨噬细胞极化。M2型巨噬细胞是一种免疫抑制型巨噬细胞,具有促肿瘤活性,释放IL-10、Arg-1等抗炎细胞因子[9-10]。TAMs大多为促肿瘤活性的M2型巨噬细胞,促进肿瘤的增长和转移。考虑到TAMs在肿瘤进展、转移和治疗后复发中的重要作用,TAMs成为肿瘤治疗的一个有吸引力的治疗靶点。
越来越多的数据显示,纳米药物通过利用肿瘤的高通透性和滞留效应(enhanced permeability and retention effect,EPR)在肿瘤部位聚集表现出很好的效果[12];另外,纳米药物可以通过被不同的靶向配体修饰,以实现肿瘤的靶向递送[13]。基于脂质体、合成和天然来源的聚合物以及无机颗粒,纳米颗粒被设计成不同的形状和大小[14]。与传统的给药方法相比,纳米药物能以最佳剂量将药物输送到特定组织,从而提高药物效力,同时减少副作用[15]。目前,纳米药物在重编程TAMs增强抗肿瘤方面也引起了广泛的关注和研究兴趣[16]。
在这篇综述中,我们将重点总结近期纳米药物介导将促肿瘤的M2型巨噬细胞重新编程为抗肿瘤的M1型巨噬细胞以恢复抗肿瘤免疫的两种策略及典型进展,包括①纳米药物介导的TAMs靶向递送各种活性物质进行重编程;②纳米药物介导的异常TME调节的间接重编程(图1)。
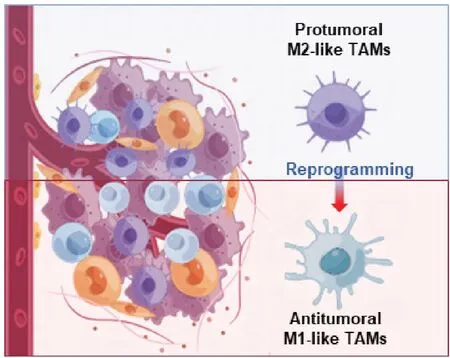
图1 纳米药物介导的TAMs 从M2 样巨噬细胞向M1 型巨噬细胞重编程用于抗肿瘤免疫治疗的示意图
1 纳米药物介导的TAMs 靶向递送各种活性物质进行重编程
纳米药物可以装载多种治疗剂以靶向肿瘤中的TAMs,从而调节表面受体、细胞因子或者调节转录信号以将其重编程为M1巨噬细胞。
1.1 靶向CD44受体重编程TAMs
透明质酸(hyaluronic acid,HA)是一种酸性黏多糖,也是细胞外基质的组成部分。当HA与M2型巨噬细胞表面的CD44受体结合时,可以导致M2巨噬细胞骨架的重组,从而介导向M1型促炎细胞的转变。基于HA良好的生物相容性,许多研究工作者将其应用于纳米药物递送系统中。例如,Zhang等[17]合成了一种名为LMWHA-MPB的纳米颗粒,并用低分子量HA进行了表面修饰,纳米颗粒可以逆转M2型巨噬细胞向M1型巨噬细胞转化。
1.2 靶向甘露糖受体重编程TAMs
TAMs在M2极化过程中的一个显著特征是甘露糖受体的过度表达[18],甘露糖受体在TAMs上的大量表达被广泛用于TAMs靶向设计[19]。之前的研究表明,甘露糖修饰的脂质体在甘露糖受体介导的TAMs靶向效应下,在体外细胞内化、肿瘤球体穿透和体内肿瘤聚集方面表现出优异的表现[20]。绿原酸(chlorogenic acid,CHA)是一种有效的抗肿瘤免疫调节剂,通过促进STAT1激活和抑制STAT6激活,促进TAMs从M2表型分化为M1表型。然而,体内快速清除和低肿瘤聚集影响了CHA在临床试验中的免疫治疗效果。Jun等[21]合成了基于甘露糖的脂质体用于将CHA靶向递送至TAMs。制备的CHA封装的甘露糖基化脂质体具有理想的粒径、良好的稳定性,并通过甘露糖受体介导的TAMs靶向作用在肿瘤中优先蓄积。此外,CHA封装的基于甘露糖脂质体通过有效地促进促肿瘤M2巨噬细胞向抗肿瘤M1巨噬细胞的极化来抑制G422胶质瘤的生长。结果表明,CHA包封的甘露糖脂质体通过诱导TAMs重编程,提高肿瘤免疫治疗效果(图2)。
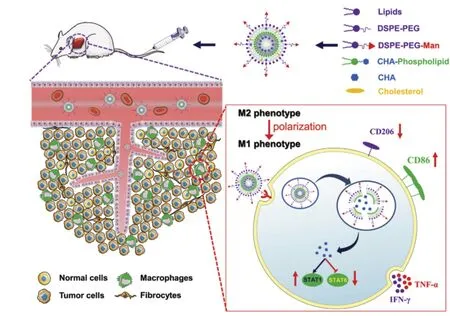
图2 CHA 封装的Man-PEG-Lipo 用于癌症治疗示意图
对甘露糖受体和其他受体的双重靶向可以获得更好的疗效。mTOR信号通路对于调节细胞代谢和TAMs的重编程非常重要。基于此,Chen等[22]开发了含有mTOR抑制剂(雷帕霉素)和抗血管生成药物(雷戈非尼)的共递送脂质体纳米递送系统,该系统可以双重调节肿瘤代谢和血管生成。通过PD-L1抗体和甘露糖配体的双重修饰,脂质体可以靶向过表达PD-L1和甘露糖受体的TAMs和肿瘤细胞。该输送平台可有效减少糖酵解,重极化TAMs,抑制血管生成,重编程免疫细胞,从而抑制肿瘤生长(图3)。
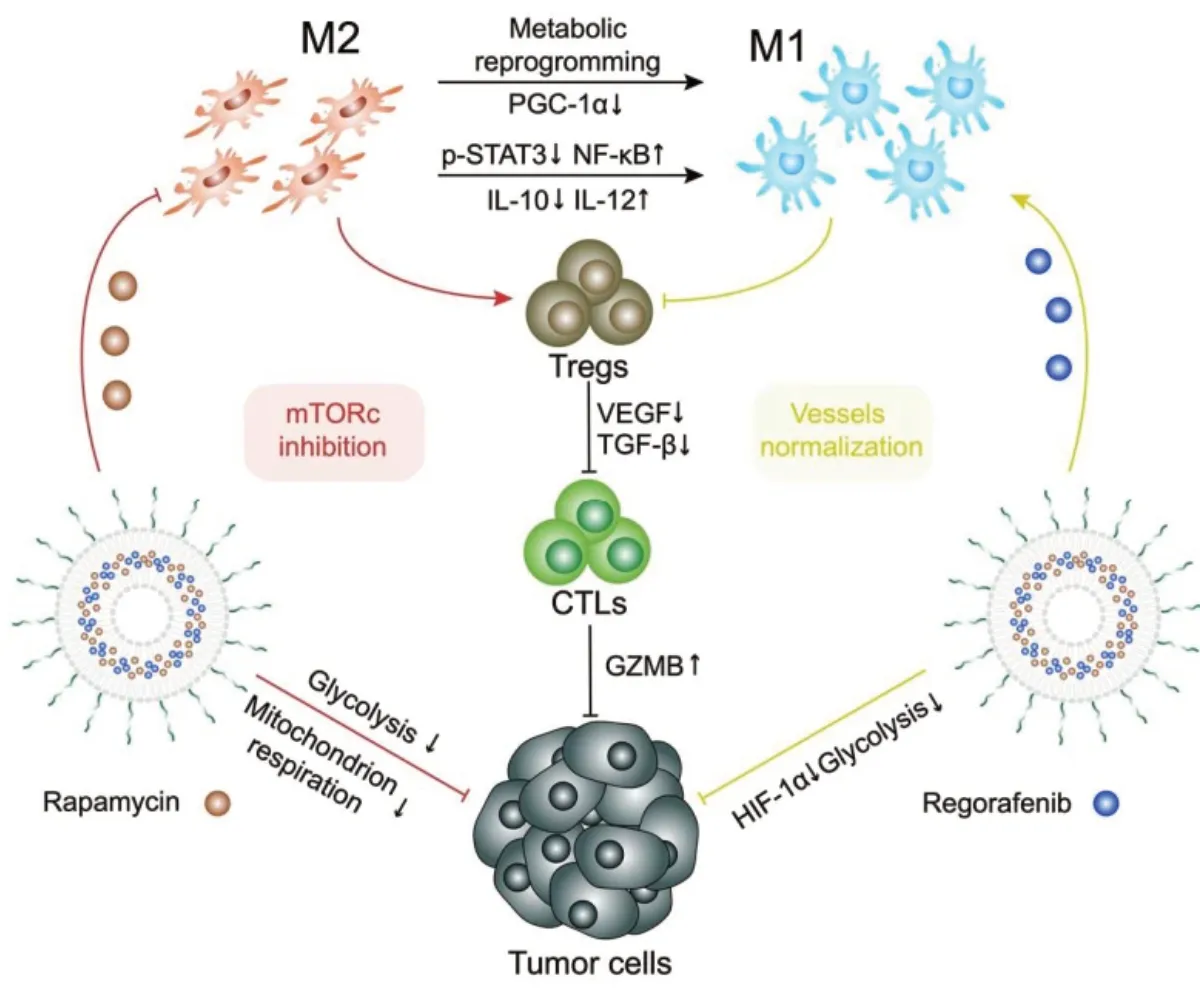
图3 通过mTOR 途径代谢调节和利用PD-L1 靶向抗血管生成共传递重塑肿瘤微环境的示意图
1.3 靶向Toll样受体重编程TAMs
TLR7/8是一种增强免疫功能的有效靶点。Resiquimod(R848)是一种咪唑并喹啉的小分子化合物,是TLR7/8激动剂,可以将M2型巨噬细胞极化为M1型巨噬细胞。Wei等[23]开发了PLGA-R848(PR848)纳米颗粒,并通过静电相互作用吸附在大肠杆菌MG1655表面,构建Ec-PR848纳米颗粒。Ec-PR848与化疗药物Dox结合促进肿瘤细胞的死亡。R848可以将M2巨噬细胞极化为M1巨噬细胞,而DOX诱导免疫原性死亡(immunogenic cell death,ICD)损害肿瘤微环境的免疫抑制。这一策略表明,TAMs重编程联合低剂量化疗药物诱导的ICD可以显著提高肿瘤免疫治疗的疗效。Zhang等[24]设计了靶向M2巨噬细胞的纳米颗粒(PNP@R@M-T),M2pep结合的纳米载体可以用来特异性地将R848输送到M2型巨噬细胞,驱动M2到M1的重编程,并最终激活抗肿瘤免疫(图4)。除了TLR7/8,TLR2也是增强免疫治疗的有效靶点。Wang等[25]的研究表明铁皮石斛多糖可以通过TLR2受体促进其向M1极化,从而显著抑制荷瘤小鼠的肿瘤生长。

图4 PNP@R@M-T 开发用于M2 样巨噬细胞的高效和选择性重编程,并通过M2pep 介导的内吞作用增强癌症免疫治疗的示意图
1.4 靶向干扰素基因途径重编程TAMs
干扰素基因的刺激剂正成为研究的关注热点,但是环状二核苷酸的细胞内递送是亟待解决的问题。Cheng等[26]用脂质体纳米粒子递送cGAMP(cGAMP-NPs),相比于裸的、可溶性cGAMP,cGAMP-NPs更有效地激活干扰素基因。在TME中,cGAMP NPs可以将小鼠和人巨噬细胞从M2巨噬细胞重编程M1巨噬细胞。此外,cGAMP NPs还可以增强MHC和共刺激分子的表达,减少M2型巨噬细胞生物标志物,增加T细胞产生IFN-γ,并进一步诱导肿瘤细胞凋亡。更重要的是,cGAMP-NPs可防止继发性肿瘤的形成,单剂量足以抑制三阴性乳腺癌。
1.5 靶向PI3K途径重编程TAMs
PTEN/PI3K-γ/mTOR信号通路已被证实可控制TAMs的极化。此外,TAMs中的PI3K-γ是在癌症和炎症期间调节免疫反应和抑制之间的关键开关。PI3K-γ/Akt信号通路可抑制NF-κB p65激活,促进肿瘤生长中的免疫抑制[27-28]。因此,选择性抑制PI3K-γ蛋白表达的PI3K-γ小分子抑制剂可以激活并延长NF-κB p65蛋白的表达,从而促进免疫应答,并通过TAMs重编程为促炎型M1型巨噬细胞来重塑TME。在Li等[29]的工作中,研究人员合成了多孔中空氧化铁纳米颗粒(PHNP)来负载PI3K-γ小分子抑制剂3-甲基腺嘌呤(3-methyladenine,3-MA)。PHNP和3-MA联合激活巨噬细胞的炎性因子NF-κB p65,从而将TAM协同转换为促炎性M1型巨噬细胞,在体内激活了肿瘤的免疫反应并抑制肿瘤的生长。
PI3K-γ和集落刺激因子-1 /集落刺激因子-1受体(colony stimulating factor -1/colony stimulating factor-1 receptor,CSF-1/CSF-1R)通路参与包括M2 TAMs在内的免疫抑制细胞的浸润和极化,从而导致抑制性肿瘤胰腺癌的免疫微环境。He等人[30]开发了靶向M2 TAMs的纳米胶束,共同递送PI3K-γ抑制剂NVP-BEZ 235和CSF-1R-siRNA,用于特异TAM的重编程和抗肿瘤免疫应答的激活。在混合胶束上修饰了M2 TAMs靶向肽M2PEP,该胶束有效地共包封了BEZ 235和CSF-1R siRNA。制备的纳米胶束在体外和体内均提高了M2 TAMs靶向效率。与单途径阻滞相比,PI3K-γ和CSF-1R的双重阻滞通过降低M2 TAMs水平和提高M1 TAMs水平显示出增强的TAMs重塑效果,并且还抑制了骨髓来源的抑制细胞的肿瘤浸润。PI3K-γ和CSF-1R的双重抑制可以重塑免疫抑制微环境并协同激活抗肿瘤免疫反应,为胰腺癌治疗提供了另一种方法(图5)。
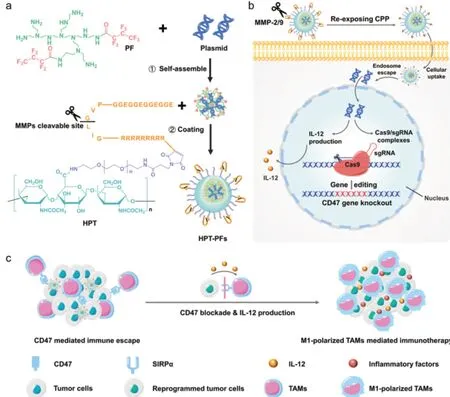
图5 M2PEP-DSPE-PEG 和PEI-SA 共同组成M2 TAMs 靶向纳米胶束
1.6 靶向清道夫受体重编程TAMs
血红蛋白(hemoglobin,Hb)清道夫受体CD163只在M2型巨噬细胞上表达,是M2型TAMs的重要特异性受体。已经证实,Hb可以自发结合血浆触珠蛋白(hemoglobin,Hp),并被表达CD163的M2型巨噬细胞特异性识别并内吞,成为M2型巨噬细胞的潜在特异性结合靶点。Sun等[31]设计了一种蛋白质加冕胶束系统,用于靶向和协同TAMs重编程以增强癌症治疗。载有血红白蛋冠的多柔比星胶束(Hb-doxorubicin-loaded micelles,Hb-DOXM)可与内源性血浆触珠蛋白结合,实现特异性M2型靶向。在肿瘤缺氧和酸性环境下,Hb-DOXM可以响应释放O2和多柔比星(doxorubicin,DOX),通过缺氧缓解减少TAMs的募集,并释放DOX以杀死M2型TAMs和肿瘤细胞。为了充分重编程TAMs,将TAMs调节药物塞来西布进一步封装(Hb-DOXM@Cel)以重新极化M2型TAMs。蛋白冠胶束策略为增强癌症治疗提供了一种靶向和协同重编程TAMs的治疗工具(图6)。
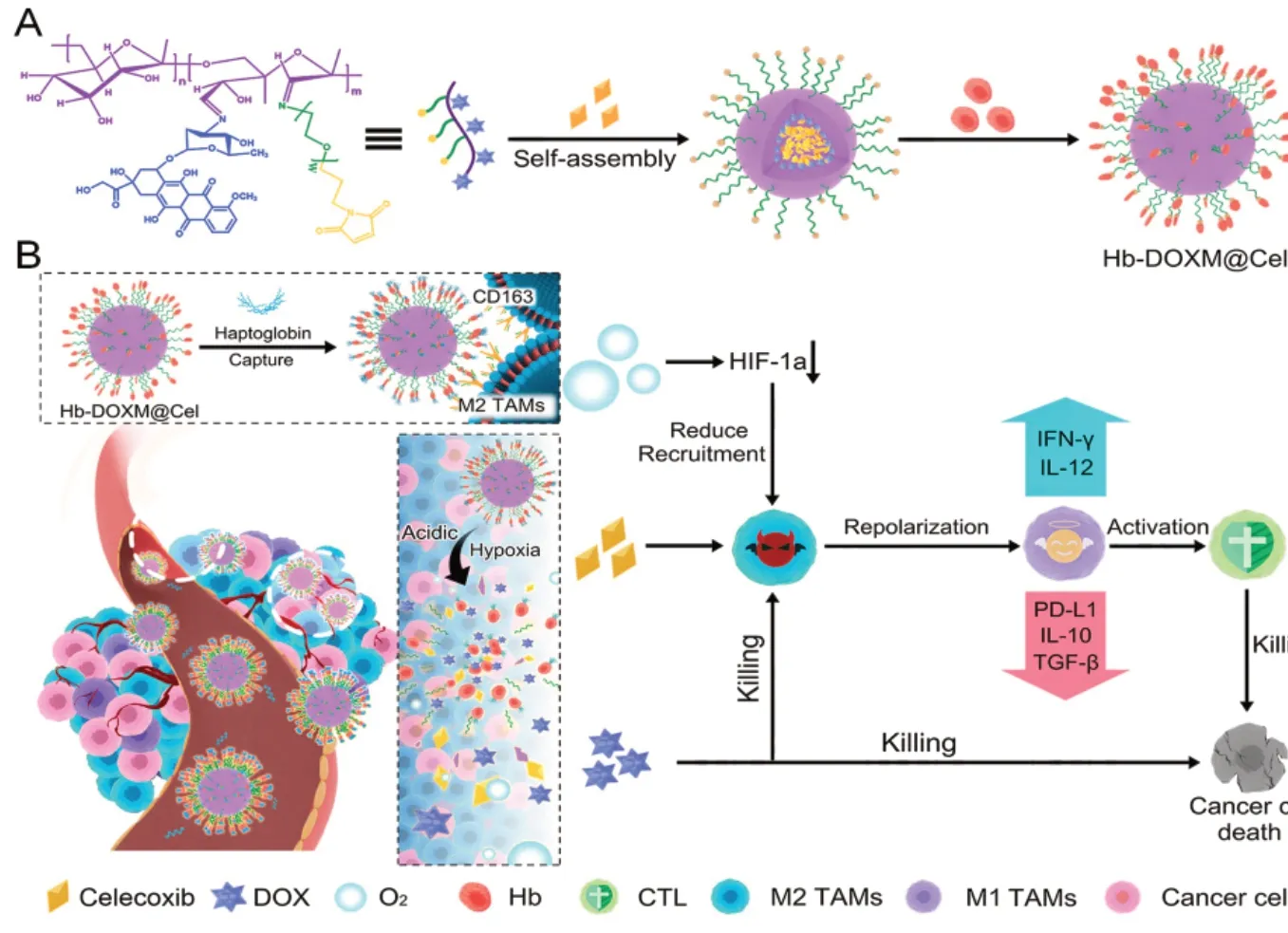
图6 蛋白冠束用于靶向和协同重编程TAMs 以增强癌症治疗的示意图
1.7 靶向CD47受体重编程TAMs
CD47是一种膜结合蛋白,在大多数恶性肿瘤中过度表达。CD47表达“不要吃我”信号,通过与TAMs上的信号调节蛋白α(signal regulatory protein α,SIRP α)相互作用来抑制吞噬。阻断CD47和SIRPα相互作用的治疗策略在肿瘤治疗中显示出有效性。Lin等人设计了一种名为HPF-PFs的选择性响应基因递送系统[32],该系统用HA和肿瘤微环境敏感肽TMSP进行双重修饰,以同时递送用于CD47敲除和IL-12产生的质粒。在黑色素瘤小鼠模型中,观察到M1巨噬细胞的急剧升高和炎性细胞因子的分泌,显著抑制肿瘤生长(图7)。而Chen等[33]人提出了一种基质金属蛋白酶2(matrix metalloprotease 2,MMP2)响应性综合免疫化疗策略,通过可拆卸的方式递送紫杉和抗CD47免疫脂质体。在三阴性乳腺癌微环境中,“二合一”免疫脂质体促进了MMP2响应性抗CD47的释放,从而有效地将M2巨噬细胞极化为M1表型,以增强对肿瘤细胞的吞噬作用并激活全身性T细胞免疫反应。
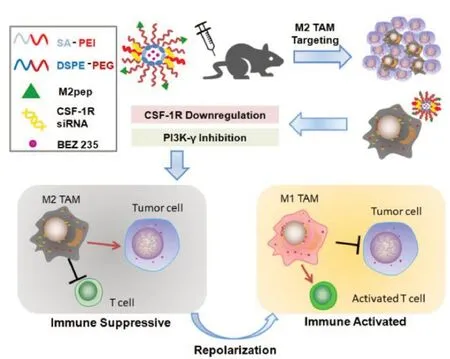
图7 基于CRISPR 的原位工程肿瘤细胞重编程巨噬细胞实现有效的癌症免疫治疗的示意图
1.8 通过调节转录因子重编程TAMs
巨噬细胞的重编程可以由多种转录因子调节。例如,STAT1和STAT5途径可以驱动M1极化,而STAT3和STAT6有助于向M2极化。辛伐他汀,一种常用的胆固醇降低剂,可以破坏细胞膜中富含胆固醇的脂筏,从而调节多种信号通路包括STAT6通路,促进向M1型巨噬细胞极化。在此基础上,Huang等人发现,负载辛伐他汀的纳米颗粒或脂质体可以有效地将TAMs重编程为M1型,并在几种肿瘤模型中显示出有效的抗肿瘤效果。他们开发了一种含有辛伐他汀和紫杉醇可激活莱珠单抗地脂质体,有效地促进了TAMs向M1巨噬细胞的重编程,辛伐他汀和紫杉醇协同重塑TME和治疗耐药的A549/T非小细胞肺癌(non-small cell lung cancer,NSCLC)模型[34]。吉非替尼是临床上治疗表皮生长因子受体(epidermal growth factor receptor,EGFR)突变的NSCLC的一线药物,但是约50%的癌症患者出现获得性耐药。考虑到TAMs与耐药性之间的关联,他们还开发了一种程序性死亡配体1(programmed cell death ligand 1,PDL1)修饰脂质体,并负载辛伐他汀和吉非替尼,以使TAMs向M1巨噬细胞复极,并克服NSCLC模型中EGFRT790M突变相关的耐药性,这为克服分子靶向药物的获得性耐药性提高了TAMs重编程策略[35]。
1.9 靶向递送核酸重编程TAMs
MicroRNA是一种小的非编码RNA,具有调节基因表达的能力,是巨噬细胞极化的关键调节因子。miR-9、miR-127、miR-155和miR-125b与M1极化相关,而miR-124、miR-223、miR-34a、miR-132和miR-146a通过靶向各种转录因子和衔接蛋白诱导M2极化。文献指出,增加巨噬细胞中miR-125b或miR-155的表达有望促进M1极化,并调节巨噬细胞活化,用于癌症免疫治疗。MiR-155水平的增加可以显著抑制CCAAT/增强结合蛋白(C/EBPβ)信号通路,从而促进TAMs向M1型巨噬细胞极化。miR-125b的过度表达可以促进TAMs分泌IFN-γ,IFN-γ可以通过降低IFN-4的表达并进一步影响STAT6通路来诱导TAMs向M1型巨噬细胞极化。Ma等人设计了一种负载miR-155的sPEG/HLC纳米载体[36],其有效促进了miR-155的巨噬细胞靶向递送,并增加了TAM中miR-155的表达,约100~400倍。该纳米复合物还有效地将M1巨噬细胞的标记物增加两倍,将M2巨噬细胞的标记物减少了40%~80%,还增加了肿瘤中活化的T淋巴细胞和NK细胞,有效地抑制了肿瘤生长。Amiji等[37]设计了一种HA连接的聚(乙烯亚胺)(HA-PEI)来封装miR-125b,以形成巨噬细胞靶向的HAPEI/miR-125b纳米复合物,该复合物可以增强巨噬细胞中miR-125b的表达,以调节巨噬细胞的活化。腹腔内给药后,HA-PEI/miR-125b纳米复合物优先在NSCLC模型的TAMs中积累,并导致TAMs中M1与M2巨噬细胞比率增加6倍以上,诱导型一氧化氮合酶(iNOS)/精氨酸-1(Arg-1)比率增加300倍,从而导致TAMs成功地向M1巨噬细胞极化,用于肿瘤的免疫治疗(图8)。
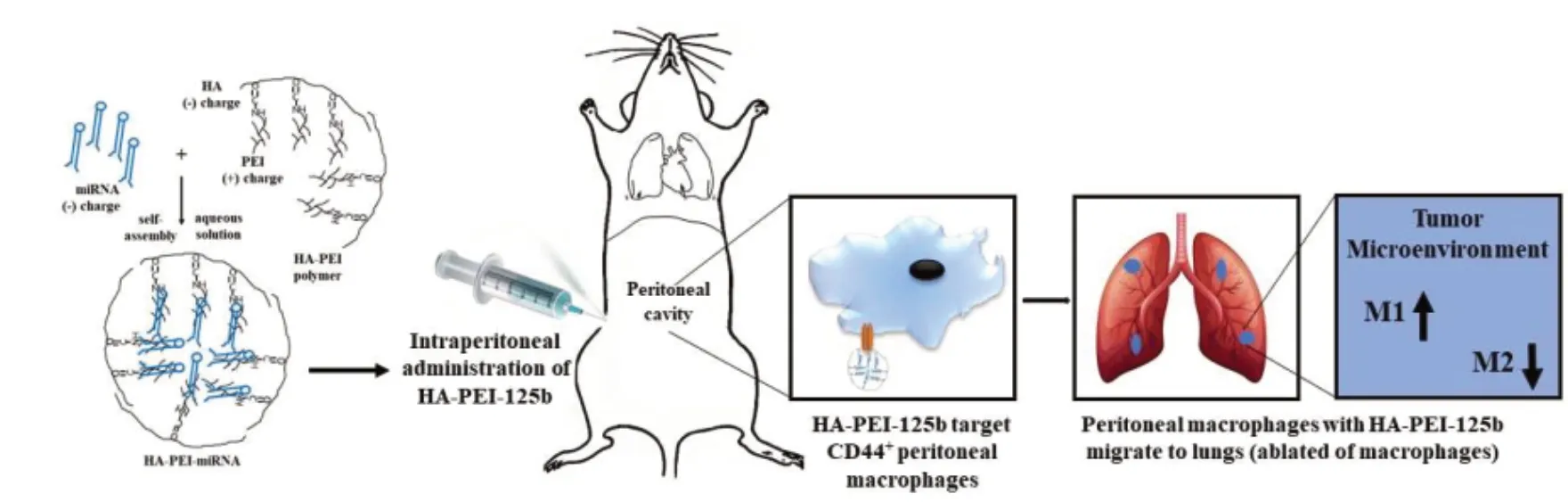
图8 透明质酸聚(乙烯亚胺)(HA-PEI)-miR-125b 腹腔注射示意图
siRNA是一种强有力的分子工具,可以在基因治疗领域中敲除特定的基因表达。它通过在RNA干扰途径内转录后降解mRNA,干扰具有互补核苷酸序列的特定基因的表达。Qian等[38]利用核酸逐步自组装制备了一种高效的siRNA和胞嘧啶核苷寡核苷酸(CpG ODNs)递送系统(CpG siRNA tRNA)。CpG siRNA tRNA有效地将TAMs重编程为M1巨噬细胞,增加促炎细胞因子分泌和NF-κB信号通路激活,从而触发显著的抗肿瘤免疫反应(图9)。
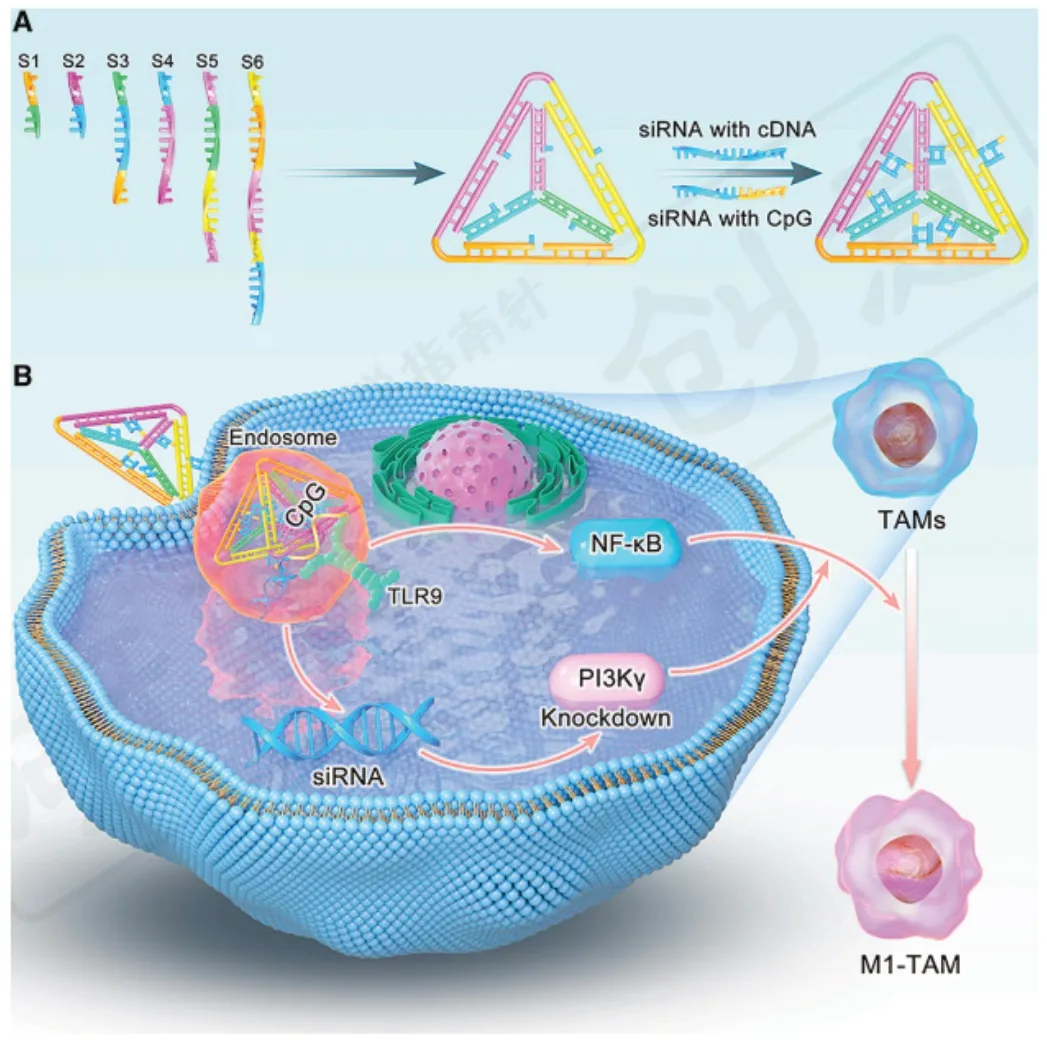
图9 CpG-siRNA tFNA 用于肿瘤免疫治疗的示意图
2 纳米药物介导的异常TME 调节的间接重编程
肿瘤细胞消耗大量的葡萄糖和氧气用于支持其快速生长,导致了肿瘤中的弱酸性和缺氧微环境。乳酸是肿瘤葡萄糖代谢的主要产物,是促使巨噬细胞重编程为M2表型的重要因素。同时,肿瘤区域的乏氧状态有助于巨噬细胞的募集和极化,乏氧肿瘤区域中浸润的巨噬细胞将迅速极化为M2型巨噬细胞,以抑制免疫反应,促进肿瘤进展和转移[39]。因此,纳米药物调节TME的酸性、增加ROS水平和缓解乏氧状态是另一种将M2样巨噬细胞重编程为M1型巨噬细胞的可行的策略。
2.1 纳米药物调节酸性TME
乳酸是肿瘤中葡萄糖的代谢产物,是酸性TME的主要贡献者[40]。抑制葡萄糖代谢和乳酸生成将有利于TAMs向M1型重编程,以增强免疫治疗。紫草素通过多种机制表现出潜在的抗癌活性,包括诱导ICD效应和抑制葡萄糖代谢。Huang及其同事[41]设计了一种甘露糖化乳铁蛋白纳米颗粒(Man-LF NPs),该纳米颗粒负载紫草素和JQ1(PD-L1的抑制剂),通过与甘露糖受体和TAMs表面的低密度脂蛋白受体相关蛋白1的特异性相互作用,靶向癌细胞和TAMs。Man-LF NPs可以有效地诱导肿瘤细胞发生ICD效应,减少乳酸产生,并导致肿瘤中M1/M2比率增加1.5倍。Man-LF NPs通过促进DC成熟、增加CD8+T细胞浸润和减少PD-L1表达激活抗肿瘤免疫反应,对CT26结肠肿瘤模型的肿瘤生长表现出协同治疗的作用。
2.2 纳米药物诱导ROS
ROS(Reactive Oxygen Species)是含氧的化学反应性化学物质,包括超氧阴离子(O2-)、羟基自由基(OH.)和过氧化氢(H2O2)。ROS在控制信号转导途径中起着至关重要的作用,并在巨噬细胞极化和活化中起着重要的调节作用,但是ROS对巨噬细胞极化的确切作用尚不清楚[42-43]。ROS的产生可介导促炎细胞因子的产生并激活NF-κB通路,随后促进p65 NF-κB磷酸化以诱导M1重编程。在此基础上,增加TME中ROS的产生可能是促进TAMs向M1巨噬细胞重编程以增强抗肿瘤免疫的一种有前途的方法。FDA批准的铁补充剂纳米颗粒,平均粒径约为30 nm的氧化铁对早期乳腺癌的生长和肺转移扩散有治疗作用。氧化铁纳米颗粒可以通过Fenton反应催化ROS的形成,H2O2增加11倍,OH.增加16倍,从而诱导TAMs向抗肿瘤M1型巨噬细胞极化[44]。
负载光敏剂的纳米颗粒在激光照射下可产生1O2,在巨噬细胞重编程和癌症免疫治疗方面具有巨大潜力。Chen及其同事[45]设计了一种甘露糖修饰的聚乙二醇化聚乳糖(MANPEG-PLGA)纳米颗粒,其负载吲哚菁绿、碳酸氢胺和二氧化钛,用于TAMs的靶向递送(图10)。这种纳米颗粒系统在激光照射后介导ROS生成,成功地将TAMs重新编程为抗肿瘤M1表型,其效率优于常用的脂多糖刺激模型,iNOS+ iL-12+巨噬细胞(M1)的百分比明显从20%增加到40%以上,而CD206+ IL-10+巨噬细胞(M2)的百分比明显从60%减少到20%左右,这表明M2样TAMs的有效重编程。重新编程的巨噬细胞有效地协调了TME中的CTL募集,并促进记忆T细胞对肿瘤的杀伤反应,从而消除肿瘤进展、转移和复发,实现有效的癌症免疫治疗。

图10 基于纳米颗粒光产生的ROS 的TAM 定向癌症免疫治疗示意图
同时,Cai和同事[46]开发了一种半乳糖功能化锌原卟啉IX(ZnPP)接枝多肽胶束,负载聚(I:C)以靶向TAMs,并诱导ROS生成,以协同TAMs向M1巨噬细胞复极化,从而提高TME中活化的NK细胞和T淋巴细胞,用于黑色素瘤的有效免疫治疗。
2.3 纳米药物缓解肿瘤缺氧
肿瘤中的缺氧环境是促进浸润巨噬细胞向M2样TAMs极化的关键因素,其特点是组织氧水平低,H2O2水平高[47]。缓解TME中的缺氧将有可能将TAMs逆转为M1型巨噬细胞,用于癌症免疫治疗。Liu及其同事[48]使用双乳化法开发了核壳PLGA纳米颗粒,该纳米颗粒在核内装载水溶性过氧化氢酶,在壳内装载疏水性R837佐剂。负载过氧化氢酶的PLGA纳米颗粒可以快速分解H2O2以生成O2,以缓解CT26肿瘤组织中的缺氧区域,从而降低TME中的IL-10并增加IL-12,以促进TAM向M1表型极化。负载过氧化氢酶的PLGA纳米颗粒显著地将TME中的M2样TAMs从32.8%降低到14.8%。放疗后,过氧化氢酶和R837负载的PLGA纳米颗粒将诱导广泛的ICD,并引发强烈的抗肿瘤免疫反应,以协同CTL相关蛋白4阻断,从而抑制肿瘤转移并通过长期免疫效应防止肿瘤复发。
Kong及其同事[49]设计了基于壳聚糖/葡聚糖的原位注射纳米复合水凝胶通过缺氧缓解和TAMs重编程结合用于肿瘤治疗。透明质酸修饰的载有绿原酸的传递体通过CD44介导的内化作用将M2型逆转为M1型,药物和过氧化氢酶被包裹在基于Schiff的交联可注射水凝胶(由羧甲基壳聚糖和氧化葡聚糖制成)中,过氧化氢酶能够将TME中的过氧化氢转化为溶解氧并缓解肿瘤缺氧,多功能纳米复合可注射水凝胶通过缓解缺氧和TAMs极性调节的协同作用有效抑制肿瘤生长(图11)。
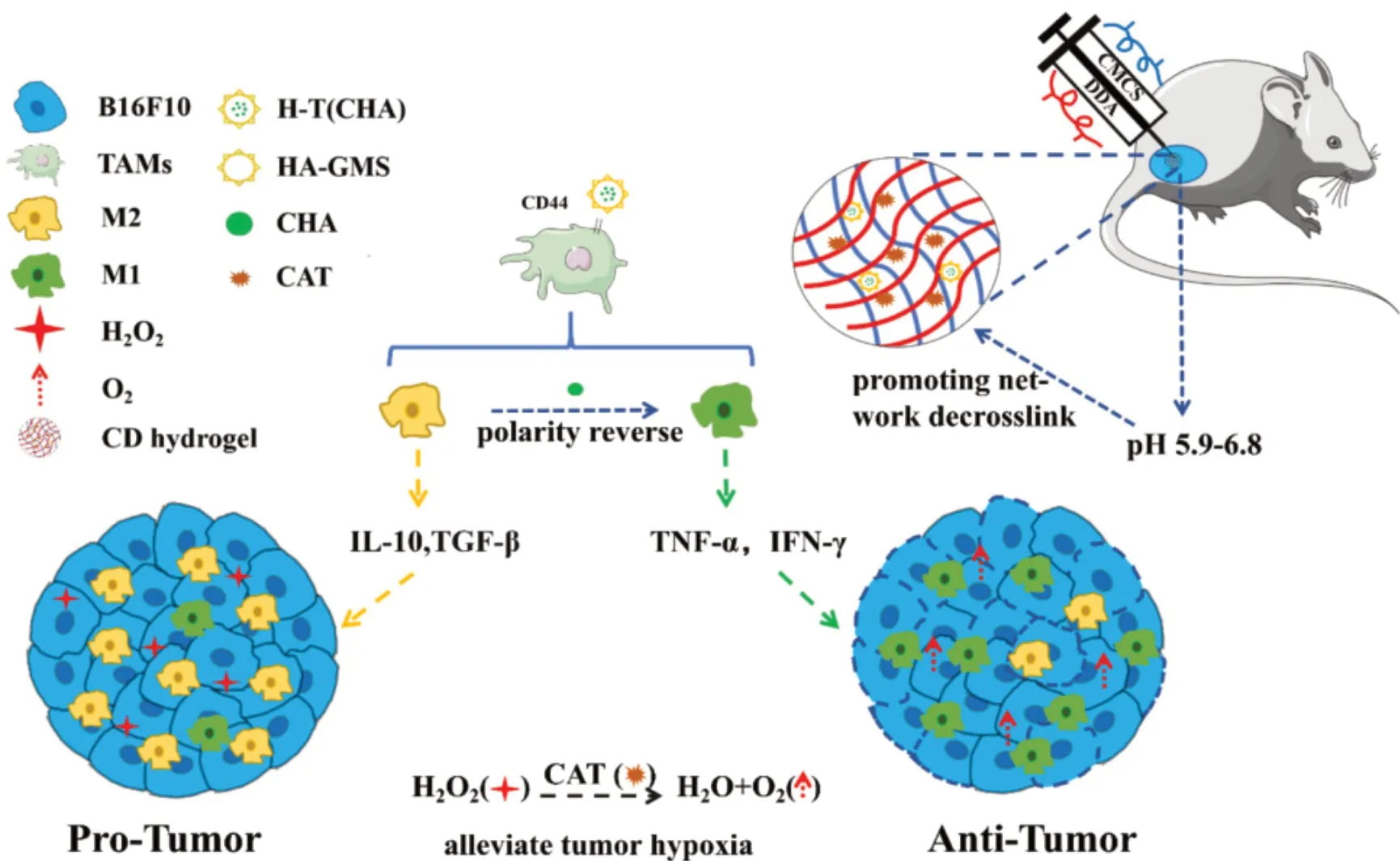
图11 原位注射纳米复合物水凝胶[CD@CAT/H-T(CHA)]调节TAMs 极性及减轻TME 缺氧的原理图
3 总结与展望
综上,本文系统总结了纳米药物重编程肿瘤相关巨噬细胞增强抗肿瘤的主要策略和重要进展。纳米药物可通过TAMs靶向递送各种活性物质进行重编程和纳米药物介导的异常TME调节的间接重编程两种方式有效地实现对巨噬细胞功能的调控,更好地提高抗肿瘤疗效。
到目前为止,已经开发了许多基于TAMs的纳米药物递送系统,它们的材料、制备方法和治疗机制各不相同。尽管我们试图根据TAMs相关的纳米药物的作用对其进行分类,但是大多数纳米治疗系统具有多种功能,很难清楚地区分其机制。
总之,TAMs在肿瘤的发生、发展和转移中起着重要作用。到目前为止,各种类型的基于TAMs的抗癌纳米药物都有各自的优点和缺点。因此,在未来,应该更加重视结合不同方法的优点来开发新的纳米递送系统,以获得更好的抗肿瘤效果。此外基于TAMs的纳米药物将通过增强稳定性、改善药代动力学特性、提高选择性、促进细胞内递送和减轻全身毒性,成为一种有前途的肿瘤治疗方法。

