电子束对体外培养的细粒棘球蚴及其p38 mRNA 表达的影响
杨丽萍 路鹏霏 周 钦 古丽米来·玉素甫 吾日古丽·巴吾东 毛 睿
新疆医科大学第一附属医院肿瘤中心(乌鲁木齐 830000)
棘球蚴病俗称包虫病,是由棘球蚴绦虫的中绦期幼虫寄生于人体及其余动物所引起的一种人畜共患性疾病[1]。据估计因棘球蚴病导致全球畜牧业每年损失约20亿美元,人类因棘球蚴病的死亡率为2%~4%[2]。手术是治疗细粒棘球蚴病的首选方法,但术后复发率极高。近几年,国内外对甲苯达唑、阿苯达唑[3]等药物的治疗疗效、药理学等方面都做了深入的研究[4-6]。其临床疗效不甚理想,治愈率只有30%。因外科手术清除难度大、高复发率及药物疗效欠佳,对于棘球蚴病的治疗仍需寻求新的方式。目前已证实放射治疗对棘球蚴有明显的杀伤作用,且放射疗法的安全性相对较高,并有独特的形态学和结构组织的改变[7-9]。
放射治疗主要分为外照射和近距离放射治疗两种技术,外照射包括低能X线、电子束,有研究证实X线对棘球蚴病的治疗有效[10],由于电子束对较表浅组织的照射有更高的控制率,有更好的剂量分布,且目前暂无电子束照射棘球蚴的相关研究,所以本研究采用电子束进行实验。有研究发现,在细粒棘球蚴原头蚴中有相应的p38基因信号通路,p38基因是由Brewster等[11]研究发现,它与寄生虫的生长、繁殖信号传递过程密切相关[12-16],且在棘球蚴中较高表达[17-20],已有结论证实p38抑制剂可抑制体外培养的棘球蚴生长[21-22],Gelmedin等提到[23]应用基因抑制剂处理,可将体外培养的棘球蚴的p38基因信号通路阻断,并使虫体死亡率明显升高;Schiff 等[24]发现p38的基因有助于放疗后的细胞修复,证实p38基因可能会减弱放疗疗效。本研究通过电子束照射棘球蚴,观察虫体大体结构、死亡率的变化并检测其中p38基因的表达情况,进一步了解电子束对于棘球蚴的杀伤作用及p38基因在其中的作用机制,以期探索包虫病潜在治疗靶点,提供新的治疗路径。
1 材料与方法
1.1 棘球蚴来源
本研究用于体外培养的棘球蚴来自自然感染棘球蚴的绵羊肝脏,由新疆维吾尔自治区乌鲁木齐市畜牧站提供。研究方案通过新疆医科大学实验动物伦理审查(伦理学审批号:IACUC-20141021002)。
1.2 主要试剂
磷酸盐缓冲液(PBS);培养'基:RPMI 1640培养基、含有100 U/mL的青霉素及100 µg/mL链霉素的双抗、胎牛血清;含有1%胃蛋白酶的消化液;0.1%的亚甲基蓝染色剂;Trizol;氯仿;异丙醇;DEPC水;无水乙醇等。
1.3 原头蚴分离
抽取羊肝包囊内液体至50 mL培养管中,将棘球蚴沉淀置于消化液中,并于37 ℃水浴30 min,每隔5 min观察消化情况,无明显可见囊皮,停止胃蛋白酶消化过程,消化完毕后检测原头蚴的活性。
1.4 原头蚴活性观察及计数
吸取1 µL虫体至EP管中,进行染色,用PBS冲洗染液,用光镜观察原头蚴活性、数量等,重复4~5次得均值,以此估算虫体总数。
1.5 原头蚴体外培养
将含有胎牛血清、RPMI 1640培养基、100 IU/mL的青链霉素双抗的培养液稀释细粒棘球蚴原头蚴至2 000粒/mL,移置于培养瓶中,共分为同等的3瓶,在37 ℃、含有5% CO2的培养箱中培养,需每2~3天更换一次更换培养液,注意实验开始前,细粒棘球蚴原头蚴的培养时间不宜超过3 d。
1.6 原头蚴电子束照射
用0 Gy、30 Gy、60 Gy的6 兆电子束(6 MeV)分别对各分组培养瓶进行1次放射,将放射后的培养瓶继续放置于培养箱中连续培养3 d、14 d,以上实验步骤共进行3~4次的重复实验。
1.7 原头蚴RNA的提取
准备实验所需试剂及实验设备,按照RNA提取步骤进行RNA的提取。
1.8 逆转录、qRT-PCR及检测原头蚴p38基因表达
mRNA的逆转录合成cDNA:按照TaKaRa公司的反转录试剂盒进行逆转录操作;进行qRT-PCR反应,引物序列见表2。
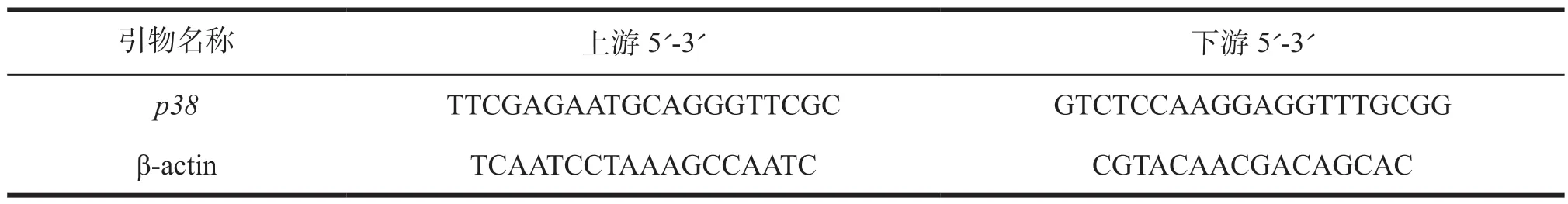
表2 p38 基因qRT-PCR引物序列信息
用cDNA作为模板,按照德国QIAGEN公司的QuantiNova SYBR Green PCR Kit(Perfect Real Time)说明书进行操作,测定p38 基因的表达,并以β-actin作为内参,反应体系为20 µL,见表3。

表3 p38基因qRT-PCR反应体系
每个样本设置三个重复实验,包括 1 次阴性对照,反应条件按照说明书进行设置。计算过程:选择每个孔的Ct值,依照相对定量公式 2-△△Ct,即△Ct=Ct(p38)-Ct(β-actin),△△Ct=△Ct(实验组)-△Ct(对照组),统计分析选择单因素方差分析,得出p38基因的mRNA 相对表达量。
1.9 统计学分析
采用Prism 8.0与SPSS 26.0统计软件,所有实验需要包含不得少于3次的重复实验,数据表示为均值±标准差(±s),虫体死亡率的比较采用χ2检验,qRT-PCR测得mRNA表达量的比较采用方差分析和SNK法进行两两比较,P<0.05为差异有统计学意义。
2 结 果
2.1 电子束照射对原头蚴的状态及形态结构的影响
相同剂量电子束照射的虫体结构在不同天数(3 d、14 d)时无明显差异,0 Gy组虫体活性基本正常,形态结果未见明显改变;30 Gy照射剂量分组中部分虫体活力减弱,育囊减少,部分囊壁变薄、塌陷;60 Gy照射剂量分组中虫体体积缩小明显,正常形态消失,多呈不规则球形、勾突脱离、头节裂解、吸盘扭曲(见图1)。
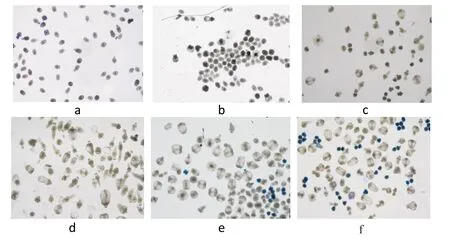
图1 光镜下观察各组细粒棘球蚴原头节形态结构
2.2 电子束照射对原头蚴死亡率的影响
经卡方检验证实部分分组死亡率有统计学意义(P<0.05),对以上实验数据进行两两比较,见表1。
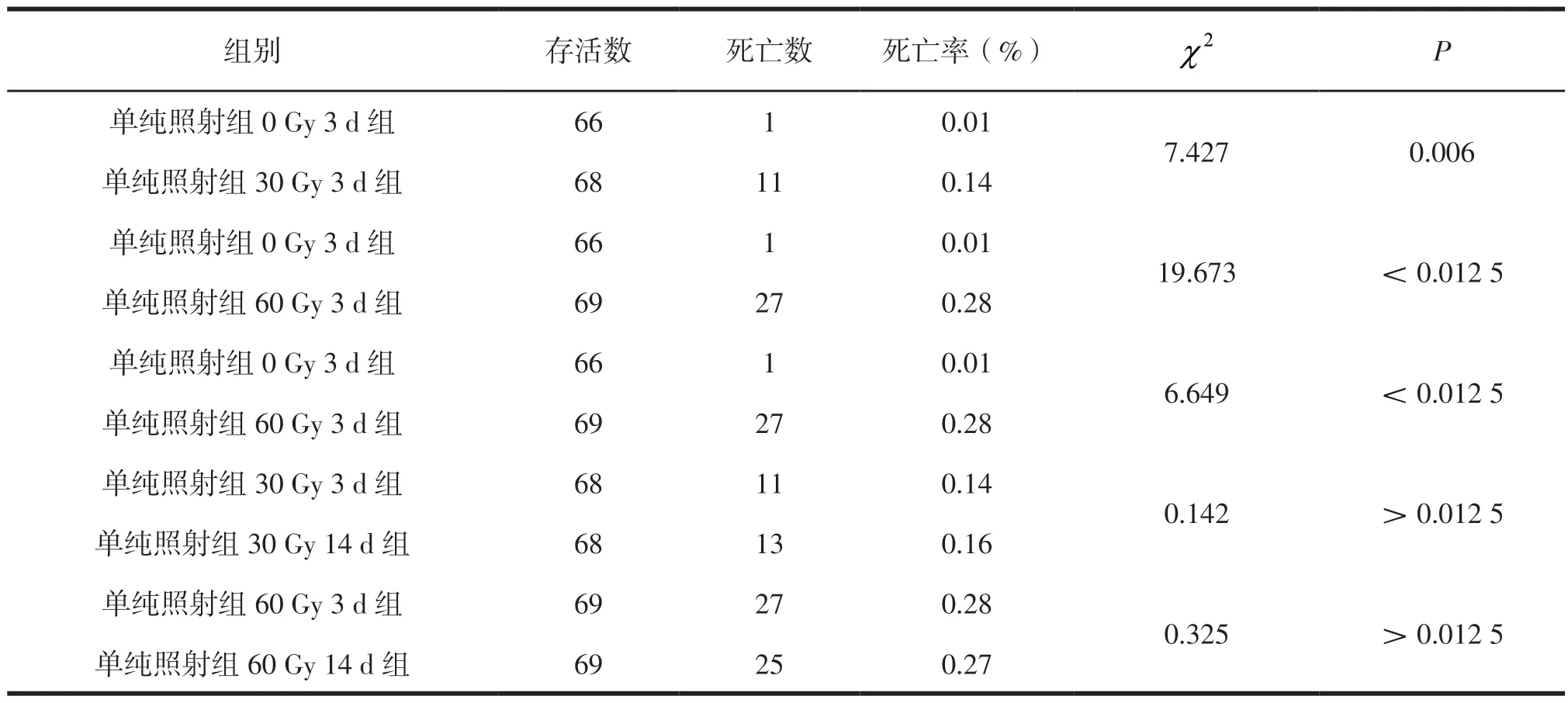
表1 单纯照射组细粒棘球蚴原头节死亡率差异情况
培养3 d、14 d时0 Gy组30 Gy、60 Gy组细粒棘球蚴原头节的死亡率有差异(P<0.012 5);30 Gy与60 Gy组的细粒棘球蚴原头节死亡率也有差异(P<0.012 5);相同照射剂量下培养3 d与培养14 d时的死亡率未见差异(P>0.012 5)。
2.3 电子束照射对原头蚴p38 mRNA表达的影响
经qRT-PCR检测,在照射组细粒棘球蚴原头蚴中的60 Gy组培养3 d时p38 mRNA表达其相对表达为:31.05±0.30,60 Gy组培养14 d时p38 mRNA表达其相对表达为:32.11±0.32,本研究证实照射组细粒棘球蚴原头蚴中的电子束剂量为60 Gy组的p38mRNA的相对表达水平高于0 Gy及30 Gy组的相对表达水平(P <0.05),且培养3 d与14 d无差异(P>0.05)。见图2。
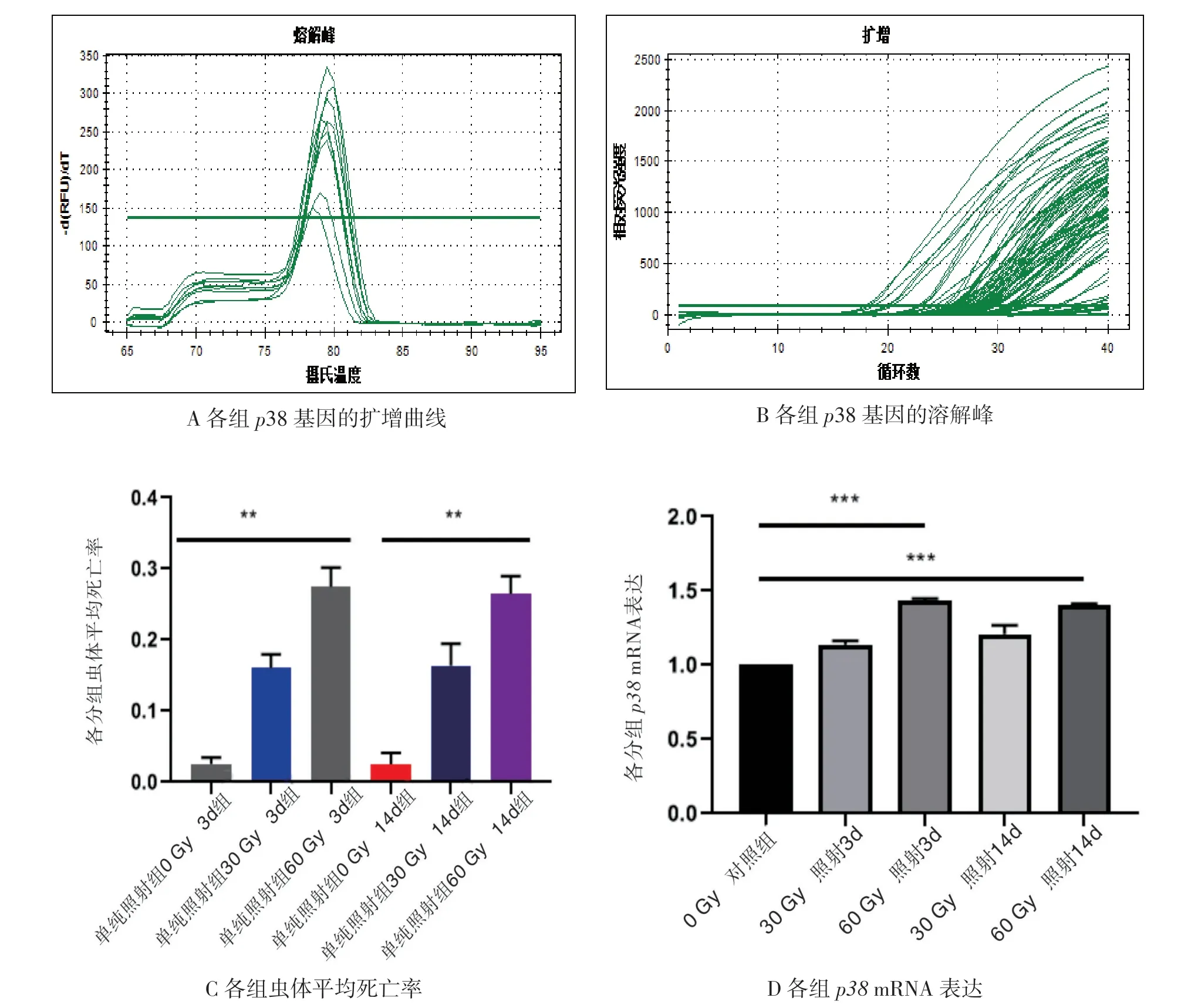
图2 各组细粒棘球蚴原头节经照射后qRT-PCR 测得mRNA 表达结果与平均死亡率对照
3 讨 论
棘球蚴病是一种全球流行的动物源性寄生虫病[25],寄生于人及某些动物等中间宿主中引起囊性棘球蚴病,如果不及时治疗,90%的病例会在诊断后10~15年内死亡[26]。全世界每年估计有超过18 000例新病例,其中91%发生在中国[27]。棘球蚴病的治疗选择很少,手术治疗主要在感染的早期阶段,可进行预防性抗寄生虫药物治疗[28],外科手术及新型药物治疗都已经有了极大的突破[29],但外科手术后的高复发率未得到有效解决,药物治疗中的耐药机制的产生还未明确,因此我们对于细粒棘球蚴病的治疗还在探寻更多、更新的治疗方式。
本研究显示,照射组在相同照射剂量下的连续培养3 d、14 d虫体结构无明显差异,0 Gy组虫体形态饱满,勾突、头节、吸盘清晰可见,大部分有活动性且不被蓝染着色;30 Gy照射剂量分组表现为部分虫体正常形态消失,部分蓝染,活力减弱,育囊减少,部分囊壁变薄、塌陷、曲折断裂;60 Gy照射剂量分组中镜下观察发现蓝染着色细胞布满大部分视野,虫体正常形态消失,体积缩小明显呈不规则球形、吸盘扭曲、头节裂解,勾突脱离,棘球蚴囊壁可见毛刺状破裂、塌陷,观察60 Gy照射剂量分组中细粒棘球蚴原头蚴细胞质散乱,肿胀变粗、拥挤。由此证实照射剂量为30 Gy、60 Gy的电子束对细粒棘球蚴原头蚴均有杀伤作用,但60 Gy组杀伤作用更加明显,而照射后培养天数的延长并不会影响虫体死亡率的变化。
本研究发现,p38基因在受电子束照射的细粒棘球蚴原头蚴中呈不同程度的表达水平,通过qRT-PCR检测证实p38基因在60 Gy照射剂量分组中的相对表达水平高于0 Gy组及30 Gy组的相对表达水平,表明照射剂量的不同可能影响p38基因的表达变化。p38基因存在于所有真核生物中,其结构和调控特征从微生物到人类都是保守的,与其他MAPK 家族成员不同,p38基因通常不主动进行有丝分裂,而是被细胞异常微环境及炎症信号激活,其编码的蛋白质将信号从细胞膜传递到细胞核,以响应各种外源性和内源性刺激[30]。这与细粒棘球蚴接受电子束照射刺激后引起p38基因不同程度表达的理论相一致。p38基因信号通路的传导引起相关通路的负反馈调节,可以起到抑制放射线诱导细胞凋亡的作用[31]。本研究显示经电子束的照射使虫体的死亡率升高、p38基因的表达增加,但p38基因的放疗抑制作用可能不足以完全抵抗电子束对虫体的杀伤作用,从而使电子束引起虫体的生长阻滞,从而促进了棘球蚴虫体的死亡,并且在60 Gy照射剂量下虫体死亡率最高、p38基因的表达最高,这也为后期包虫病的放射治疗的剂量选择提供一定的理论参考。
综上所述,电子束治疗包虫病的研究目前仍处于初级阶段,后期将进一步从机制出发,深入研究电子束致棘球蚴中p38基因信号通路调控变化的作用机制,为包虫病的放射治疗提供更多的实验数据与理论支持。

