推拿对CCI模型大鼠海马CaMKⅡ和SYP蛋白表达的影响*
黄红叶,林志刚,陈水金,陈乐春,张幻真,陈进城,蒋晶晶,江 煜,王晓华,方佳钰
(1.福建中医药大学,福建 福州 350122;2.福建中医药大学附属康复医院,福建 福州 350003;3.福建省康复技术重点实验室,福建 福州 350003)
神经病理性疼痛是一种复杂的慢性疼痛,由中枢或周围神经系统的损伤或功能障碍引起[1]。行为学上,它的特征是异常的自发性疼痛,疼痛知觉的改变,以及刺激诱发的异常疼痛症状,已造成巨大的社会和经济负担[2]。临床与动物研究均发现推拿可显著缓解神经病理性疼痛,但镇痛机制尚不明确[3-4]。
钙调蛋白激酶Ⅱ(calmodulin dependent protein kinase II,CaMKⅡ)是一种丝氨酸/苏氨酸磷酸化蛋白激酶,参与疼痛中枢敏化,对神经元可塑性有重要意义[5]。突触素(synaptophysin,SYP)表达于突触囊泡膜,参与了突触的形成与调节,在神经病理性疼痛发生发展中起重要作用[6]。CaMKⅡ和SYP 是突触相关蛋白,其在神经病理性疼痛大鼠脊髓背角中的表达增加[7-8],在海马中降低[9-10],提示神经病理性疼痛的发生可能与脊髓背角和海马的突触可塑性的改变有关。我们前期研究发现推拿能够抑制脊髓背角突触可塑性[11],基于此,本研究通过观察推拿手法对CCI大鼠海马神经元及突触相关蛋白CaMKⅡ与SYP 的表达,探讨推拿手法的镇痛机制。
1 材料与方法
1.1 实验动物与分组 取32 只体质量180-200g,成年雄性SD 大鼠,由福建中医药大学实验动物中心提供,动物许可证号:SCXK(沪)2017-0005。正式实验前适应性喂养1周后,随机分为空白组、假手术组、模型组、推拿组,每组8只。
1.2 实验试剂与器材 大鼠固定器(专利号:201821139321.X)、自制推拿按摩指套(专利号:ZL201821318407.9)、HE 染色试剂盒(索莱宝)、兔多克隆抗体CAMKⅡ(proteintech)、兔多克隆抗体Syn‐aptophysin(proteintech)、GAPDH 内参(proteintech)、488 绿色荧光二抗(proteintech)、HRP 标记抗兔二抗(proteintech)、BCA 蛋白定量试剂盒(博士德)、SDSPAGE 凝胶制备试剂盒(博士德)、蛋白质常规分子量标(proteintech)、ECL 超敏化学发光检测试剂盒(百赛生物)、抗荧光淬灭封片液(碧云天)、ImageLab 图像分析系统,ImageJ图像处理软件。
1.3 造模方法 根据Bennett和Xie[12]方法制备坐骨神经慢性压迫性损伤(Chronic Constriction Injury,CCI) 大鼠模型。用1%戊巴比妥钠(40 mg/kg,i.p.)麻醉大鼠后,暴露大鼠右大腿坐骨神经,使用4-0 铬制羊肠线结扎坐骨神经,结扎4 道,每道间隔1.0-1.5mm,以观察到大鼠后肢肌肉轻微抽动为宜。空白组不做任何处理,假手术组大鼠仅暴露右坐骨神经,不结扎。
1.4 推拿干预 手法操作前先将大鼠置于推拿操作固定装置5min,适应环境。操作时,用右手拇指对大鼠右后肢委中穴进行推拿按揉法操作。手法选择:按揉法为临床常用治疗手法,对于疼痛有明显缓解作用。依据前期预实验经验,自制推拿按摩指套(专利号:ZL201821318407.9)最佳手法频率为30 次/分钟,力量约4-6N,持续10 分钟。穴位选择:由于“委中穴”所在位置为大鼠股二头肌,此处肌肉较为丰满,便于进行按揉手法操作;此外,由大鼠腰膨大发出的脊神经根穿出椎间孔后向下组成坐骨神经,支配股二头肌,因此我们选取右后肢“委中穴”进行推拿按揉治疗,可使推拿起到较好治疗作用。推拿治疗从术后第4天开始,每日1次,连续14天。
1.5 观察指标
1.5.1 机械足反射阈值(PWT)参照Chaplan[13]的研究,每只大鼠被放入有钢丝网底部的有机玻璃盒子中,以适应周围环境30 分钟。使用不同等级的Von-Frey 纤毛刺激大鼠右后爪足底表面,由低等级逐级向高等级测试,引起大鼠出现缩足、舔脚等反应时的刺激强度定义为机械足反射阈值(PWT)。分别在术前1 天、术后第4、10、14 和18 天观察各组大鼠PWT改变。
1.5.2 HE 染色 推拿干预14 天后,每组取4 只大鼠,麻醉后灌流固定,取出大鼠全脑,置于4%多聚甲醛中固定48h,经脱水、包埋、切片和置片程序备好石蜡切片。取海马区域的石蜡切片,经梯度酒精脱水,苏木素染色5min,流水冲洗3min,盐酸酒精分化2s,伊红染色30s,流水冲洗5min 后中性树脂封片。400 倍镜下观察左侧海马神经元形态,染色结果为细胞核蓝色,细胞质红色。
1.5.3 免疫荧光染色 海马石蜡切片梯度酒精脱水,放入煮沸的EDTA 修复液中高温修复2h。经PBS 洗涤,加入0.3%Triton 穿透10min,再加入BSA 封闭液,37℃烘箱封闭1h。加入CaMKⅡ抗体(1∶200)4℃过夜。第二天经PBS 洗涤后加入488 标记的驴抗兔IgG(二抗,1:500)37℃烘箱避光孵育2h。PBS 洗涤后,使用抗荧光淬灭封片液封片。200倍镜下以左侧海马为观察部位,在相同条件下,拍照采集图片。用ImageJ 图像分析软件对CaMKⅡ免疫荧光图片进行分析,计算CaMKⅡ平均光密度。
1.5.4 Western Blot 推拿干预14 天后每组取4 只大鼠,麻醉后断头处死,迅速取出左侧海马放入EP 管中,-80℃冰箱保存。称重后加入相应裂解液,离心取上清液。BCA 法测定蛋白浓度,样品用12%凝胶浓度进行SDS-PAGE 凝胶电泳,转膜至PVDF 膜、牛奶封闭1h,加入SYP 抗体(1:1000)摇床4℃过夜。TBST 洗涤后加入二抗(驴抗兔IgG,1:5000),室温摇床2h。PVDF 膜放入显色液后进行图像扫描,使用Image Lab 软件对实验结果进行分析,以GAPDH 为内参,计算目的蛋白相对灰度值。
1.6 统计方法 采用SPSS23.0 统计软件,实验数据以均数±标准差(±s)表示。行为学数据采用重复测量数据的方差分析。其余数据采用Oneway-ANOVA(单因素方差分析)分析组间差异,方差齐用LSD 法,方差不齐用Games Howell法。P<0.05为差异有统计学意义。
2 结果
2.1 大鼠行为学结果CCI 术后,模型组大鼠出现跛行,右后足呈明显跖屈与外翻畸形,且常见舔舐、悬空等后肢保护现象,对机械刺激敏感。经推拿治疗后,大鼠跛行与足跖屈、外翻畸形有所改善,偶见右后肢保护现象,对机械痛刺激敏感性有所下降。如图1 所示,各组大鼠在造模前PWT 均无差异(P>0.05),空白组与假手术组PWT 术后均无差异(P>0.05),与假手术组相比,模型组术后第4-18 天PWT出现明显下降(P<0.001),与模型组相比,推拿组PWT逐渐升高,术后第10-18天差异明显(第10天P<0.05,第14天P<0.05,第18天P<0.01)。
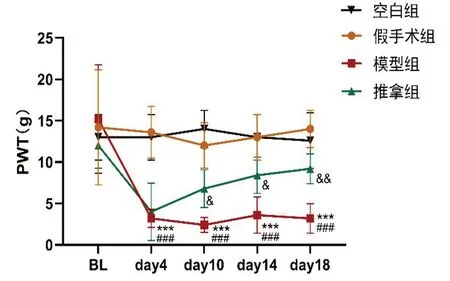
图1 各组大鼠右后足PWT值变化(g)
2.2 形态学结果HE 染色 从图2 可见,空白组与假手术组海马神经元排列整齐,形态结构较为完整。与空白组及假手术组相比,模型组海马神经元损伤,排列紊乱,结构松散,细胞固化萎缩明显;相比模型组,推拿组在一定程度上恢复了神经元的损伤,神经元排列有序,结构完整,细胞固化与萎缩减轻,具有显著效果。
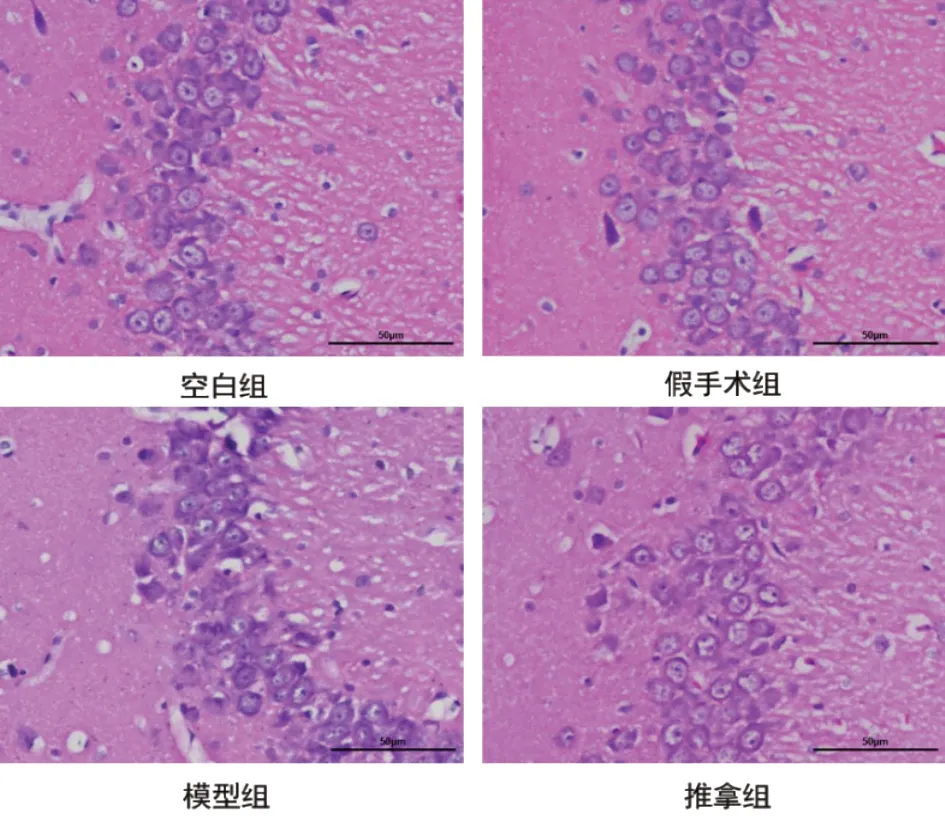
图2 各组大鼠海马HE染色结果(×400)
2.3 免疫荧光染色 如图3 所示,海马区CaMKⅡ主要表达于神经元细胞膜。空白组与假手术CaMKⅡ阳性表达无差异(P>0.05)。与空白组和假手术组相比,模型组大鼠海马的CaMKⅡ阳性表达明显减少,差异具有统计学意义(P<0.01);与模型组相比,推拿组海马CaMKⅡ阳性表达明显增加,差异有统计学意义(P<0.01)。
2.4 Western Blot 如图4-5 所示,空白组与假手术组SYP 表达无差异(P>0.05),与空白组及假手术组相比,模型组大鼠海马SYP 蛋白表达明显降低,差异有统计学意义(P<0.01、P<0.05);与模型组相比,推拿组大鼠SYP蛋白表达明显升高,差异有统计学意义(P<0.01)。
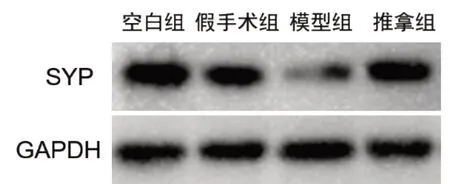
图4 各组大鼠海马SYP及内参的灰度条带
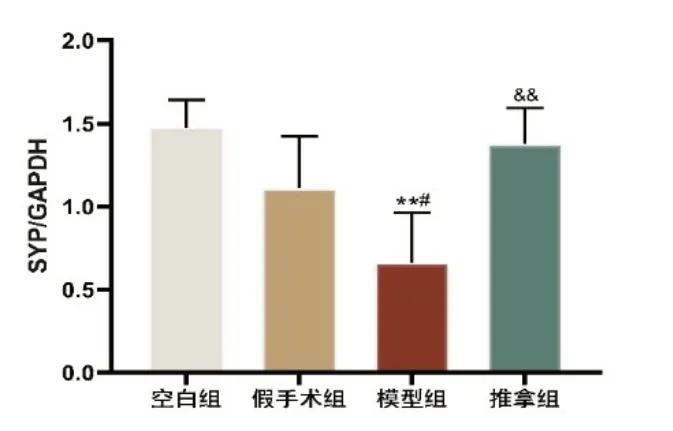
图5 各组大鼠海马SYP及内参的蛋白表达
3 讨论
神经病理性疼痛是一种以自发性疼痛、痛觉过敏和痛觉超敏为特征的慢性疼痛,发病机制较为复杂。研究发现,持续的伤害性刺激可引起脊髓背角突触结构和功能的改变,这些可塑性变化可导致脊髓背角中枢敏化,从而维持神经病理性疼痛的发生[14]。突触可塑性包含结构可塑性与功能可塑性,主要表现为突触传递的长时程增强(long-term poten‐tiation,LTP),均与疼痛密切相关。突触是两个神经元相互接触并能传递信息的结构,主要由突触前部(突触前膜与突触囊泡)、突触间隙(其中包含大量神经递质)以及突触后膜(由细胞骨架蛋白与调节蛋白组成)构成[15]。CaMKII是一种多功能的丝氨酸/苏氨酸蛋白激酶,在突触前后膜均有广泛表达,CaMKII可通过调节神经元的兴奋性,调控突触传递和突触可塑性,从而对疼痛产生影响[16]。研究发现突触前膜的CaMKⅡ通过调控靶点的磷酸化促进兴奋性递质的释放,使其作用于突触后膜的NMDA受体,进而激活CaMKⅡ,从而诱导突触后膜的长时程增强与突触结构重塑[17]。突触素(synaptophysin,SYP)是一种位于突触前膜,并能与突触囊泡相互联系的钙结合蛋白,在神经递质释放及囊泡再循环的过程中发挥重要作用[18],同时突触素也直接参与了突触的形成与调节,是突触可塑性的重要标志[19]。经典的理论认为CaMKⅡ与突触囊泡相接后,可提高突触素与突触囊泡的结合力,从而调节突触可塑性[20]。由此可见,CaMKⅡ与SYP在突触可塑性中发挥重要作用。
本团队在前期研究中发现,CCI大鼠出现脊髓背角突触间隙变窄、突触前膜活性带长度增加及突触后膜致密物变厚等结构变化[21],同时也出现明显LTP增强现象[11],这说明CCI大鼠脊髓背角发生结构与功能可塑性。推拿不仅缓解CCI 大鼠疼痛,同时也逆转了这些突触可塑性改变,意味着推拿通过调控脊髓背角突触可塑性发挥镇痛作用。目前推拿镇痛机制研究主要围绕外周与脊髓[22,23],但疼痛并非简单的外周与脊髓水平伤害性刺激的直接产物,更有可能是由高级中枢对伤害性刺激信号整合、处理而产生的。海马作为边缘系统的重要组成之一,不仅接受疼痛信息的传入,还能处理整合疼痛信息,调节疼痛所引起的机体反应,参与了神经病理性疼痛的发生发展[24]。研究发现周围神经损伤后,大鼠的海马的长时程增强(LTP)受损[25],并出现树突棘萎缩,树突分支数目减少以及突触后致密物变薄、活性带长度缩短等突触结构可塑性的表现[10,26],这表明海马突触可塑性同样参与了神经病理性疼痛状态的形成与维持。基于此,我们选择了海马作为推拿镇痛机制进一步研究对象。
慢性疼痛可诱导脊髓背角突触长时程增强,但对海马区LTP 有损害作用。同时海马树突长度和棘突密度显著减少,脊髓背角树突长度和密度显著增加[27]。另有研究发现疼痛大鼠脊髓背角突触相关蛋白CaMK Ⅱ和SYP 表达增加[7-8],在海马中表达减少[9-10],这表明神经病理性疼痛模型中,海马突触可塑性减弱,脊髓背角突触可塑性增强,疼痛导致脊髓背角与海马突触可塑性发生完全相反的变化。本研究采用慢性压迫性损伤模型来模拟腰椎间盘突出症神经性疼痛,该模型利用羊肠线对坐骨神经进行机械性压迫,造成慢性神经损伤,这种神经损伤能够保持稳定的疼痛状态,非常接近于临床上腰椎间盘突出压迫周围神经引起下肢放射痛的病理过程[28]。
腰椎间盘突出症中医称为“腰痛病”,并将其归于“经筋”病范畴。经筋功能失常表现如《素问·长刺节论》所云:“病在筋,筋挛节痛,不可以行,名为筋痹”即肢体疼痛、活动不利等,这与腰椎间盘突出症临床表现吻合。中医认为腰痛病病机主要包括“不通则痛”与“不荣则痛”,并在《素问·血气形志篇》与《素问·调经》中提到“……经络不通,病生于不仁,治之以按摩醪药”及“神不足者,视其虚络,按而致之,……以通其经,神气乃平”等治疗方法,由此可见中医推拿治疗“经筋”疾病有着悠久的历史。目前推拿也已广泛应用于腰椎间盘突出症的治疗,主要包括按揉法、推法、拿法和点法等[29],均能明显缓解疼痛,有着具有显著的临床疗效[30]。慢性压迫性损伤模型是对于坐骨神经的直接压迫,长期的压迫又致神经所支配区域气血失于濡养,因此,本病病机同时包含“不通则痛”与“不荣则痛”,通过对疼痛部位的点按、按揉,推拿可发挥疏经通络、促进运行气血的功效,从而达到“通则不痛”、“荣则不痛”镇痛作用[31-32]。
本研究结果显示,CCI手术可导致大鼠出现疼痛行为,降低机械足反射阈值,推拿可缓解大鼠疼痛行为(P<0.05),升高大鼠机械足反射阈值(P<0.05),这与我们前期研究一致[32];HE 染色下观察到空白组与假手术组大鼠左侧海马神经元排列整齐,形态完整且饱满,CCI 造模后海马神经元结构破坏明显,排列紊乱,细胞固化萎缩,经推拿治疗后,神经元形态结构有明显改善,排列趋于整齐,由此可推断推拿可保护CCI 大鼠海马神经元,减少神经元损伤;神经元之间通过突触联系,神经元的变化与突触相关蛋白密切相关。模型组大鼠海马CaMKII 与SYP 蛋白表达明显下降(P<0.05),提示CCI会导致海马突触可塑性降低,这与之前的研究一致[33];推拿治疗可使海马CaMKII 与SYP 蛋白表达明显上升(P<0.05),即增强了这两个蛋白的活性,鉴于这两个蛋白对于突触可塑性的重要意义,我们推测认为推拿可使海马CaM‐KII 与SYP 表达上调,加强了海马突触之间的联系,从而改善海马突触可塑性,达到镇痛的效果。
综上所述,推拿镇痛机制可能是通过上调海马CaMKII与SYP表达,改善海马突触可塑性而起效。

