新生儿坏死性小肠结肠炎患儿血清SAA、IL-8的表达及其与临床预后的相关性
许俊,张金玉,王东丽,丁若雨
(南阳市第一人民医院 儿科,河南 南阳 473000)
坏死性小肠结肠炎(necrotizing enterocolitis,NEC)的病死率较高,有研究报道可高达20%~30%,特别是胎龄不足33周的早产儿病死率更高[1]。虽然大部分早期患儿经保守治疗后可痊愈,但若病情不断进展需外科干预,术后常伴有一系列并发症(如肠狭窄、神经系统发育异常等)[2]。目前影像学应用于诊断和评估患儿病情进展存在明显的滞后性,而既往的研究显示,血清标志物在评估NEC病情进展及预后中具有一定的临床指导意义。且血清标志物检查具有无创、快速等特点,更适用于评估新生儿疾病进展情况。NEC的确切病因尚不明确,但目前较多研究发现,NEC多与免疫调节异常、急性炎症瀑布反应等有关[3-4]。白细胞介素-8(interleukin,IL-8)在炎症反应中起到重要的调控作用,且有研究表明,在NEC发生中,携带的IL-8-251 A/T等位基因可在外界刺激下,扩大炎症反应,增加NEC的易感性[5]。越来越多的证据也表明,各种炎症递质(如IL-6、IL-8)在NEC病情进展中出现升高[6-7]。但是IL-6、IL-8等炎症递质的特异性较低,在评估病情进展、预后等方面可能准确度较低。血清淀粉样蛋白A(serum amyloid,SAA)在炎症启动8~24 h内水平急剧升高,对中性粒细胞和肥大细胞具有诱导作用,表现出较强的免疫活性[8]。SAA也被证明可激活炎性小体级联反应,在激活免疫反应中起到关键作用。基于上述研究,为了进一步改善患儿的预后情况,本研究采用巢式病例对照研究,分析新生儿SAA患儿血清SAA、IL-8的表达及其与临床预后的关系,旨在为改善NEC患儿的预后提供临床支持。
1 资料与方法
1.1 临床资料本研究经南阳市第一人民医院医学伦理委员会审核批准,伦理号(2020016),患儿家属均签署知情同意书。以2020年6月至2022年6月南阳市第一人民医院儿科收治的NEC新生儿为研究对象,通过对入选对象临床资料的判定,最终126例患儿进入队列。病例纳入标准:(1)NEC符合第9版《儿科学》[9]中相关标准,患儿主要表现为体温不稳、喂养困难、呕吐、便血等症状;且经实验室、腹部X线平片、腹部超声等综合检查确诊;(2)入院日龄0~28 d;(3)修正后的Bell-NEC分期[10]为Ⅱ~Ⅲ期;(4)均为单胎。病例排除标准:(1)先天性消化道畸形;(2)合并有先天性免疫缺陷病、遗传代谢性疾病;(3)近期接受过白蛋白或血小板输注治疗:(4)合并其他类型感染性疾病,如新生儿肺炎、腹膜炎;(5)外院诊断为NEC,但无完整的临床资料。随访时间为60 d(以院内记录或出院后电话或门诊方式随访记录为依据),至2022年8月。以随访期间患儿入院治疗开始至终点事件发生(全因死亡)为预后判定标准,该队列60 d内有18例患者纳入病例组,其他108例患儿作为对照组。随访期间无脱落。
1.2 临床资料调查采用统一的临床资料调查表,统计患儿性别、胎龄(早产儿、足月儿)、有无窒息、有无宫内窘迫、发病时间(早发型、晚发型)(早发型为发病日龄≤7 d;晚发型为发病日龄>7 d)、NEC并发症(如休克、呼吸衰竭、肾功能损害等)、治疗方式(保守治疗、外科手术治疗)等。
1.3 血清SAA、IL-8检查及其他实验室指标测定于NEC确诊时抽取其外周静脉血1 mL,置于不含抗凝剂的真空采血管(试管1)为测量血清SAA的血样标本;同时吸取10 μL全血置于含抗凝剂的真空采血管(试管2)为测量血清IL-8的血样标本。将采血管反复颠倒混匀,直立静置,低温下3 500 r·min-1离心10 min,收集血清,并放置于-20 ℃冰箱中保存备用。其中血清SAA检测方法为散射比浊法,试剂盒选自重庆博士泰生物技术有限公司;血清IL-8检测方法为免疫荧光发光法,试剂盒选自天津旷博同生生物技术有限公司。同时检测NEC确诊时的其他实验室指标,包括白细胞计数(white blood cell count,WBC)、血小板计数(platelet cell count,PLT)、中性粒细胞/淋巴细胞比值(neutrophil lymphocyte ratio,NLR)、C反应蛋白(C-reaction protein,CRP)等。

2 结果
2.1 不同临床资料特征患儿生存期情况不同Bell-NEC分期、呼吸衰竭情况、治疗方式的NEC患儿生存期比较,差异有统计学意义(P<0.05);不同性别、胎龄、窒息情况、宫内窘迫情况、发病时间、休克情况、肾功能损害情况、其他并发症情况的NEC患儿生存期比较,差异无统计学意义(P>0.05)。见表1。
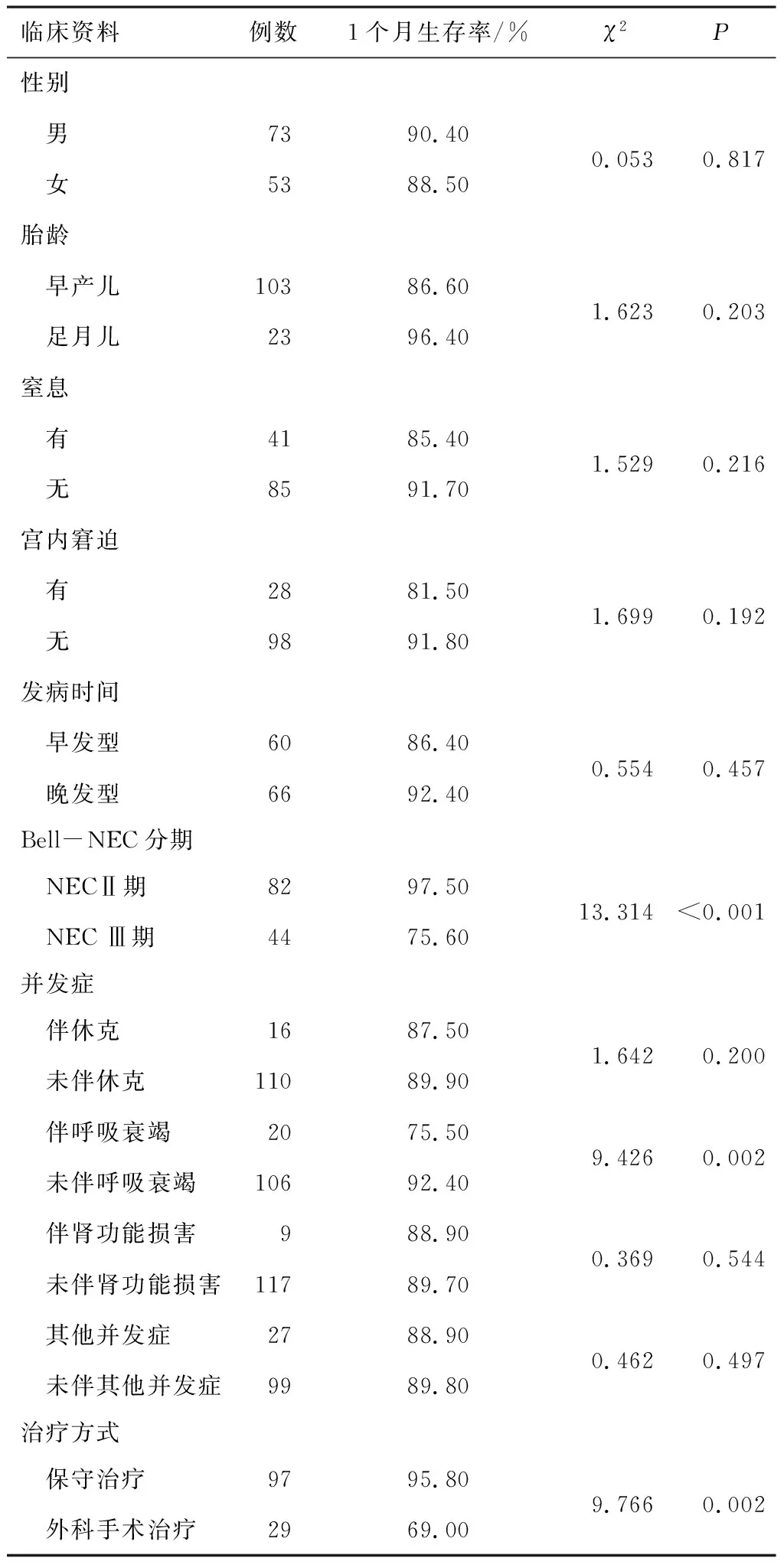
表1 不同临床资料特征患儿生存期情况
2.2 两组患者实验室指标比较病例组NLR值、血清CRP、SAA、IL-8水平均高于对照组,差异有统计学意义(P<0.05);两组WBC、PLT值比较,差异无统计学意义(P>0.05)。见表2。

表2 两组患者实验室指标比较
2.3 血清SAA、IL-8水平与NEC患儿预后的关系将NEC确诊时血清SAA、IL-8水平作为因变量,预后作为自变量,经Cox回归分析显示,无论是否调整混杂因素,血清SAA、IL-8与新生儿NEC患儿预后有关(P<0.05)。见表3。

表3 血清SAA、IL-8水平与NEC患儿预后的关系
3 讨论
NEC病情进展迅速、并发症多,如未给予及时诊断、治疗,易造成患儿病情预后差。NEC确切病因、发病机制尚不明确,但目前临床研究发现,NEC的发生与过度炎症反应密切相关,相关炎症因素可导致肠道黏膜损伤,导致疾病进一步进展;且炎症反应可减少肠系黏膜血流灌注减少,加快患儿病情进展,预后较差[11]。因此,本研究主要从炎症反应这一机制出发,探讨相关血清指标与NEC患儿临床预后的关系,为临床预后提供新的判断依据。
本研究观察血清SAA、IL-8水平与患儿的预后情况,结果显示,预后不良患儿血清SAA、IL-8水平高于预后良好患儿。这一研究结果提示了血清SAA、IL-8水平在预后不良患儿中呈高表达,可能提示患儿预后情况。NEC的发病机制包括内源性炎症反应和免疫炎症递质过度增加,IL-8是一类与免疫相关的细胞因子,当机体受到炎症、感染等刺激时,其水平可异常升高,参与NEC的发生、发展。周川等[12]研究也证实了,IL-8水平变化有助于NEC新生儿的临床诊断。且Nanthakumar等[13]于2011年的研究报道已指出,未成熟的肠道环境对定植细菌的某些成分和继发产生的活化反应,可通过增加IL-8有关的炎症反应而得以实现,而肠道环境紊乱可导致肠道黏膜损伤,增加NEC易感性。
SAA是敏感度、特异度更高的炎症标志物,当机体受到细菌、病毒、支原体、衣原体等抗原刺激后,肝脏可分泌大量SAA,而机体抗原清除后,SAA可快速恢复至正常水平。由此提示了,SAA在提示炎症性疾病病情、预后方面具有一定的作用。急性期SAA可激活许多促炎反应,诱导单核细胞和中性粒细胞等多种细胞因子的释放,加重肠道黏膜的损伤坏死,也易引发其他器官感染或功能障碍;而新生儿机体免疫力较低,不易抵抗严重感染,促使病情进展,往往预后不佳[14]。
基于上述研究,本研究经Cox回归分析显示,无论是否调整混杂因素,血清SAA、IL-8高表达是NEC患儿60 d内病死的高危因素。临床多项研究已证实,NEC患儿的预后与肠道缺血缺氧、炎症坏死、并发症等相关[15-16]。血清SAA、IL-8水平增加,会打乱炎症平衡状态,促炎过程远高于抗炎过程,导致肠道黏膜缺氧缺血、启动肠道炎症的级联反应,损伤肠黏膜,进而引发NEC患儿出现不良结局。且NEC是一种快速进展的炎症性胃肠道疾病,炎症递质的持续升高可促使患者病情由轻症迅速进展至急性腹膜炎、休克等,最终可能引起多器官衰竭,导致其预后不良。根据本研究的结果可得出,通过检测血清SAA、IL-8水平变化可提示患儿的预后情况。但本次研究未进一步证实,在今后的研究中可进行具体的分析,以此证实两指标在新生儿NEC中的价值。
此外,本研究还发现,血清SAA与IL-8呈正相关。主要是由于两指标均参与NEC患儿的炎症反应,二者可相互影响、相互作用,促进患儿病情进展。且本研究观察不同预后患儿的其他指标情况,发现NEC Ⅲ期、手术治疗、呼吸衰竭、NLR、CRP均可能与新生儿NEC患儿预后不良有关。但临床相关研究中已证实,因而本研究未进行进一步分析。但临床评估NEC患儿预后情况时,需考虑上述因素的影响,以此更为精确地判断患儿预后。
综上所述,血清SAA、IL-8高表达提示新生儿NEC患儿预后不良,两指标可为临床治疗效果、预后提供新的判断依据。

