横纹肌肉瘤的18F-FDG PET/CT表现
周会,尚康康,吴桐,武含露,程兵
(1.郑州大学第一附属医院 核医学科,河南 郑州 450052;2.河南省洛阳正骨医院 影像中心,河南 洛阳 471002)
横纹肌肉瘤(rhabdomyosarcoma,RMS)可以发生于任何年龄,在儿童及青少年中是一种比较常见的软组织恶性肿瘤,大约占儿童软组织肉瘤的50%,然而其在成人中比较少见,只占成人软组织肉瘤的3%[1]。第5版世界卫生组织(World Health Organization,WHO)公布的软组织与骨肿瘤分类[2]将横纹肌肉瘤分为胚胎型、腺泡型、梭形细胞型/硬化型及多形型4型,其中胚胎型横纹肌肉瘤最常见。目前关于RMS18F-氟代脱氧葡萄糖(18F-fluorodeoxyglucose,18F-FDG)正电子发射断层成像术(positron emission tomography,PET)/计算机断层扫描(computed tomography,CT)图像特征及应用价值的研究较少,本研究拟回顾性分析41例经病理证实的RMS 患者的18F-FDG PET/CT 影像学表现,以期提高对RMS的认识及诊断准确率。
1 资料与方法
1.1 研究对象回顾性分析2012年10月至2022年2月郑州大学第一附属医院41例经病理组织学证实的RMS患者的PET/CT影像学和临床资料。41例患者中,除4例为术后及化疗后复发行PET/CT检查,其余37例患者均为术前及放化疗前检查。
1.2 仪器与方法采用Siemens PET/CT 扫描仪(Biography 64 Truepoint)。18F-FDG由日本住友集团医用回旋加速器生产并通过自动化合成模块自动化合成,放化纯度>98%。所有受检者禁食6 h以上,血糖<8.0 mmol·L-1。静脉注射显像剂18F-FDG 60 min后行头部及体部PET/CT检查:CT扫描参数为管电压120 kV,管电流120~250 mAs,层厚3 mm。PET采用3D扫描模式,扫描范围从颅顶至脚底。根据CT图像对PET图像进行衰减校正后行迭代法重建,在Syngo工作站上将重建图像与CT图像进行融合。
1.3 图像分析由2名具有10 a以上工作经验的核医学科医生采用盲法阅片,分别对病灶的部位、密度及与周围组织的关系进行观察,并记录病灶最大标准化摄取值(maximum standardized uptake value,SUVmax)。结论不一致时由第3位医生进行分析并做出最终诊断。

2 结果
2.1 临床特征41例RMS患者,其中男21例,女20例,年龄0.75~77岁,中位年龄14(6.5,26.5)岁。病理类型:胚胎型 21 例,腺泡型 10例,梭形细胞型3例,多形型1例,类型不明6例。原发灶部位:头面部18例,腹盆腔(除外膀胱和前列腺)10例,四肢6例,泌尿生殖道5例,纵隔1例,骶尾部1例。周围骨质破坏发生率为34.1%(14/41),淋巴结转移发生率为56.1%(23/41),远处转移发生率为34.15%(14/41)。
2.2 原发灶评估肿块密度等同或稍低于肌肉密度,所有肿块均未见明显出血、钙化征象。除原发于足部的1例呈多发肿块外,余40例均为单发肿块。10例原发于腹盆腔的病灶,7例出现输尿管受压引起肾积水。27例(65.9%)原发灶侵犯周围结构,其中骨质破坏发生率达34.1% (14/41),除2例原发于四肢外,余均位于头颈部。41例患者原发灶均呈FDG摄取增高,除1例原发于前列腺的病灶SUVmax低于肝脏本底外,余均高于肝脏本底摄取。原发灶除部分体积较小的病灶,大部分病灶FDG摄取不均匀。原发灶SUVmax为9.67±4.75,范围1.3~21.2;TLR为4.26±1.94,范围0.34~8.83。患者PET/CT图像见图1、2。
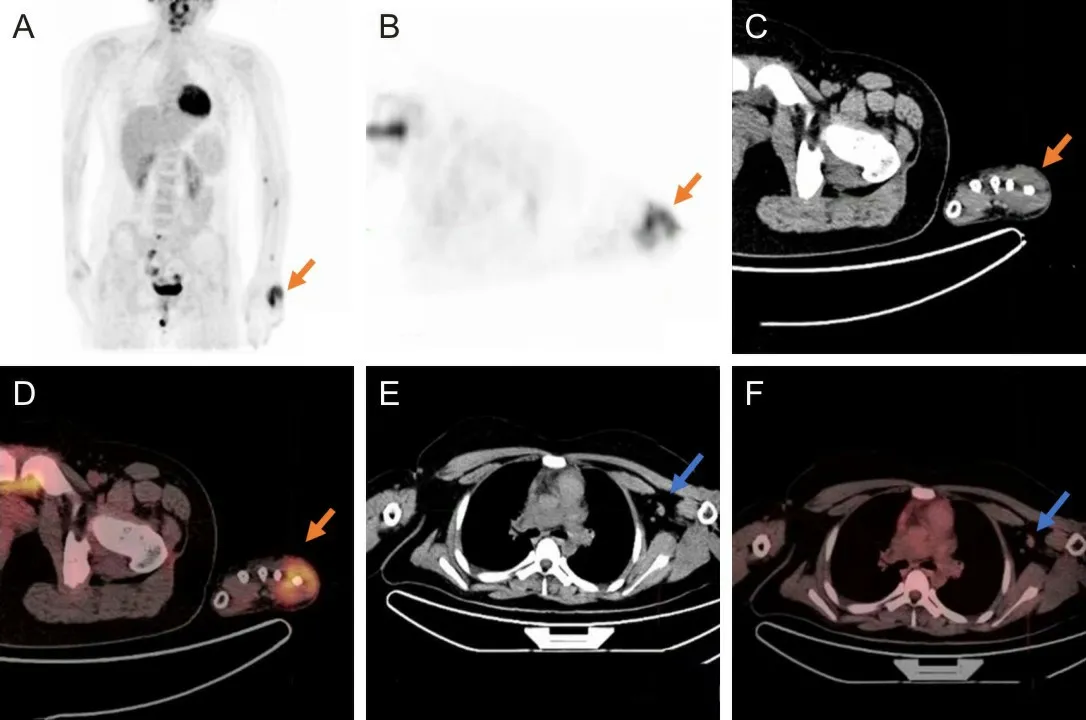
A 为三维最大密度投影图;B为PET图像;C为CT图像;D为PET/CT图像;A~D箭头示左侧第5掌骨周围可见软组织肿块影放射性分布浓聚,SUVmax约8.6;E为CT图像;F为PET/CT图像;E、F箭头示左侧腋窝可见多个肿大淋巴结,大者直径约1.2 cm,SUVmax约为1.9。
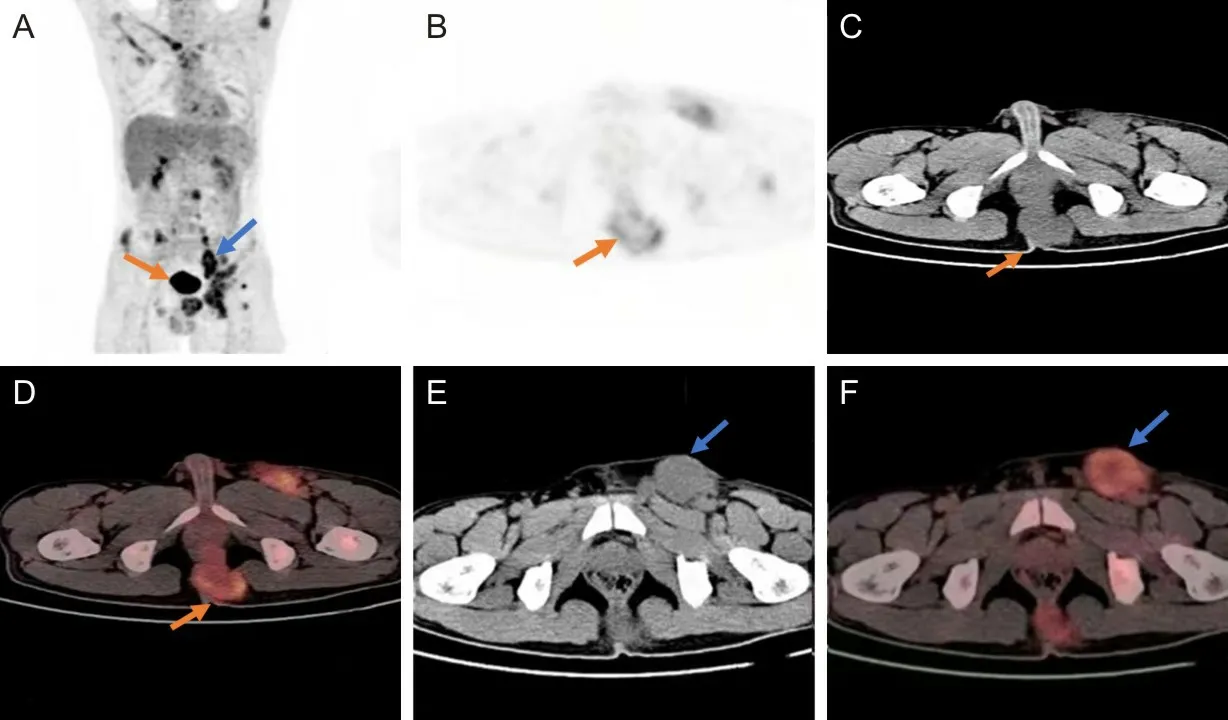
A为三维最大密度投影图;B为PET图像;C为CT图像;D为PET/CT图像;A左侧箭头及B~D箭头示尾骨下方直肠后可见软组织肿块放射性分布浓聚,SUVmax约为4.9。E为CT图像;F为PET/CT图像;A右侧箭头及E、F箭头示左侧腹股沟区可见多个肿大淋巴结,大者直径约4.3 cm,SUVmax约为5.5。
2.3 胚胎型与其他病理类型RMS、儿童与成人RMS的比较
2.3.1胚胎型RMS与其他病理类型RMS比较 胚胎型患者年龄低于其他病理类型者(P<0.05)。两组性别、骨质破坏发生率、淋巴结转移发生率、远处转移发生率、原发灶SUVmax、TLR差异均无统计学意义(P>0.05)。见表1。
2.3.2儿童RMS 与成人RMS 比较 儿童患者胚胎型RMS占比高于成人(P<0.05),成人远处转移发生率高于儿童(P<0.05)。两组性别、周围骨质破坏发生率、淋巴结转移发生率、原发灶SUVmax、TLR差异均无统计学意义(P>0.05)。见表2。
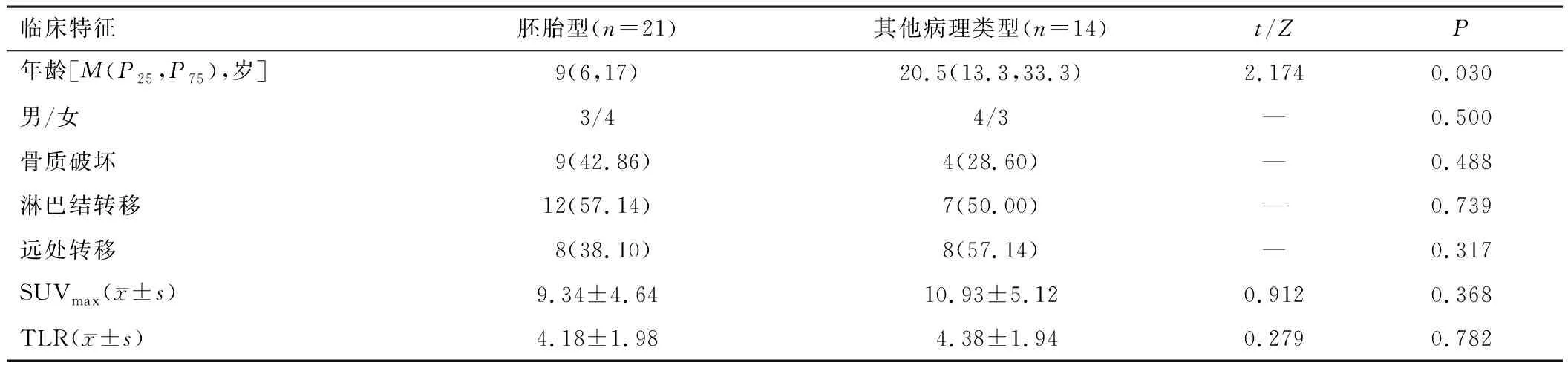
表1 胚胎型RMS与其他病理类型RMS比较
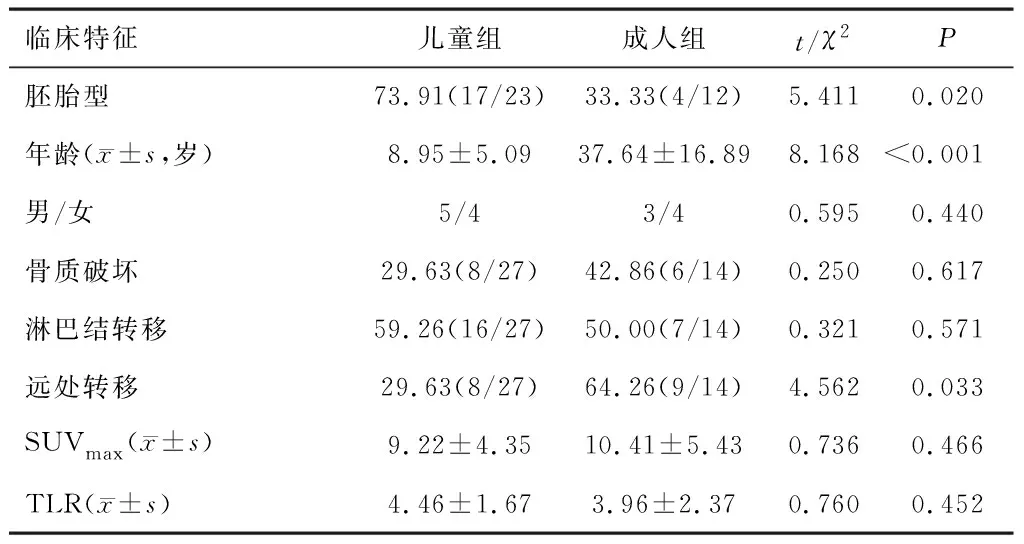
表2 儿童RMS 与成人RMS 比较
2.4 淋巴结及远处转移41例RMS患者中,淋巴结转移发生率为56.1%(23/41),远处转移发生率为41.46%(17/41)。淋巴结转移主要表现为咽旁间隙、颈部、锁骨上下、纵隔、腹腔、腹膜后、双侧髂血管旁、双侧腹股沟、腋窝淋巴结增大伴FDG代谢增高,转移淋巴直径为0.4~6.2 cm,SUVmax为1.8~9.0。6例患者肺部转移,其中4例表现为肺内高密度结节影,另2例表现为絮状高密度影及软组织密度影。2例患者胸膜转移,1例表现为局部胸膜增厚代谢增高,SUVmax为6.5,另1例胸膜未见明显异常,仅有局部胸膜代谢增高,SUVmax为4.6。12例患者出现骨转移,表现为部分骨质破坏伴代谢增高,SUVmax为2~16。1例患者出现骨髓腔病变,表现为中央及外周骨髓放射性分布凝聚,SUVmax为9.0。
3 讨论
横纹肌肉瘤可以发生于任何年龄,是儿童和青少年中最常见的软组织肉瘤,但成人的发病率远远低于儿童及青少年,RMS在成人中极为罕见。本研究儿童患者27例,年龄(9.29±4.90)岁。成人患者14例,年龄(37.64±16.89)岁。胚胎型是RMS最常见的亚型,好发于儿童及青少年,占50%~60%以上,近50% 的RMS起源于头颈部[3]。本研究胚胎型患者占病理类型明确者60%(21/35),43.9%(18/41)的病例发生于头颈部,与文献报道相符。多形型RMS比较罕见,常见于中老年人,好发于四肢[4-5]。本研究仅有1例患者为多形型,年龄77岁,表现为左膝关节外侧肿物。RMS产生的症状因部位而异,本研究头颈部患者以头痛、鼻塞、视物模糊、腮腺区肿大为主;腹盆腔以无痛性包块为主,其中2例患儿以发现腹股沟区肿大淋巴结就诊;泌尿生殖系统以排尿困难、阴道流血为主;四肢病变以局部包块为主;纵隔病变表现为胸闷、咳嗽咳痰;骶尾部表现为左臀部肿物。RMS 是一种侵袭性恶性肿瘤,主要通过淋巴及血行转移,主要转移部位为远处淋巴结、肺及骨等。本研究显示,骨是RMS远处转移最常受累部位,其次是肺,这与文献报道[6]一致。本研究有2例患者胸膜转移,既往文献还报道了乳房、肝脏、小肠部位的转移[6]。骨质破坏在RMS 中非常普遍[7-8],本研究病例骨质破坏发生率达34.1%,除2例原发于四肢外,余均位于头颈部,主要与头颈部的解剖特点有关。
PET/CT能够从代谢方面提供诊断依据,在肿瘤的鉴别诊断中有着独特的优势。然而,既往研究中RMS的影像学分析多为CT及MRI表现,PET/CT研究较少,且多数为个案报道。本研究显示,RMS原发灶在CT上表现为等密度或稍低密度肿块,钙化和出血在RMS 中少见[9-10],本研究亦未发现。所有患者原发灶均呈FDG摄取增高,除1例原发于前列腺的病灶SUVmax低于肝脏本底外,余均高于肝脏本底摄取。原发灶除部分体积较小的病灶,大部分病灶FDG摄取不均匀。PET/CT 比起常规影像学检查,对骨骼及淋巴结受累的检出更有优势,有助于RMS患者的分期、再分期及治疗后评估[11-12]。报告称 PET/CT 在18%的病例中改变了 RMS 患者的管理[13]。本研究有12例检出骨转移,其中部分病灶未见明显骨质破坏而在PET上表现出FDG分布浓聚。本研究检出的转移淋巴直径为0.4~6.2 cm,SUVmax为1.8~9.0。PET/CT 检测到的转移性淋巴结无大小阈值,在 CT 上低于被视为异常大小标准的淋巴结在PET上可显示 FDG 摄取异常。本研究1例骨髓腔SUVmax为9.0的患者后行骨髓穿刺证实骨髓受累,提示PET可用于检测骨髓受累情况[14]。本研究1例检出胸膜转移的患者,CT表现未见明显异常,仅在PET上表现为局部胸膜FDG浓聚,提示PET有助于发现结构尚未发生改变的转移病灶。检出的肺部病灶中,部分肺内结节代谢不高,既往文献也提到PET在肺结节检出上有局限性[15],因此肺转移灶的诊断需要结合CT。PET/CT还可以检测肿瘤的早期复发,本组4例患者术后及化疗后行PET/CT检查,发现原手术部位FDG摄取异常增高,提示疾病复发。本研究分组比较了胚胎型RMS与其他病理类型RMS、儿童RMS及成人RMS的SUVmax及TLR值,但差异无统计学意义。唐文芳等[15]比较了儿童胚胎型RMS与腺泡型RMS的SUVmax及TLR值,亦差异无统计学意义。有待以后大样本数据及更细化的分组进一步比较。
RMS治疗方法包括化疗、手术切除及局部放疗[16-17]。成人RMS的预后明显差于儿童,目前导致这种差别的原因仍然未知。多数文献认为,组织学类型、原发部位、远处转移、疾病分期及对治疗的耐受程度是导致这种差别的可能因素[4,18-19]。胚胎型RMS的预后好于其他病理类型。预后好的部位包括眼眶部、头颈部(除外脑膜旁)、泌尿生殖系统(除外膀胱和前列腺)及胆道,预后不好部位包括膀胱、前列腺、脑膜旁、肢体、躯干、腹膜后、盆腔和其他。本研究儿童组及成人组远处转移发生率分别为29.63%及64.26%,差异有统计学意义。儿童组及成人组胚胎型RMS分别占62.96%及28.57%,差异有统计学意义,与郭芬等[18]的研究结果一致。本研究儿童组与成人组、胚胎型与其他病理类型患者PET/CT表现差异无统计学意义。
PET/CT对于评价RMS患者的预后亦有一定价值。Fayolle等[20]最新的研究表明,肿瘤代谢体积(metabolic tumor volume,MTV)>200 cm3是影响RMS患者预后的独立预测因子。Casey等[21]对107例患者的研究表明,原发肿瘤的SUVmax阈值为9.5是总生存期和无病生存率的独立预测因子。Baum等[22]的研究表明,PET代谢程度在视觉上被评为高度代谢活跃的病灶或TLR值高于4.6的RMS患者,总体生存时间显著缩短。Sa等[6]的研究表示,完全代谢反应的患者,根据基线PET/CT得出的SUVmax、标准化摄取峰值(peak standardized uptake value,SUVpeak)、MTV、糖酵解总量(total lesion glycolysis,TLG)代谢参数显著低于非完全代谢反应患者。本研究未对病例进行随访及预后分析,有待今后进一步研究 PET 参数与RMS患者预后的相关性。
总之,本研究比较了胚胎型RMS与其他病理类型RMS、儿童RMS与成人RMS在PET/CT上的表现,未发现不同分组之间有显著差别。本研究显示胚胎型RMS患者年龄较其他病理类型RMS患者年龄小,儿童组胚胎型RMS较成人组多见,成人组远处转移发生率大于儿童组。PET/CT 可以较好地反映患者病灶分布范围及其代谢活性,为临床诊疗提供依据。

