BRAF V600E基因检测对超声高危、细胞学Bethesda Ⅰ类甲状腺结节良恶性的鉴别诊断价值
付敬杰,韦娜,史银花,许晶晶
(郑州大学第一附属医院 病理科,河南 郑州 450000)
随着影像学检查的普及,甲状腺结节的检出率越来越高[1]。术前病理诊断不仅决定是否需要手术,还为手术范围、手术策略的确定提供了可靠的依据,因此在术前准确筛选出甲状腺恶性结节是非常重要的[2]。美国甲状腺学会(American Thyroid Association,ATA )于2015年发布的《成人甲状腺结节与分化型甲状腺癌指南》[3]指出,超声诊断为“高危”的甲状腺结节的恶性肿瘤发生率为70%~90%,此类结节应在超声引导下细针穿刺活检[4]。然而,细针穿刺得到的标本无法诊断或标本不满意,即细胞学Bethesda Ⅰ类[5]的概率为10%~20%[6]。对于细胞学无法诊断的甲状腺结节,Bethesda指南给出的建议是3个月后重复细针穿刺,然而由于重复细针穿刺的费用较高,且时间间隔较长,有必要寻找一种特异性较高的检测手段来提高此类结节的恶性检出率。近年来,随着分子生物学技术的发展,在甲状腺结节的诊断和预后评价中,大量的分子标志物被引用进来。BRAFV600E基因突变是甲状腺恶性肿瘤发生发展的重要遗传事件[7]。本文探讨BRAFV600E基因检测对超声高危、细胞学Bethesda Ⅰ类的甲状腺结节良恶性的鉴别诊断价值,以及与BRAFV600E突变相关的临床超声表现。
1 资料与方法
1.1 一般资料回顾性分析2018年3月至2019年6月在郑州大学第一附属医院超声检查提示高危且细胞学判读为Bethesda Ⅰ类(图1)的患者共780例,其中70例接受BRAFV600E基因检测和手术治疗。将这70例患者纳入研究,其中男12例(17.1%),女58例(82.9%)。经组织病理证实的良性甲状腺结节有17例(24.3%),其中结节性甲状腺肿11例,结节性甲状腺肿伴纤维化、钙化6例;恶性甲状腺结节有53例,其中甲状腺乳头状癌(图2)50例,甲状腺微小乳头状癌3例。
A为低倍镜下可见大量囊性成分,未见甲状腺滤泡细胞团(HE染色,放大倍数4×10);B为高倍镜下可见少许炎细胞,杂质成分,未见甲状腺滤泡上皮细胞(HE染色,放大倍数10×10)。
A为低倍镜下组织排列紊乱,局部形成分枝状的乳头结构(HE染色,放大倍数10×10);B为高倍镜下肿瘤细胞的极向紊乱,核增大,重叠,部分呈毛玻璃样核,可见核沟(HE染色,放大倍数40×10)。
1.2 纳入排除标准纳入标准:(1)超声判读为高危且细胞学判读为Bethesda Ⅰ类的结节;(2)接受BRAFV600E基因检测和手术治疗;(3)无颈部放射治疗史;(4)具备完整的临床病历资料。排除标准:(1)无最终组织病理结果;(2)重要临床资料缺如;(3)既往有其他肿瘤病史。具体流程如图3。
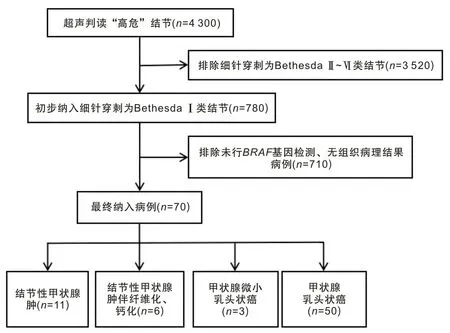
图3 纳入流程图
1.3 检查方法及诊断标准
1.3.1超声 嘱患者平躺于诊疗床上,选用多普勒超声仪器,配置7.5~12 MHz的高频线阵探头进行超声检查。高危结节[8]是指:(1)实性、低回声结节。(2)同时满足以下1项或多项可疑恶性超声征象:①边缘不规则;②微钙化;③纵横比>1;④边缘钙化中断,低回声突出钙化外;⑤侵犯甲状腺被膜。
1.3.2超声引导下细针穿刺及BRAFV600E基因检测 (1)由同一位高级细胞技术医生在超声引导下将穿刺针进入目标结节,拔出针芯,在结节内反复提插穿刺针,充分取材后退出穿刺针;(2)每个穿刺部位应至少穿刺2~3次,并将穿刺物放入30 mL清洗液的离心管内;(3)离心(1 200g离心5 min),去除上清液;(4)将样本瓶静置15 min后,使用T1200/T5000/T5000AL制片,并将剩余保存液用于BRAFV600E基因检测。细针穿刺诊断标准:按照细胞病理学Bethesda系统[5]将甲状腺结节分为Bethesda Ⅰ~Ⅵ类;阳性代表BRAFV600E基因突变型,阴性代表野生型。
1.4 统计学方法采用SPSS 22.0软件,计数资料以例数和百分数(%)表示。以组织病理为金标准,构建受试者工作特征(receiver operating characteristic,ROC)曲线分析BRAFV600E基因检测对超声高危、细胞学Bethesda Ⅰ类的甲状腺结节良恶性的鉴别诊断效能;应用χ2检验分析与BRAFV600E基因突变相关的临床超声特征。P<0.05为差异有统计学意义。
2 结果
2.1BRAFV600E基因检测诊断效能70例患者中,有50例(71.4%)BRAFV600E基因突变,20例(28.6%)BRAFV600E基因未突变。以石蜡切片组织病理为金标准,BRAFV600E基因检测诊断超声高危、细胞学Bethesda Ⅰ类甲状腺结节的特异度为88.2%(15/17),敏感度为90.5%(48/53),阳性预测值为96.0%(48/50),阴性预测值为75.0%(15/20),阳性率为71.4%(50/70),曲线下面积为0.894。见表1。

表1 BRAF V600E基因检测诊断效能
2.2BRAFV600E基因突变相关的临床资料分析将纳入研究的70例患者按照BRAFV600E基因检测结果分为两组,即突变组和未突变组。70例患者70个甲状腺结节,49个(70.0%)结节的纵横比≥1;58个(82.9%)结节的边缘不规则;53个(75.7%)结节合并微钙化。相关临床资料分析结果显示:患者年龄、性别和结节纵横比两组间比较差异无统计学意义(P>0.05);结节边缘不规则、微钙化、≥2个可疑恶性超声征象以及恶性组织病理两组间比较,差异有统计学意义(P<0.05)。见表2。
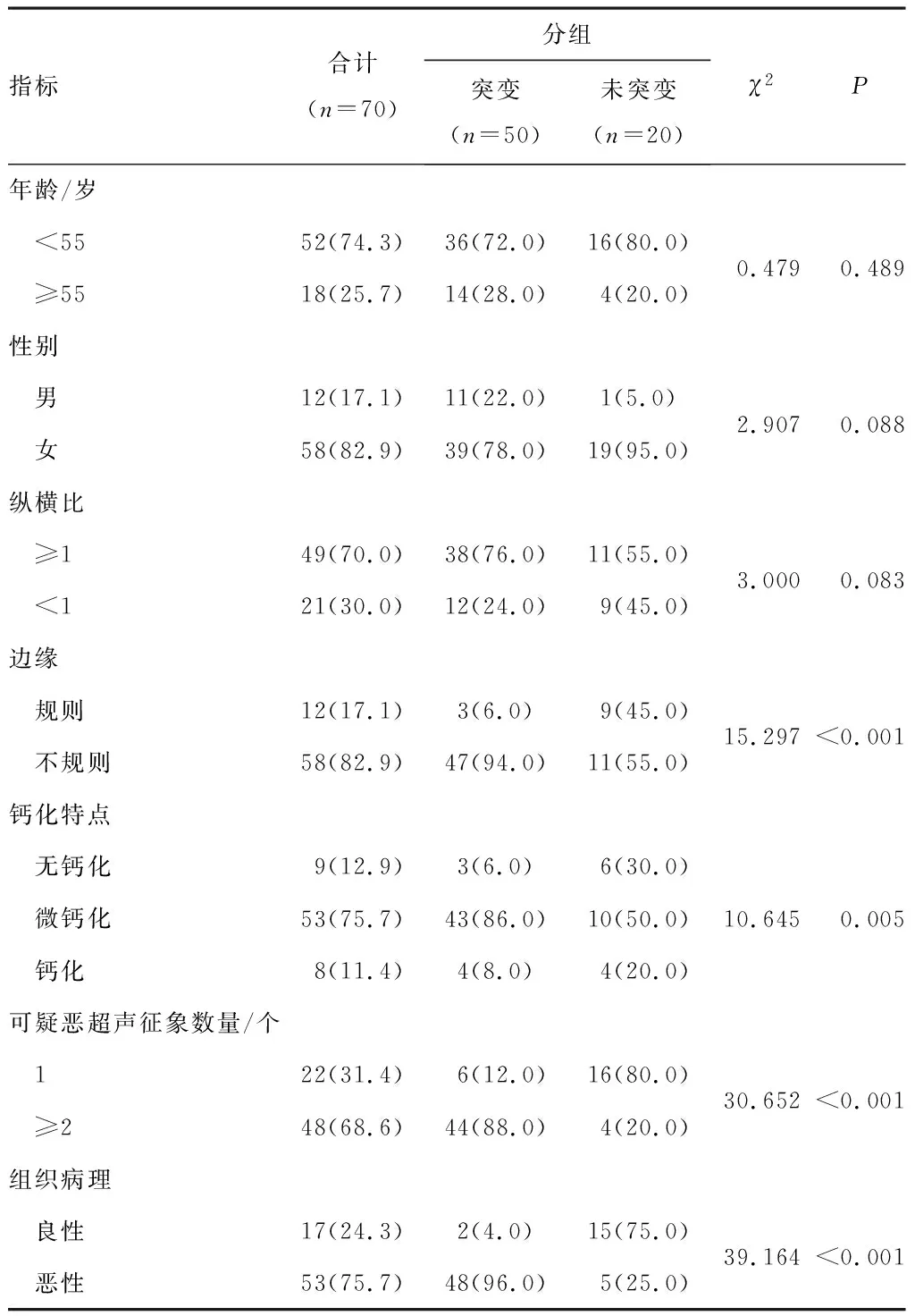
表2 BRAF V600E基因突变相关的临床资料分析
3 讨论
甲状腺细针穿刺细胞学检查是术前评估甲状腺结节良恶性的常用手段[9]。标本满意度评估是甲状腺细针穿刺诊断不可或缺的一步,它决定了细胞学诊断结果正确与否。恰当应用满意度评估标准,可减少细针穿刺诊断的假阴性[10]。虽然大多数细胞学检查可以获得明确的诊断结果,但在临床工作中发现仍有10%~20%的甲状腺结节被归类为标本无法诊断或标本不满意,即细胞学Bethesda Ⅰ类[11]。主要包含以下情况[5]:(1)甲状腺滤泡上皮细胞团少于6团、每团少于10个滤泡上皮细胞;(2)制片原因引起的标本杂质较多、滤泡细胞被遮盖或染色不良;(3)大量囊液成分,甲状腺滤泡上皮细胞极少。导致细胞学无法诊断标本的原因如下:(1)穿刺者操作不当,采样有误,制片效果不佳;(2)结节直径较小、存在环状钙化,超声引导下细针穿刺的难度较高,细针穿刺难以获得满意标本[12];(3)细针穿刺能获取满意的滤泡细胞数量在一定程度上还取决于病变的性质,结节的高囊性容量是导致标本无法诊断或标本不满意细胞学结果的独立危险因素[13]。对于此类结节,目前采取的措施主要以重复细针穿刺为主[14]。然而Woo等[15]发现,重复细针穿刺仍然有67.5%的概率再次得到不满意标本,并且Choi等[16]的数据分析得出重复细针穿刺是第二次得到无法诊断结果的独立危险因素;其次,多项研究证明再次穿刺的最佳时间是3个月之后[12,17]。但是超声判读为高危的甲状腺结节有着较高(70%~90%)的恶性风险,应当尽早做出明确诊断,3个月的等待期可能会延误治疗,对患者造成心理负担。因此,对于超声高危、细胞学Bethesda Ⅰ类的甲状腺结节,重复细针穿刺并非最佳选择,需要寻找一种高效的检测方法来区分这类结节的良恶性。甲状腺滤泡起源的癌倾向为经过多级协同分子事件后不断进展的一组肿瘤,其中BRAFV600E基因突变是最常见的早期驱动分子改变,其发生机制为BRAFV600E基因构象改变,激活下游传导通路,即RAS/RAF/MEK/ERK通路,最终导致细胞转录增殖失控,产生一系列临床病理表现[18]。由此看来,对于超声提示高危、细胞学无法诊断的甲状腺结节,BRAFV600E基因检测或许有一定的辅助诊断价值。
本研究探讨了BRAFV600E基因检测对于超声高危、细胞学Bethesda Ⅰ类的甲状腺结节的临床价值。数据显示,超声高危、细胞学Bethesda Ⅰ类共70例,以组织病理为“金标准”,53例经最终组织病理证实为恶性,恶性率为75.7%。70例超声高危、细胞学Bethesda Ⅰ类甲状腺结节,50例发生BRAFV600E基因突变,基因突变率为71.4%。50例BRAFV600E基因突变的甲状腺结节,48例(96.0%)最终证实为恶性。甲状腺细胞学的诊断依靠异型性的滤泡上皮细胞团,对于细针穿刺获取的滤泡上皮细胞团质量和数量不足的结节,细胞学无法做出明确诊断,但是BRAFV600E基因检测可识别出极少量恶性肿瘤细胞。数据显示BRAFV600E基因检测诊断超声高危、细胞学Bethesda Ⅰ类甲状腺结节的灵敏度、阳性预测值都在90.0%以上,表明BRAFV600E基因检测对于鉴别此类结节良恶性具有较好的临床价值[19],可以降低此类结节的漏诊率。因此,在临床上,BRAFV600E基因检测或可代替重复细针穿刺,以辅助诊断超声高危、细胞学Bethesda Ⅰ类的甲状腺结节。国内外研究表明BRAFV600E基因突变与甲状腺乳头状癌的复发以及复发性甲状腺乳头状癌放射性碘治疗效果欠佳相关[20-21]。一项大型meta数据分析结果表明,在甲状腺乳头状癌患者中,BRAFV600E基因突变的患者淋巴结更易发生转移[22]。由此可见,BRAFV600E基因检测不仅可以协助诊断甲状腺恶性肿瘤,而且对恶性结节治疗方式的选择及预后方面或有很大帮助。
BRAFV600E基因突变与临床超声特征的关系一直是近年来研究的热点,大多数的研究方向主要集中在探讨甲状腺结节微钙化、边缘不规则以及结节纵横比等[23],然而不同的研究结论各不相同。Helmi等[24]认为BRAFV600E基因突变与低回声、结节钙化和边缘不规则有关,而与结节大小和结节内部成分无关。本研究表明患者年龄、性别和结节纵横比与BRAFV600E基因突变无关;结节边缘不规则、微钙化、≥2个可疑恶性超声征象以及恶性组织病理与BRAFV600E基因突变相关。
本研究发现2例BRAFV600E基因检测假阳性的病例,即BRAFV600E基因突变,但细针穿刺细胞学和组织病理均为良性。这2例的组织病理结果均为结节性甲状腺肿。以往文献也报道过这种假阳性的病例,这种情况主要是由于检测方法的自身机制引起的。传统的荧光PCR法可靠性高,但是不够灵敏。因此人们开始探索如ARMS-qPCR测序法、dd-PCR测序法的新兴检测方法,这些方法能显著提高基因检测的灵敏度,但是会造成一定的假阳性[25]。Kim等[26]发现 5例BRAFV600E基因突变,手术证实为良性的基因突变假阳性病例。DiLorenzo等[27]报告1例BRAFV600E基因突变,最终经手术证实为腺瘤样结节甲状腺肿的病例。然而Zhao等[28]证实ARMS-qPCR检测虽然可造成假阳性病例,但是就总体而言,ARMS-qPCR检测不会影响BRAFV600E突变分析对甲状腺恶性结节的附加诊断价值。本研究BRAFV600E基因检测方法采用Sanger测序结合ARMS-qPCR方法。另外,本研究中有5例手术病理证实为甲状腺乳头状癌,但是未检测到BRAFV600E基因突变,这可能是不合并BRAFV600E基因突变的野生型甲状腺乳头状癌病例。
本文的研究意义主要包括以下几点:(1)以往大量文献报道BRAFV600E基因检测对于细胞学判读为Bethesda Ⅲ~Ⅵ类的甲状腺结节有着较高的灵敏度、特异度,但是很少有研究探讨BRAFV600E基因检测在细胞学Bethesda Ⅰ类的诊断价值,本文发现BRAFV600E基因可将细胞学无法诊断的标本中的恶性结节筛选出来,弥补了细胞学诊断上的不足;(2)近年来很多研究探讨与BRAFV600E基因突变相关的超声病理特征,但是很少有研究报道甲状腺结节恶性超声征象数量是否与BRAFV600E基因突变相关,本文证实具有2个及2个以上的甲状腺结节更易发生BRAFV600E基因突变。
综上所述,BRAFV600E基因检测对于鉴别细胞学Bethesda Ⅰ类、超声高危的结节良恶性有较高的临床价值,可以提高此类结节的恶性检出率。甲状腺结节微钙化、边缘不规则以及结节具有≥2个可疑恶性超声征象与BRAFV600E基因突变相关。

