卵巢癌预后不良基因ATP6V1F、GINS1、GINS4的筛选
饶玉梅,王欣欣
(郑州大学第一附属医院 妇科,河南 郑州 450052)
女性生殖系统恶性肿瘤病死率中上皮性卵巢癌居首,虽然手术治疗、铂类为主的化疗、贝伐珠单抗和多腺苷二磷酸核糖聚合酶抑制剂在一定程度上改善了预后,但晚期患者5 a生存率低于45%[1-2]。2021年美国卵巢癌病例数约24.7万人[3],而我国每年死于卵巢癌的人数约为2.5万人,而且呈逐年上升趋势[4],因此研究卵巢癌发生发展的分子学机制,寻找可靠的临床标志物,用于诊断和识别不同特征患者,并进行分层,以便进行更精准的个体化治疗,具有重要的临床意义。
近年来随着生物信息学技术的发展,借用计算机从宏观上进行大数据分析,改变了以往单个基因研究的局限性,可以在多基因水平更全面地研究肿瘤特性,为更好研究肿瘤发生发展机制提供新的方法。本研究借助于基因表达综合数据库(gene expression ominibus,GEO)公共大数据平台,通过对比正常卵巢组织的基础上,得到卵巢癌差异表达基因(differentially expressed genes,DEGs),再通过多种大数据库对差异基因进一步筛选,获得与卵巢癌预后密切关联的基因,为进一步研究卵巢癌的分子学机制进行铺垫工作。
1 材料与方法
1.1 数据提取从GEO数据库(http://www.ncbi.nlm.nih.gov/geo)中筛选下载数据集GSE14001、GSE14407,分析平台为GPL570。GSE14001包含20例浆液性卵巢癌和3例正常卵巢组织;GSE14407包含12例浆液性卵巢癌和 12例正常卵巢组织。
1.2 差异表达基因筛选运用GEO自有的在线分析工具GEO2R(http://www.ncbi.nlm.nih.gov/geo/geo2r)分析所下载的数据集,筛选出DEGs。筛选标准为adj.P.Val<0.05,|log FC|>2,下载所得数据,去除无探针对应或一对多个探针的基因。将DEGs输入Venn软件(http://bioinformatics.psb.ugent.be/webtools/Venn/),得出DEGs的交集。设log FC<0为下调基因,log FC>0为上调基因[5-6]。
1.3 基因本体论(gene ontology,GO)富集分析和京都基因和基因组百科全书(Kyoto Encyclopedia of Genes and Genomes,KEGG)富集分析利用DAVID数据库(https://david.ncifcrf.gov/)对所得DEGs进行GO和KEGG富集分析,P<0.05为富集差异有统计学意义,结果大于3的仅列出差异最显著的前三位[7]。
1.4 蛋白相互作用网络(the protein- protein interaction network,PPI)及模块分析应用String11.0网站http://string-db.org分析DEGs,参数设置:maximum number of interactors=0,confidence score≥0.4,将分析所得数据导入Cytoscape 3.7.1软件的插件MCODE 1.5.1,进行分析,参数设置:degree cutoff=2,max.Depth=100,k-core=2,node score cutoff=0.2,得到关键基因网络模块[8]。
1.5 筛选分析关键基因用Kaplan Meier plotter网站http://kmplot.com/analysis分析网络模块关键基因,筛选出与患者总生存期(overall surviva,OS)有相关性的基因(P<0.05)。将筛选出的基因,通过GEPIA数据库(http://gepia.cancer-pku.cn),再一次筛选出卵巢癌中表达异常的基因(P<0.05)[9]。
1.6 关键基因蛋白质在正常卵巢及卵巢癌中表达及定位The Human Protein Atlas数据库(https://www.proteinatlas.org/)提供了2万余种人类蛋白质的细胞、组织和器官分布信息,并应用免疫组化技术检查每种蛋白质在人类48种正常组织、20余种肿瘤组织中的表达情况。在该数据库中检索筛选的关键基因,在Tissue选项中选择“ovary”,在Pathology分析中选择“ovarian Cancer”,分别获得上述基因的蛋白质,在正常卵巢组织和卵巢癌组织中表达的免疫组化情况,进一步分析其表达和定位[10-11]。
2 结果
2.1 筛选差异基因从GSE14001数据集得到1 199个DEGs,其中上调为518,下调为681;GSE14407中得到1 673个DEGs,上调为986,下调为687;二者交集得到211个DEGs,其中92个上调、119个下调基因。见图1。
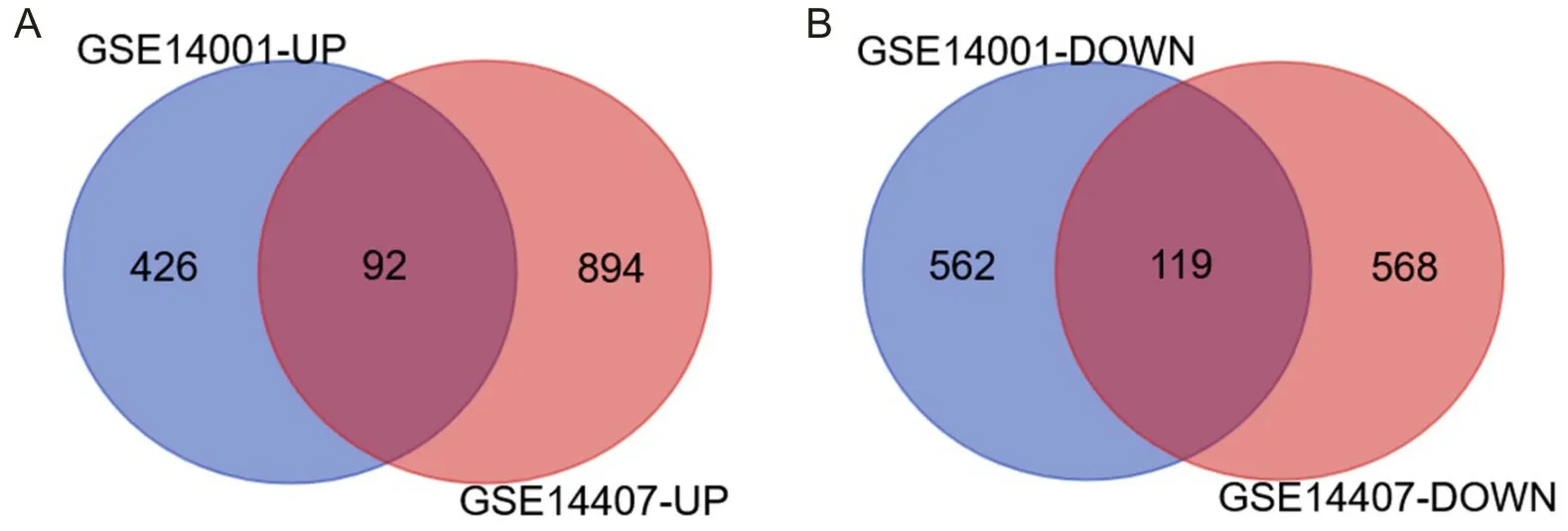
A为上调基因,B为下调基因。
2.2 GO和KEGG富集分析211个DEGs的GO富集主要从生物学过程、细胞组分和分子功能3个方面进行分析,结果见表1,表内基因数为对应的DEGs数目,结果显示差异基因主要参与细胞的氧化代谢、细胞外泌体、细胞运动等方面。KEGG通路主要集中于细胞黏附运动及癌症通路等方面,见表2。

表1 卵巢癌DEGs的GO富集分析
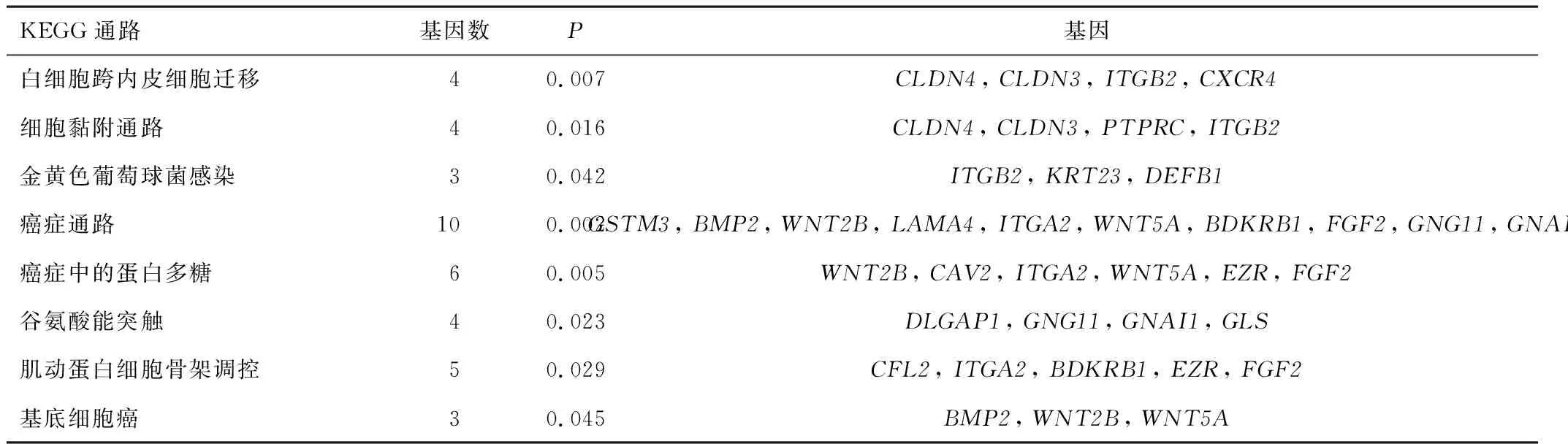
表2 卵巢癌DEGs的KEGG富集分析
2.3 构建PPI网络选择关键基因用String网站及Cytoscape软件,对211个DEGs分析制作PPI网络(图2)。用MCODE插件对筛选的关键基因进行网络模块构建,得到3个模块,其中第1个模块里包含15个关键基因,第2个和第3个模块各包含10个关键基因,共获得35个关键基因,见图3。
2.4 关键基因分析为分析35个关键基因与卵巢癌患者OS之间关系,使用Kaplan Meier plotter数据库。其中22个基因与患者的预后存在相关性,分别为:ATP6V1C1(H+转运-ATP酶C1亚基)、ATP6V1D(H+转运-ATP酶D亚基)、ATP6V1E2(H+转运-ATP酶E2亚基)、ATP6V1H(H+转运-ATP酶H亚基)、ATP6V1F(H+转运-ATP酶F亚基,又名VATF)、GNAI1(鸟嘌呤核苷酸结合G蛋白α抑制活性肽1)、GNG11(鸟嘌呤核苷酸结合G蛋白γ11)、GNB4(鸟嘌呤核苷酸结合G蛋白β肽4)、GNB1(鸟嘌呤核苷酸结合G蛋白β肽1)、CXCL12(C-X-C基序趋化因子12)、GNG2(鸟嘌呤核苷酸结合G蛋白γ2)、GINS1(GINS复合体亚基1)、GINS4(GINS复合体亚基4)、WDHD1(WD重复和HMG框DNA结合蛋白1)等14个基因高表达与患者总生存期下降相关(P<0.05)。而ATP6V1B1(H+转运-ATP酶B1亚基)、ATP6V1C2(H+转运-ATP酶C2亚基)、ATP6V0D1( H+转运AT 酶V0亚基d1,又名VATX)、GNB3(G蛋白β3亚单位)、CXCR4(C-X-C基序趋化因子受体4)、GINS3(GINS复合体亚基3)、MCM3(微染色体维持缺陷3关联蛋白)、MCM5(微染色体维持缺陷5关联蛋白)等8个基因低表达与总生存期下降相关(P<0.05),见图4,另外13个基因表达与患者总生存期无相关性。
用GEPIA数据库分析上述22个筛选出来的关键基因在卵巢癌和正常卵巢组织中表达情况,结果示ATP6V1F、GINS1、GINS4在卵巢癌组织中表达高于正常组织,而GNB3在卵巢癌组织中表达低于正常组织(P<0.05),见图5,其余18个基因在卵巢癌和正常组织间表达差异无统计学意义,或者与生存曲线表达趋势的结论相悖。
2.5ATP6V1F、GINS1、GINS4、GNB3在卵巢及卵巢癌组织中的表达及定位于The Human Protein Atlas数据库中获取ATP6V1F、GINS1、GINS4、GNB3在卵巢及卵巢癌组织中的免疫组化检测图像,结果显示,在蛋白水平上,ATP6V1F(抗体号:HPA062011)在正常卵巢中不表达,在卵巢癌中呈高、中表达,表达主要定位于肿瘤细胞的胞质和细胞核;GINS1(抗体号:HPA051185)和GINS4(抗体号:HPA024663)在正常卵巢中不表达,在卵巢癌中呈中、低表达,表达定位于肿瘤细胞的细胞质、细胞膜和细胞核;GNB3(抗体号:HPA040736)在正常卵巢中低表达,定位于细胞质和细胞膜,在卵巢癌中呈高、中表达,定位于细胞核,细胞质和细胞膜(图6)。因此 ,ATP6V1F、GINS1、GINS4这3个基因与它们的mRNA表达水平一致,其蛋白水平在卵巢癌组织中表达升高,而GNB3蛋白表达水平与其mRNA表达水平不一致,在卵巢癌组织中表达高于正常组织(P<0.05)。故将选择ATP6V1F、GINS1、GINS4这3个基因作为卵巢癌关键基因作为下一步继续研究。
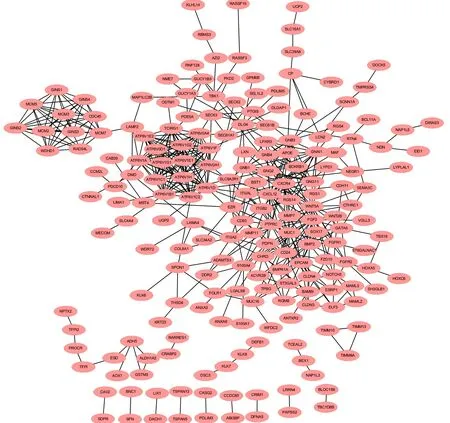
图2 卵巢癌与正常卵巢组织DEGs的PPI网络图
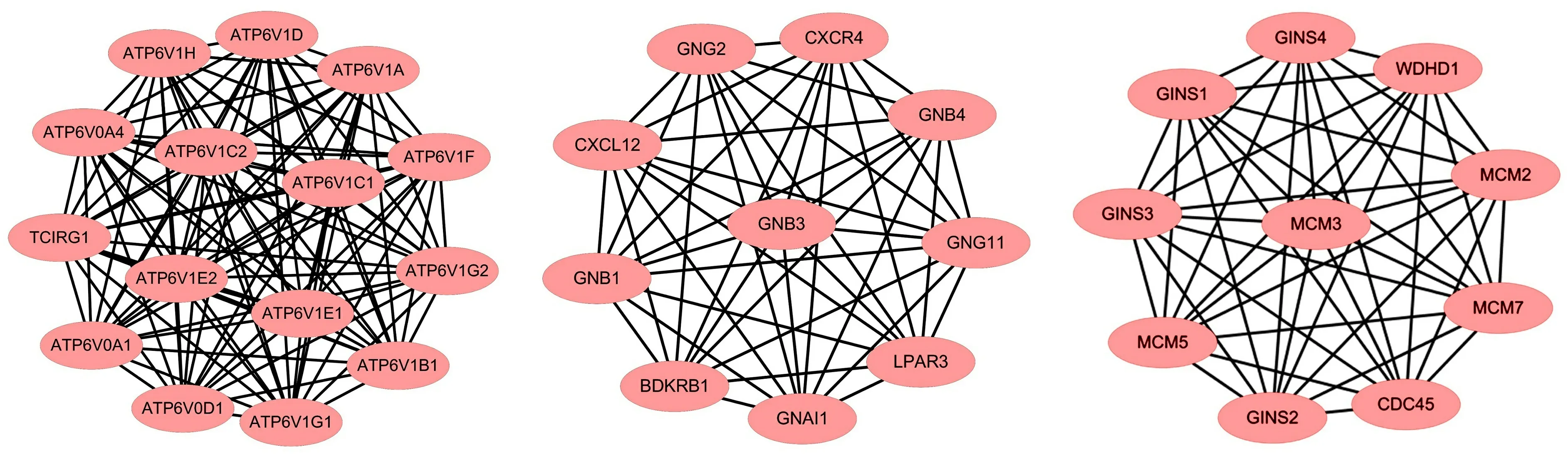
图3 关键基因模块图

图5 ATP6V1F、GINS1、GINS4、GNB3在卵巢癌和正常卵巢组织中的表达

图6 ATP6V1F、GINS1、GINS4、GNB3在卵巢癌和正常卵巢组织中的定位
3 讨论
全球范围内卵巢癌在妇科恶性肿瘤中的致死率都比较高[12],其中上皮性卵巢癌占卵巢癌的90%~95%[13]。而高级别浆液性癌是卵巢癌最常见的组织学亚型,占卵巢癌死亡的70%~80%[14]。本研究利用GEO数据库中的GSE14001和GSE14407数据集,比对了浆液性卵巢癌和正常组织差异表达基因。通过GEO中的GEO2R工具,筛选出211个DEGs。DEGs的GO和KEGG通路富集分析结果显示,它们集中在乏氧反应、间充质-上皮细胞信号传导、细胞黏附通路、癌症通路等方面,而这些过程或通路在恶性肿瘤的发生及演进过程中有促进作用,这已在许多种类恶性肿瘤中得到证实,包括卵巢癌。本研究通过PPI网络构建、Kaplan Meier plotter数据库、GEPIA数据库分析、The Human Protein Atlas 数据库等筛选,得到ATP6V1F、GINS1、GINS4这3个基因作为进一步研究的对象。
V-ATP酶广泛分布于真核细胞中,它分为两部分,包括位于细胞质部分V1和跨膜部分V0。V-ATP酶V1也被称为ATP6V1,它由A-H共8个亚基组成[15]。ATP6V1F基因属于ATP6V1家族成员之一,ATP6V1的主要功能是水解ATP,为运输氢离子提供能量。ATP6V1家族在肿瘤、肾脏疾病、骨骼发育异常和糖尿病等疾病中发挥着重要作用[16-17]。许多研究表明,ATP6V1家族成员在肿瘤组织或肿瘤细胞系中异常表达,比如:ATP6V1C1在口腔鳞状细胞癌中表达升高[18],ATP6V1A在胃癌组织中过表达,且与组织学分级、淋巴结转移、血管浸润有关。抑制ATP6V1A的表达可抑制胃癌细胞的增殖和侵袭能力,也可降低肝癌细胞的侵袭性[19]。ATP6V1C1通过激活mTORC1通路促进乳腺癌的生长,并促进乳腺癌的骨转移[20]。而ATP6V1F相较于正常肾组织,其在肾透明细胞癌中表达是降低的[21],这表明ATP6V1家族在不同的肿瘤谱中表达不太相同,具有组织特异性,这也提示其在不同肿瘤中的作用功能亦不相同。而ATP6V1家族与卵巢癌之间关系的研究未见报道。本研究显示ATP6V1家族中的ATP6V1F成员在卵巢癌组织中高表达,且与患者的预后不良相关,这与ATP6V1家族其他大多数成员在大部分肿瘤中的高表达和促进肿瘤进展作用的报道相一致,其具体作用机制需要进一步研究,有可能成为卵巢癌预后的潜在标志物。
GINS家族有4个成员,分别为GINS1、2、3、4,GINS1也被称为PSF1伴侣,与SLD5、PSF2和PSF3形成异四聚体复合物,该复合物对DNA复制起始和复制叉的延伸至关重要[22]。GINS1最初被发现主要在高增殖细胞中表达,而不是成熟细胞。每个GINS亚基的表达水平在不同的人类癌症中不同,对肿瘤的发生和演进起着重要作用。有研究显示:GINS1在乳腺癌、结直肠癌、肝细胞癌、神经胶质瘤等多种肿瘤组织中高表达,参与肿瘤的发生和发展。GINS1可通过usp15介导的TOP2A蛋白去泛素化促进胶质瘤细胞的增殖和迁移[23]。而GINS1在卵巢癌中的研究报道罕见,有研究者基于全基因组SNP微阵列芯片研究,仅发现在卵巢癌和乳腺癌中GINS1基因高表达[24],而缺乏该基因的临床及作用机制研究。本研究显示,在卵巢癌中GINS1在RNA水平和蛋白质水平均高表达,且GINS1表达高的患者总生存期更短,表明GINS1在卵巢癌中是个促癌基因,能促进卵巢肿瘤患者疾病的发生发展,对卵巢癌患者的预后有估测作用。The Human Protein Atlas数据库中显示GINS1在人正常唾液腺腺细胞中表达定位于细胞核,而在卵巢癌细胞中表达定位除了在细胞核中,还定位于细胞质和细胞膜,这种异常定位可能与其导致卵巢肿瘤恶性生物学行为有关。有研究显示GINS4在肺癌、胃癌、乳腺癌等组织中的表达水平明显高于正常组织,GINS4亚单位表达水平的增加与肺癌、乳腺癌不良预后相关[25-26],而几乎未见GINS4在卵巢癌中的研究。本研究结果显示,与GINS1研究结果相似,GINS4在卵巢癌中无论RNA水平还是蛋白质水平表达均升高,且高表达者患者预后不良,表明GINS4在卵巢癌中有促进肿瘤进展的作用,对患者预后有预测作用,可以试探性作为卵巢癌标志性分子进一步研究。GINS4在正常人唾液腺上皮细胞中主要定位于细胞核,其次定位于中心体。与GINS1相似,GINS4在卵巢癌中定位发生异化,可见于细胞质、细胞膜和细胞核,这也可能提示其致瘤作用的机制所在,为下一步研究其在卵巢癌中的作用机制提供研究方向。
总之,本研究通过多种大样本数据库层层筛选验证,ATP6V1F、GINS1、GINS4基因在卵巢癌组织中,无论是RNA水平还是蛋白水平表达均高于正常组织,它们表达的升高提示患者生存期更短。ATP6V1F、GINS1、GINS4有可能是卵巢癌预后不良的新标志物,需进一步研究。

