FDX1基因在乳腺癌中的表达及临床预后价值
叶露,张明芳,姜明强,张园园,孙萍,葛新
(郑州大学第一附属医院 乳腺外三科,河南 郑州 450052)
乳腺癌是女性最常见的恶性肿瘤,随着近些年发病率逐渐升高,乳腺癌已经成为女性癌症死亡的主要原因,严重威胁患者生命健康[1]。尽管随着手术、放化疗结合靶向治疗等手段的综合运用,近20年乳腺癌患者的生存获益和生活质量有了较大提高,但由于乳腺癌分型的特殊性,其治疗预后仍不尽如人意。《CSCO乳腺癌诊疗指南(2022版)》[2]提示目前中国乳腺癌患者总体5 a生存率已超过80%,其中北京、上海、广州等城市三甲医院早期乳腺癌的5 a生存率达到了90%以上。20年来,我国总患者数虽然在增加,但晚期患者比率在下降,早期患者的比率在增高[3]。因此寻找乳腺癌发生、发展的根本原因,进一步探讨乳腺癌发病的分子学机制,确定新的预测性标志物及潜在的治疗靶点仍是提高乳腺癌治疗的重要研究方向。
铜离子是生物体中必不可少的辅助因子,当其水平超过一定阈值时,就会对机体产生毒害作用[4]。过量的铜离子可以导致细胞死亡,但其机制尚不清楚。铜死亡是近几年研究者新发现的一种新的细胞死亡形式,区别于其他的细胞程序性死亡(如铁死亡、细胞凋亡等),铜死亡依赖于线粒体呼吸,其特征是细胞内游离铜积累,导致其蛋白质脂化,从而诱发细胞毒性应激,最终诱导细胞死亡[5-6]。目前已报道与铜死亡相关的基因有10余个,其中肾上腺皮质铁氧还蛋白1(ferredoxin 1,FDX1)是发现的最重要的正向调控因子[7]。FDX1是一种编码强效铜离子载体(elesclomol)的靶向蛋白,已知可将Cu2+还原为更具有毒性的Cu+。当FDX1基因被敲除后,能够赋予细胞更强的对铜诱导的细胞死亡的免疫力[8]。此研究说明铜与线粒体代谢的紧密关系,目前有关FDX1在肿瘤中的研究较少。本研究通过肿瘤基因表达图谱(the Cancer Genome Atlas,TCGA)公共数据集乳腺癌在线数据并对其进行分析,明确FDX1基因在乳腺癌中的表达情况,分析其对乳腺癌预后生存的影响,探讨FDX1作为铜死亡重要调控基因,是否可以作为潜在的预后预测因子和治疗靶点。
1 资料与方法
1.1 数据集收集采用Bioconductor中的TCGABiolinks函数包(https://bioconductor.org/packages/release/bioc/html/TCGAbiolinks.html)[9]和TCGA数据库(https://tcga-data.nci.nih.gov./Tcga/)[10]下载乳腺癌数据库mRNA表达的RNAseqTPM数据。分析整理临床资料及样本分型信息,最终收集TCGA数据集1 083例。
1.2FDX1表达与临床病理表征和预后的关系根据FDX1表达(中位数)将肿瘤样本分为高表达和低表达两组,分别分析FDX1表达与T(tumor)分级、N(nearby lymph nodes)分级、M(metastasis)分级、病理分级、组织学分型、雌激素受体(estrogen receptor,ER)表达、孕激素受体(progesterone receptor,PR)表达、人表皮生长因子受体2(human epidermal growth factor receptor 2,HER2)表达、PAM50、解剖肿瘤部位、放射治疗的相关性。PR、ER、HER2根据患者病理分级分为阴性(<1%)、中间(1%~9%)、阳性(≥10%)。Bc-GeExminer 3.0(http://bcgenex.ico.unicancer.fr/)[11]数据库在免疫组化水平上分析FDX1表达与ER表达、PR表达与HER2表达状态的相关性。采用Kaplan-Meier Plotter数据库(https://kmplot.com/analysis/)[12]进行在线生存分析。
1.3 免疫细胞浸润相关性分析采用Timer 2.0(http://timer.cistrome.org/)[13]在线分析FDX1表达与CD8+T细胞、CD4+T细胞、B细胞、巨噬细胞、单核细胞、中性粒细胞及树突细胞免疫浸润相关性,Rho代表相关系数,P<0.05表示差异有统计学意义。
1.4 基因介导通路预测及富集分析采用LinkedOmic(http://www.linkedomics.org/login.php)[14]在线分析系统,分析TCGA-BRCA(Firehose_RSEM_log2)数据集,皮尔森相关性检测,在LinkInterpreter中寻找Gene Set Enrichment Analysis(GSEA)分析工具,参照缺省参数设置进行富集分析,随机组合次数为1 000次,错误发生率(false discovery rate,FDR)<0.05的基因集被认为差异有统计学意义。
1.5 免疫组织化学免疫组织化学采用SP法染色。制作组织石蜡切片,烤片后行脱蜡、水化、枸橼酸盐高压抗原修复、过氧化氢去除内源性过氧化酶以及室温孵育10 min。加入一抗(FDX1,proteintech,稀释比例1∶200),4 ℃孵育过夜。第2天,PBS冲洗切片3次,每次5 min,加入山羊抗兔二抗,室温孵育45 min,PBS冲洗切片3次,每次5 min,配制足够的DAB显色液,显微镜下观察,显色1~3 min,再行苏木精复染,脱水,封固处理。
1.6 统计学分析采用SPSS 16.0软件进行统计分析。采用χ2检验分析FDX1表达与临床病理信息的关系。生存分析采用log-rank检验。P<0.05为差异有统计学意义。
2 结果
2.1FDX1表达与乳腺癌临床病理特征的关系在TCGA数据集中,相对比癌旁组织,FDX1在乳腺肿瘤组织中低表达。Bc-GeExminer 3.0数据库免疫组化结果提示FDX1在ER、PR、HER2阴性组高表达,见图1。进一步收集20例乳腺癌和正常乳腺组织,采用免疫组化的方法检测FDX1在乳腺组织中的蛋白表达水平,高倍镜下观察,FDX1在细胞质和细胞核中均有表达,FDX1阳性表达部位主要定位于细胞核周围的细胞质中。20例乳腺组织中,18例FDX1高表达,高表达率90%。肿瘤组织中未见FDX1阳性表达,见图2。基于TCGA数据库中临床资料,构建基线数据表,FDX1表达与ER表达、PR表达、PAM50表达情况有关(P<0.001),而与年龄、T分级、N分级、M分级、病理分级、HER2表达、组织学分型、解剖肿瘤部位、是否接受放射治疗均无关(P>0.05)。见表1。
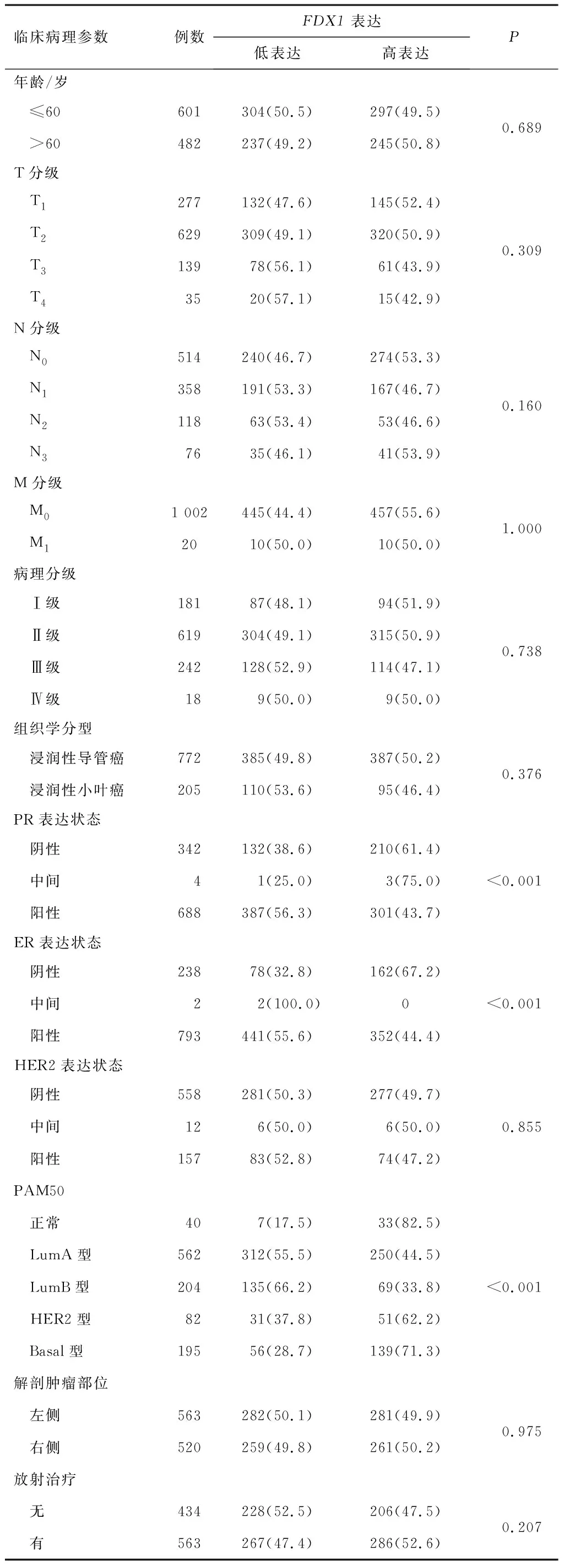
表1 FDX1表达与乳腺癌临床病理特征的关系分析 (TCGA数据集)
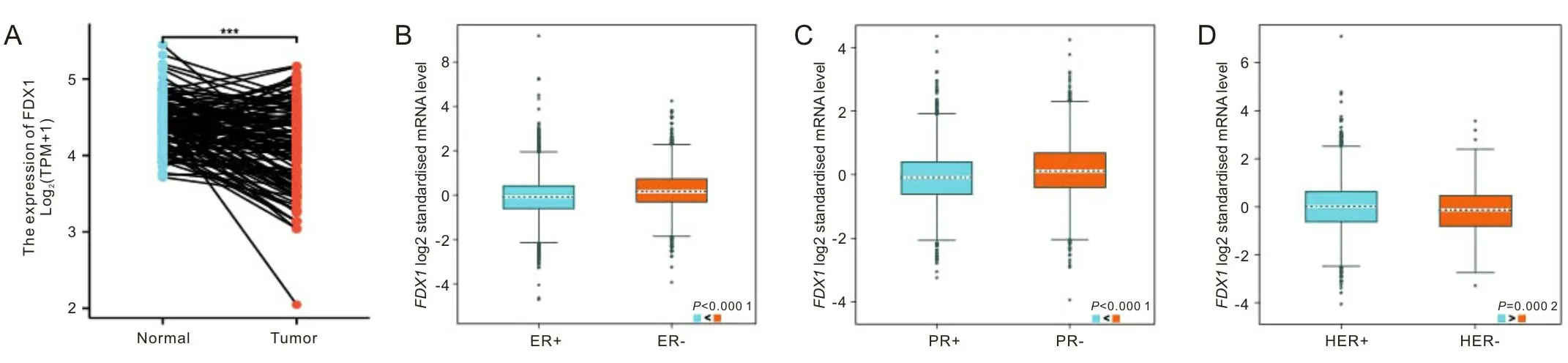
A为TCGA数据集中FDX1在乳腺癌和癌旁的表达;B~D为Bc-Geminer 3.0检测FDX1表达与ER、PR、HER2表达的关系。
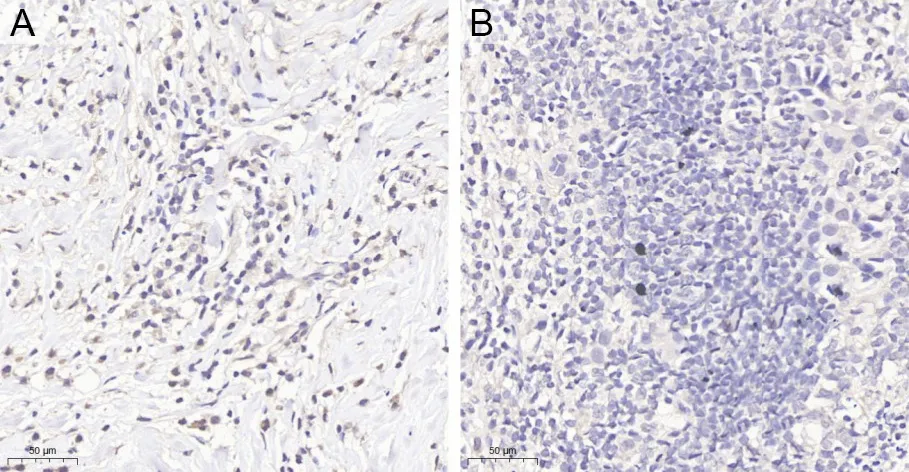
A为FDX1在正常乳腺组织中阳性表达;B为FDX1在乳腺癌组织中阴性表达。
2.2FDX1表达与乳腺癌预后的关系采用Kaplan-Meier Plotter对TCGA进行生存分析,包括总生存期(overall survival,OS)、无复发生存期(relapse-free survival,RFS)、无远处转移生存期(distant metastasis-free survival,DMFS)。在TCGA数据集中(n=943),根据FDX1表达中位数,将样本分为FDX1高表达及低表达组,FDX1低及高表达组乳腺癌患者的中位OS为69.7个月和136.8个月,两组差异有统计学意义(HR=0.6,95% CI:0.43~0.86,P=0.004)。TCGA数据集中(n=2 032),FDX1低及高表啊组乳腺癌患者的中位RFS为30个月和44个月,两组差异有统计学意义(HR=0.68,95% CI:0.58~0.79,P<0.001)。TCGA数据集中(n=2 765),FDX1低及高表达组乳腺癌患者的中位DMFS为222.8个月和236.2个月,两组差异有统计学意义(HR=0.68,95% CI:0.58~0.79,P=0.007)。见图3A~C。进一步分析了FDX1对三阴性乳腺癌预后的影响,结果如图3D~F结果所示,TCGA数据集中(n=201),两组中位OS差异有统计学意义(HR=0.5,95% CI:0.27~0.84,P=0.028),见图3D。TCGA数据集中(n=534),FDX1低及高表达组乳腺癌患者的中位RFS为32.1个月和28.2个月,两组差异无有统计学意义(HR=0.97,95% CI:0.72~1.32,P=0.862),见图3E。TCGA数据集中(n=424),FDX1低及高表达组乳腺癌患者的中位DMFS为27.1个月和48.1个月,两组差异有统计学意义(HR=0.6,95% CI:0.42~0.87,P=0.006)。见图3F。
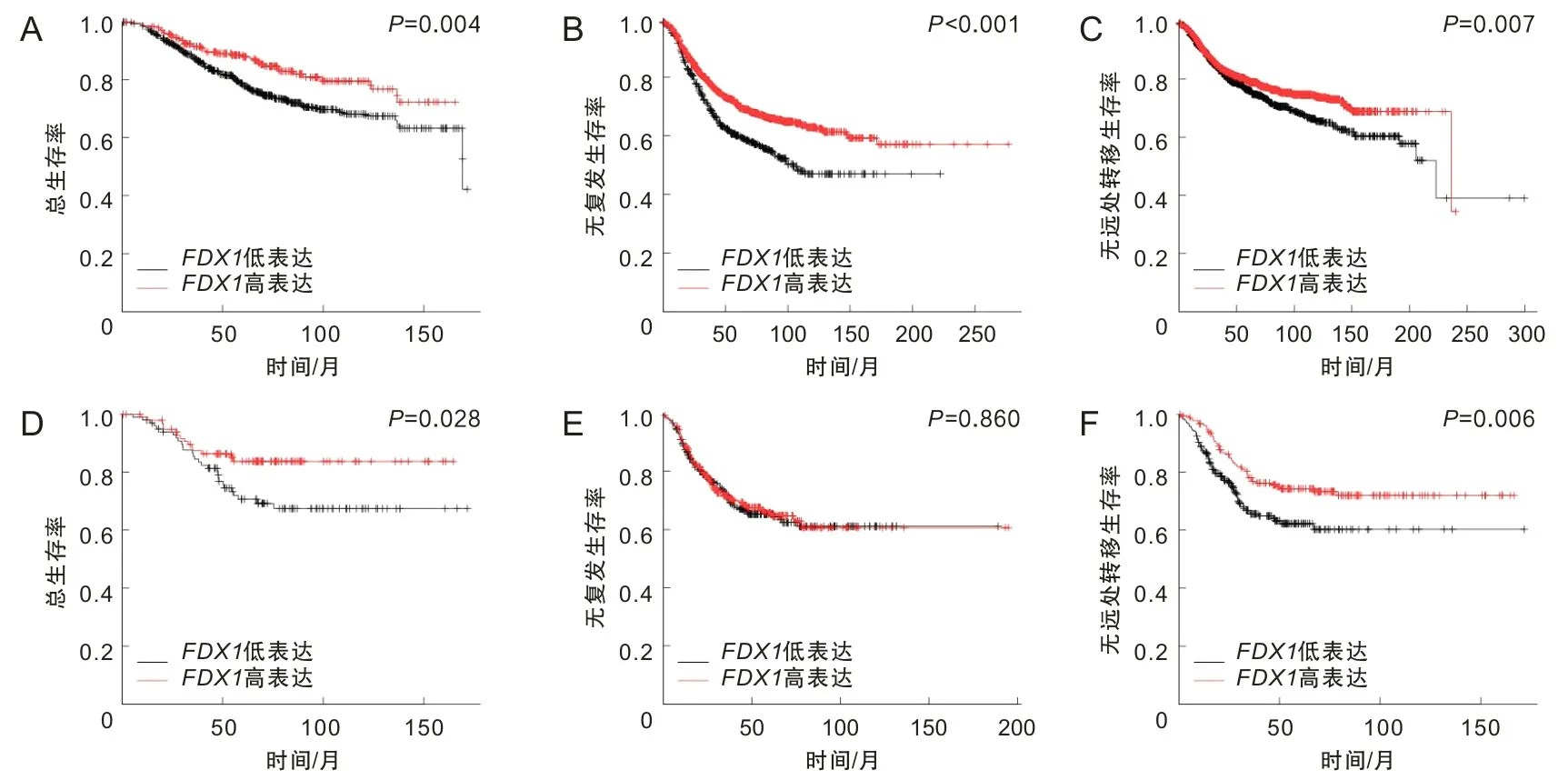
A为OS;B为RFS;C为DMFS;D为三阴性OS;E为三阴性RFS;F为三阴性DMFS。
2.3FDX1与免疫细胞浸润相关性的分析进一步使用Timer 2.0数据库在线分析FDX1对免疫细胞浸润性的影响,结果显示,FDX1表达与免疫细胞CD8+T细胞(Rho=0.157,P<0.001)、CD4+T细胞(Rho=0.105,P<0.001)、B细胞(Rho=0.114,P<0.001),巨噬细胞(Rho=0.103,P<0.001)、单核细胞(Rho=0.238,P<0.001)、中性粒细胞(Rho=0.323,P<0.001)及树突状细胞(Rho=0.118,P<0.001)免疫浸润呈正相关。通过使用GSVA R语言包分析TCGA数据库24种免疫细胞亚型在FDX1高表达和低表达组中乳腺癌患者的肿瘤免疫微环境中的差异。结果显示,FDX1高、低表达组间的调节性T细胞、细胞毒性T细胞、NK细胞、T helper细胞、Th1细胞、Th2细胞、TFH细胞、Treg细胞、嗜酸性粒细胞差异有统计学意义(P<0.05)。见图4。
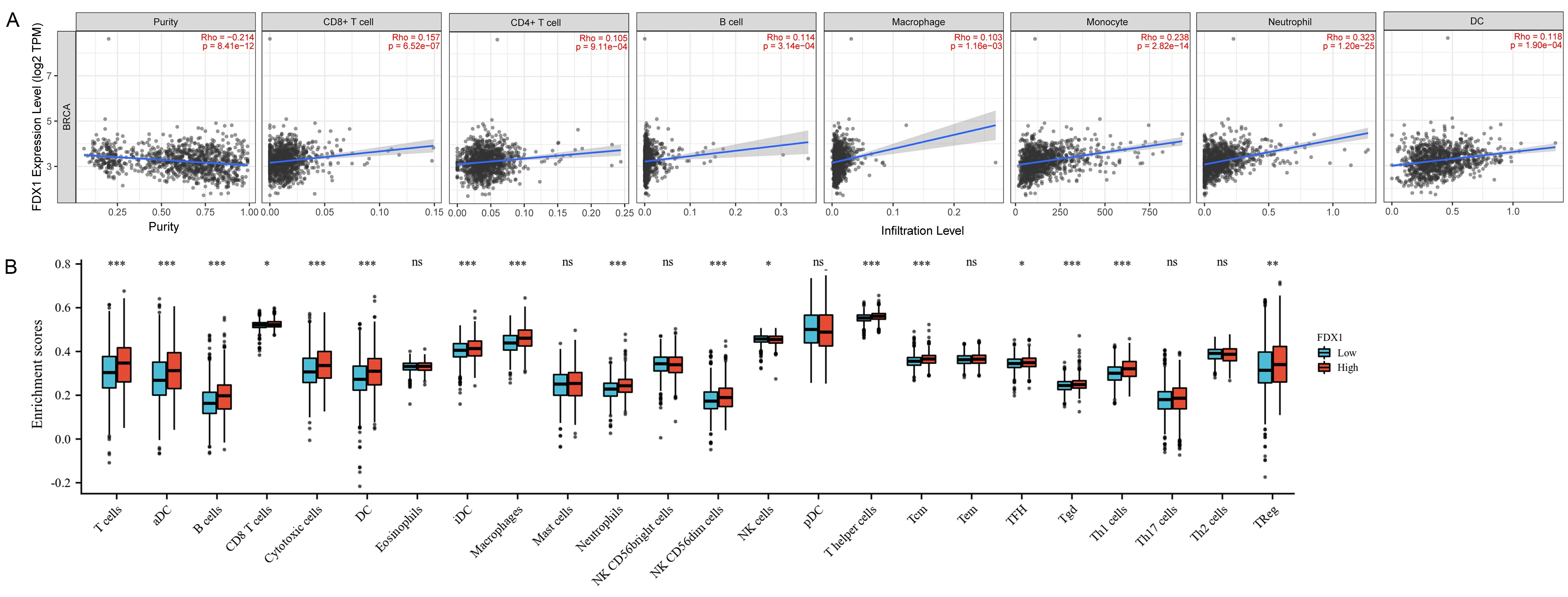
A为TIMER数据库检测FDX1表达与免疫细胞(CD4+T,CD8+T,B细胞,单核细胞,中性粒细胞,树突状细胞)免疫浸润的相关性;B为FDX1高、低表达组中24种免疫细胞亚型比率。
2.4FDX1的功能富集性分析进一步分析FDX1对相关功能机制的影响,结果提示FDX1对诸多生物学过程有影响,变化影响位于前3位的分别是核糖体(FDR<0.001,NES=2.35),氧化磷酸化(FDR<0.001,NES=2.19),帕金森病(FDR<0.001,NES=2.09)。见图5。
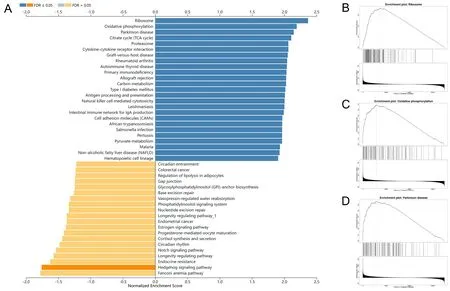
A为LinkedOmics分析结果;B为核糖体;C为氧化磷酸化;D为帕金森病。
3 讨论
铜是一种常见的金属元素,位于元素周期表第29位,是一种过渡性元素,具有氧化还原性,在自然界中常以Cu2+复合物存在,在常规化合物反应下,还原型Cu+可氧化为氧化型Cu2+[3]。二价铜离子可与多种酶结合,作为辅助因子参与蛋白的功能,调控机体的线粒体代谢、氧化还原反应等多种生理过程[13]。此外,机体内铜离子水平的动态失衡将导致细胞自噬功能异常,从而诱发铜离子介导的相关疾病的发生。因此说铜离子的稳定对于机体至关重要。2022年,Tsvetkov等[8]首次提出了“铜死亡(cuprotosis)”的概念,这是一种铜离子依赖的,新的细胞死亡方式,区别于现有的细胞死亡方式,包括细胞凋亡(apoptosis)、细胞焦亡(pyroptosis)和细胞坏死(necroptosis),铜死亡是一种金属离子诱导的调节性细胞死亡,现有的调节机制是Cu2+通过与三羧酸循环的脂酰化成分直接相结合,导致脂酰化蛋白聚集和铁硫簇蛋白的丢失,进而引发蛋白质发生毒性应激,从而发生依赖于铜离子调控的细胞死亡[14]。
FDX1编码一种小的铁硫蛋白,它通过铁氧还蛋白还原酶将电子从NAPDH转移到线粒体细胞色素P450,并参与类固醇激素的合成、维生素D和胆汁酸的代谢[15-16]。Tsvetkov等[8]的研究中,首次发现FDX1是铜死亡的关键调控因子,它可将Cu2+还原为更具有毒性的Cu+,并且它同时还是蛋白质脂酰化的上游调节因子。近年来研究发现,FDX1在多种肿瘤中表达异常,如在肺癌、肝癌、肾癌及结直肠癌等[17-19],但FDX1在乳腺癌中的表达尚未被阐明。尽管多数研究提示FDX1与多种肿瘤的发生、发展密切相关,但其表达与生存预后及调控机制仍不清楚,需要进一步探索。本研究首次通过TCGA数据库进行相关分析,发现FDX1在乳腺癌组织中低表达,其表达与肿瘤中的ER、PR、HER2表达以及PAM50密切相关,作为潜在的抑癌基因,其表达程度越高,相应的乳腺癌患者生存水平越好,该研究结果提示FDX1表达有望成为预测乳腺癌临床预后的指标。近年来研究发现,FDX1在肿瘤微环境同样发挥着重要作用[20],然而FDX1在乳腺癌中与肿瘤免疫浸润细胞的关系鲜有报道,因此本研究利用TIMER数据库检测FDX1表达与乳腺癌中免疫细胞浸润间的关系,结果显示FDX1表达与多种免疫细胞如CD8+T细胞、CD4+T细胞、B细胞、巨噬细胞、中性粒细胞、单核细胞、树突状细胞浸润呈正相关。该结果显示,在乳腺癌中FDX1与肿瘤细胞免疫浸润之间存在潜在的相关性,其具体调控机制仍需进一步探索。
在本研究中,利用GSEA技术预测发现FDX1的表达与多种生物学功能密切相关,其中包括较为重要的神经系统疾病阿尔茨海默病(Alzheirmer’s disease,AD)。脑是仅次于肝脏铜含量第2高的人体器官,在铜转运蛋白1与ATP7A转运下,铜离子可以穿过血脑屏障运输至不同脑区。在许多研究报道中,铜参与了神经系统中髓鞘的形成,并调节突触活动、信号级联反应以及神经元坏死功能。铜离子稳态失调可导致多种神经退行性疾病的发生,包括阿尔茨海默病和帕金森病[20-23],其潜在的研究机制为血清中含量较高的游离铜离子过载引起β淀粉样蛋白(amyloid-β,Aβ)沉积与Tau蛋白折叠异常[24]。Cu2+不仅可以促进β淀粉样蛋白无定形聚集体的形成,还可增强对该复合体神经元的毒性,其毒性远高于β淀粉样蛋白[25-26]。此外,多个研究证实铜代谢与肿瘤发生、发展密切相关,与正常细胞相对比,癌细胞对铜离子的代谢能力更强,对铜的需要更高[27-28]。乳腺癌患者表现出肿瘤组织铜金属水平增高和全身铜分布的改变[29-30]。Wang等[31]研究发现,阻断Cu2+运输可引起细胞氧化应激激活AMP活化蛋白激酶,从而导致脂肪生成降低,抑制肿瘤细胞的增殖。此外最近的研究表明,铜离子水平在新型冠状病毒肺炎(corona virus disease 2019,COVID-19)患者预后中有一定参考价值。武汉COVID-19患者全血微量元素的检测结果显示病情较重患者血清铜水平普遍升高[31]。早期感染COVID-19患者,其血清中Cu2+水平增加,且Zn2+水平降低[32]。Hackler等[33]研究也发现,COVID-19患者血清中铜离子和硒离子水平将有助于预测COVID-19患者预后指标。
综上所述,FDX1mRNA在乳腺癌中表达降低,其表达与乳腺癌多种临床表现指征相关,FDX1的表达也与乳腺癌的预后密切相关。此外,FDX1可以作为乳腺癌一种潜在的预后不良的肿瘤标志物,并可能参与肿瘤免疫微环境的调控,可能成为调节免疫抑制的新靶点,但具体机制仍需进一步实验验证与探索。

