牡蛎多糖制备工艺研究及体外抗氧化活性评价
林靖莹,黄姝玲,孟 鹏,陈毅斌,吴明玉,黄鹭强,陈慧斌,3,4
(1.福建师范大学生命科学学院,福建 福州 350117;2.福建省产品质量检验研究院,福建 福州 350002;3.福州海洋研究院海洋活性物质与制品技术研发中心,福建 福州 350117;4.福建师范大学福建省特色海洋生物资源可持续利用重点实验室,福建 福州 350117)
牡蛎又称为生蚝、海蛎子,隶属软体动物门、双壳纲、珍珠贝目、牡蛎科,是一种在全球沿海海域广泛分布的海洋经济贝类[1].牡蛎肉质细嫩、味道鲜美,营养价值极高,具有很高的药用和食用价值,含有丰富的优质蛋白、多糖、牛磺酸、多不饱和脂肪酸和微量元素锌等[2],素有“海洋牛奶”的美誉,是国家卫生健康委员会第一批批准的药食同源食品之一[3].已有研究表明,海洋资源中存在许多活性物质具有良好的抗氧化能力.海带多糖具有显著的体外抗氧化活性,具有较强的DPPH自由基、ABTS自由基及羟自由基清除能力[4];Yu等[5]发现海参多糖FUC-Ta对超氧阴离子自由基的抑制作用显著高于VC;而牡蛎多糖的功能结构复杂[6],常被用作抗癌药物的载体[7],在一些生物医学方面的免疫调节和癌症治疗上存在着密切的联系,具有一定的抗凝血作用和降低血脂、促进血液循环的功能[8],开发潜力巨大.
常用的牡蛎多糖提取方法为水提法[9]、碱提法[10]和酶解法[11].水提法主要利用对温度和时间的控制来提取多糖,提取工艺简单,生产成本较低;碱提法通过碱液的作用,破坏细胞结构,使多糖溶出,在一定程度上可以提高多糖的得率;而酶解法利用酶的专一性进行提取,提取效率高,提得多糖生物活性好.故采用单酶酶解法,提高牡蛎肉的水解度,安全性较高,并在此基础上减少生产投入.现阶段的分离纯化工艺有限,提取的多糖多是糖类和蛋白质的混合物,使它在生物医学方面的应用受限,需进一步优化纯化工艺.
本研究以新鲜牡蛎为原料,采用木瓜蛋白酶酶解牡蛎提取粗多糖,对牡蛎粗多糖中多糖和蛋白含量进行测定.通过脱蛋白处理和凝胶柱层析进行小量的分离纯化,得到纯化的牡蛎多糖,并通过抗氧化试剂盒及傅里叶红外光谱来分别测定分析牡蛎多糖的体外抗氧化活性及纯化牡蛎多糖的结构.为推进牡蛎高值化利用及扩大牡蛎多糖的应用面提供了一定参考依据.
1 材料与方法
1.1 实验材料
1.1.1 原料
新鲜太平洋牡蛎(Crassostreagigas):漳州元新食品有限公司提供.
1.1.2 主要试剂和仪器
木瓜蛋白酶(酶活800 000 U·g-1),购自北京索莱宝科技有限公司;磷酸二氢钾、磷酸氢二钠、无水葡萄糖、无水乙醇、苯酚、浓硫酸、三氯甲烷、正丁醇等均为国药集团化学试剂有限公司分析纯;牛血清蛋白,兰杰柯科技有限公司;Sephadex G-200,北京索莱宝科技有限公司.羟自由基测试试剂盒、抑制与产生超氧阴离子自由基测定试剂盒和总抗氧化能力(T-AOC)检测试剂盒,南京建成生物工程研究所;D-37520高速冷冻离心机,赛默飞世尔科技公司;DS-1高速组织搅碎机,上海美谱达仪器有限公司;STARTERS2100 pH计,美国奥豪斯仪器有限公司;X85-2恒温磁力搅拌器,上海梅颖浦仪器仪表制造有限公司;RE-5205旋转蒸发仪,上海亚荣生化仪器厂有限公司;ALPHA2-4 LD冷冻真空干燥机,德国Marin Christ公司.
1.2 牡蛎粗多糖的提取
参照孙克岩等[12]的方法,将新鲜牡蛎去壳洗净并沥干,用捣碎机将适量牡蛎搅碎,按1∶1的质量比加入Na2HPO4-KH2PO4缓冲液后,再按m(酶)∶m(底物)=4∶100加入木瓜蛋白酶,调节pH至6.0左右,放置在50 ℃的恒温水浴锅中酶解4 h.将酶解液置于离心机中,10 000 r·min-1离心10 min,取上清液旋转浓缩至上清液体积的1/3,用3倍体积的无水乙醇进行醇沉处理,于4 ℃冰箱中存放16 h.将醇沉后的样液置于离心机中8 000 r·min-1离心10 min,收集沉淀,在自然条件下烫漂获得牡蛎粗多糖.牡蛎粗多糖得率计算公式如下:

(1)
1.3 牡蛎粗多糖的纯化
1.3.1 牡蛎粗多糖的脱蛋白
参照张萍等[13]的Sevage法脱蛋白.称取2.00 g牡蛎多糖粗品,用蒸馏水将其溶解后定容至100 mL,再向其中加入Sevage试剂(V(氯仿)∶V(正丁醇)=5∶1)20 mL,使用磁力搅拌器缓慢搅拌1 h.反应结束将混合溶液于8 000 r·min-1离心10 min,离心后溶液分3层,最上层溶液呈淡淡的黄色,中央为絮状的变性蛋白,底层是有机相.取上层多糖溶液重复以上操作步骤直至无絮状蛋白沉淀析出则脱蛋白完成,记为脱蛋白牡蛎多糖.脱蛋白牡蛎多糖经稀释,通过Bradford法测定蛋白含量.
1.3.2 牡蛎粗多糖的Sephadex G-200凝胶柱层析
取适量Sephadex G-200凝胶干粉,加去离子水搅拌均匀,沸水浴1 h使其充分溶胀,冷却,除去悬浮杂质待用.层析柱底加水后装柱,用去离子水均衡24 h后再上样.称取20.00 mg脱蛋白牡蛎多糖,溶于2 mL去离子水,上样,去离子水洗脱,流速0.50 mL·min-1,自动收集器收集组分,苯酚-硫酸法跟踪检测,绘制洗脱曲线,观察峰型,根据显色反应结果合并主峰部位[14],透析,浓缩,冷冻干燥,记为纯化牡蛎多糖.由凝胶柱层析制得的纯化牡蛎多糖得率计算公式如下:

(2)
1.4 牡蛎多糖相关理化指标的测定
1.4.1 多糖含量测定
采用苯酚-硫酸法[15]测定牡蛎中多糖含量,蒸馏水溶解0.010 0 g葡萄糖标准品后,定容于100 mL容量瓶中.按梯度稀释,加入定量的5%苯酚和浓硫酸混匀,室温静置20 min后于490 nm处测定吸光度值,制备得葡萄糖标准曲线如图1,为y=16.706x-0.012 9,R2=0.999 8,成良好的线性关系.取2 mL稀释500倍的牡蛎粗多糖、脱蛋白牡蛎多糖及纯化牡蛎多糖样品于试管中,依次添加1 mL的5%苯酚和5 mL的浓硫酸,混匀后静置冷却至室温,将于490 nm处所测吸光度值代入葡萄糖标准曲线,计算得多糖含量.
1.4.2 蛋白含量测定
牡蛎多糖中蛋白含量测定采用Bradford法[16],称取0.100 0 g牛血清蛋白,取100 mL蒸馏水将其溶解后制备得0.10 mg·mL-1的牛血清蛋白标准溶液.按梯度稀释后加入5 mL考马斯亮蓝,于紫外分光光度计595 nm处测定吸光度值,制备得蛋白质标准曲线(图2)为:y=4.24x+0.028 43,R2=0.983 25,具有较良好的线性关系.分别移取1 mL定容稀释100倍的牡蛎粗多糖、脱蛋白牡蛎多糖样品溶液,各加入5 mL考马斯亮蓝,涡旋混匀2 min,于避光处静置5 min后,测定595 nm处样品的吸光度值,根据蛋白质标准曲线计算得到蛋白含量.
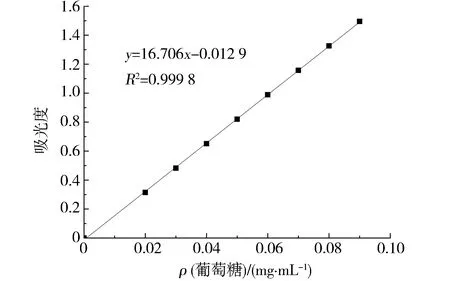
图1 葡萄糖标准曲线Fig.1 The standard curve of glucose
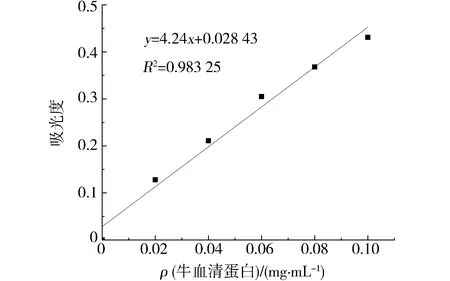
图2 蛋白质标准曲线Fig.2 The standard curve of protein
1.5 抗氧化能力的测定
选择牡蛎多糖提取纯化过程中制得的3种样品:牡蛎粗多糖溶液、脱蛋白牡蛎多糖溶液和纯化牡蛎多糖溶液,将多糖质量浓度均控制在1.70 mg·mL-1,分别使用羟自由基测试试剂盒、抑制与产生超氧阴离子自由基测定试剂盒和T-AOC检测试剂盒进行牡蛎多糖抗氧化能力的测定,按照试剂盒说明书方法进行操作,做3组平行试验,测得其抑制羟自由基能力、抗超氧阴离子自由基能力及总抗氧化能力.计算公式如下:
抑制羟自由基能力计算公式:
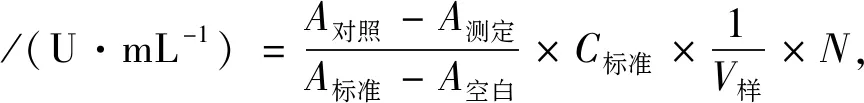
(3)
式中:C标准为H2O2标准品浓度,8.824 mmol·L-1;V样为取样量,0.2 mL;N为样本测试前稀释倍数.每mL样品在37 ℃下反应1 min,使反应体系中H2O2浓度降低1 mmol·L-1为一个抑制羟自由基能力单位.
抗超氧阴离子自由基计算公式:

(4)
式中:C标准为VC标准品质量浓度,0.15 mg·mL-1;N为样本测试前稀释倍数.每升样品在37 ℃反应40 min所抑制的超氧阴离子自由基相当于1 mg的VC所抑制的超氧阴离子自由基的变化值为一个活力单位.
总抗氧化能力计算公式:
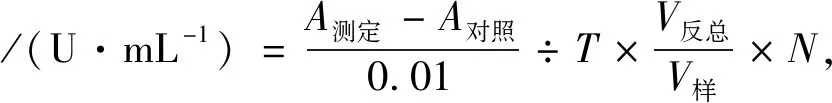
(5)
式中:T为反应时间,30 min;V反总为反应体系总体积,mL;V样为取样量,mL;N为样本测试前稀释倍数.在37 ℃时,每分钟每毫升样品使反应体系的吸光度值每增加0.01时,为一个总抗氧化能力单位.
1.6 红外光谱分析
采用红外光谱的结构分析方法[17],分析牡蛎纯化多糖中的官能团等结构.取2.00 mg的牡蛎纯化多糖,事先放置于红外灯下干燥,再称取适量溴化钾与其研磨均匀,压片机压片后取下,在傅里叶红外光谱范围400~4 000 cm-1、分辨率4 cm-1的条件下,测定样品在该区域内的吸收光谱.
1.7 数据分析
使用 SPSS 16.0 软件对数据进行统计学分析,并用 Origin 2018 软件绘图.
2 结果与分析
2.1 牡蛎多糖的制备
2.1.1 牡蛎多糖的提取及蛋白去除
牡蛎多糖是一种重要的活性物质,占牡蛎干质量的18%~39%[18],实验采用木瓜蛋白酶配合乙醇醇沉制备牡蛎粗多糖,测得牡蛎粗多糖得率约为3.69%,较曾臻等[11]使用水提法(1.25%)和热碱法(0.98%)提取牡蛎多糖得率有了显著的提高.通过苯酚-硫酸法测定不同稀释倍数下牡蛎粗多糖中的多糖含量,由表1可知提取的牡蛎粗多糖中多糖含量约为43.02%,蛋白含量约为0.52%.经Sevage法脱蛋白并进行浓缩醇沉操作,牡蛎多糖得率达到66.76%,多糖含量达到43.45%,且蛋白含量显著降低至0.05%.
2.1.2 牡蛎多糖的Sephadex G-200凝胶柱层析
采用Sephadex G-200凝胶柱对脱蛋白牡蛎多糖进行过柱处理,使用紫外分光光度计跟踪检测,牡蛎多糖洗脱曲线如下图3.图谱有2个明显波峰,为2种组分,编号LF1和LF2.LF1峰型小且含量低,相比之下LF2含量高且峰型宽,所以选择LF2多糖进行纯化操作.多次上样洗脱,合并LF2洗脱峰、浓缩、冷冻干燥得到纯化的牡蛎多糖粉末,洗脱后冻干,纯化多糖得率为0.64%(见表1).
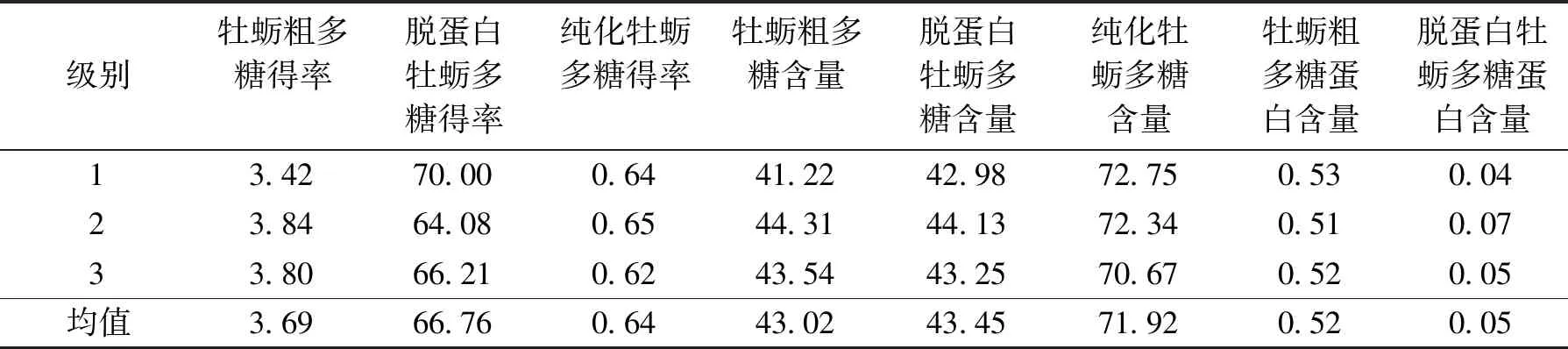
表1 不同处理阶段的牡蛎多糖得率及多糖、蛋白含量Tab.1 Polysaccharide yields and polysaccharide and protein contents of oysters at different treatment stages %
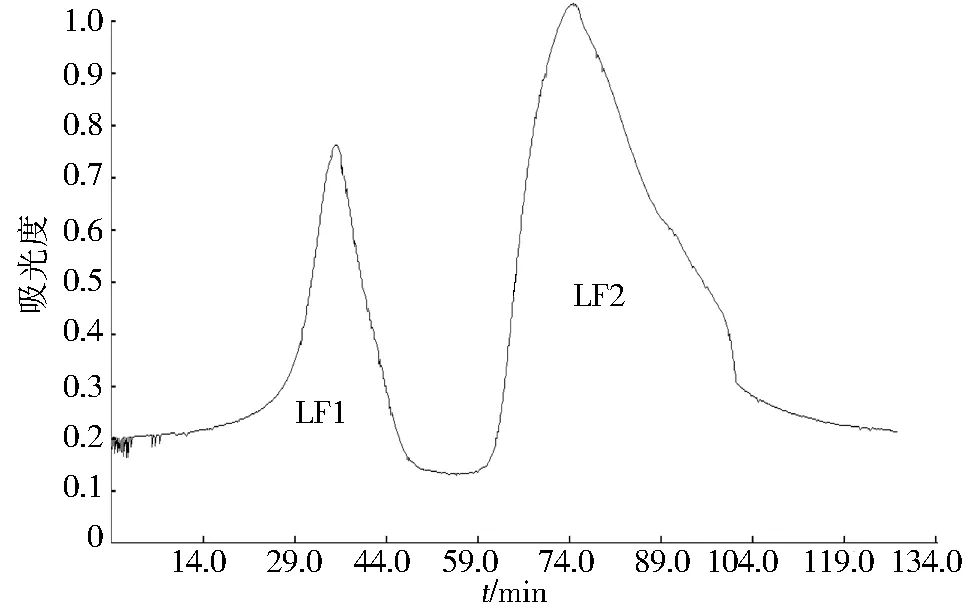
图3 牡蛎多糖洗脱曲线Fig.3 Elution curve of oyster polysaccharides
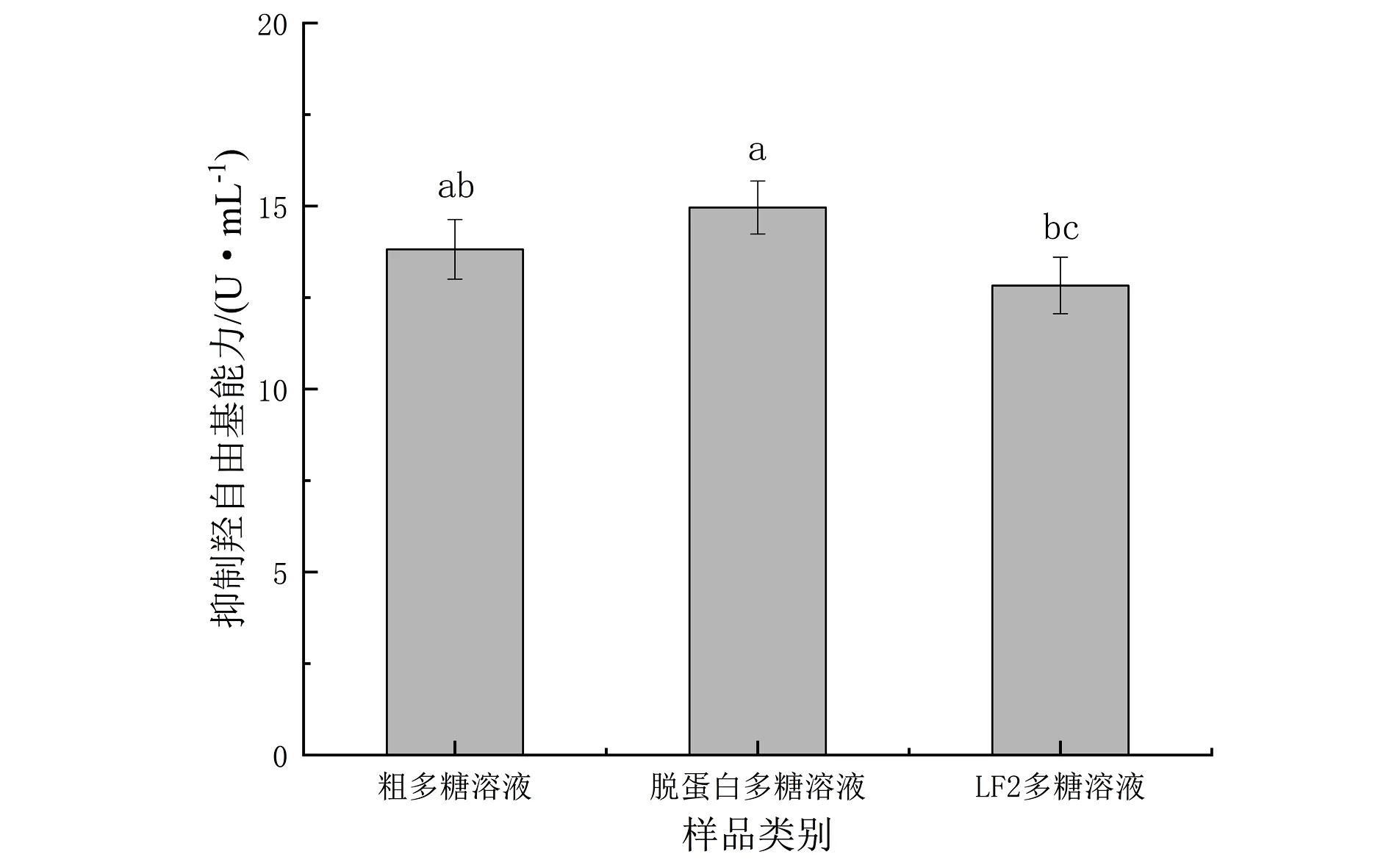
图中的不同字母表示具有统计学意义(P<0.05)图4 牡蛎多糖样品抑制羟自由基能力Fig.4 Hydroxyl radical inhibition ability of oyster polysaccharides samples
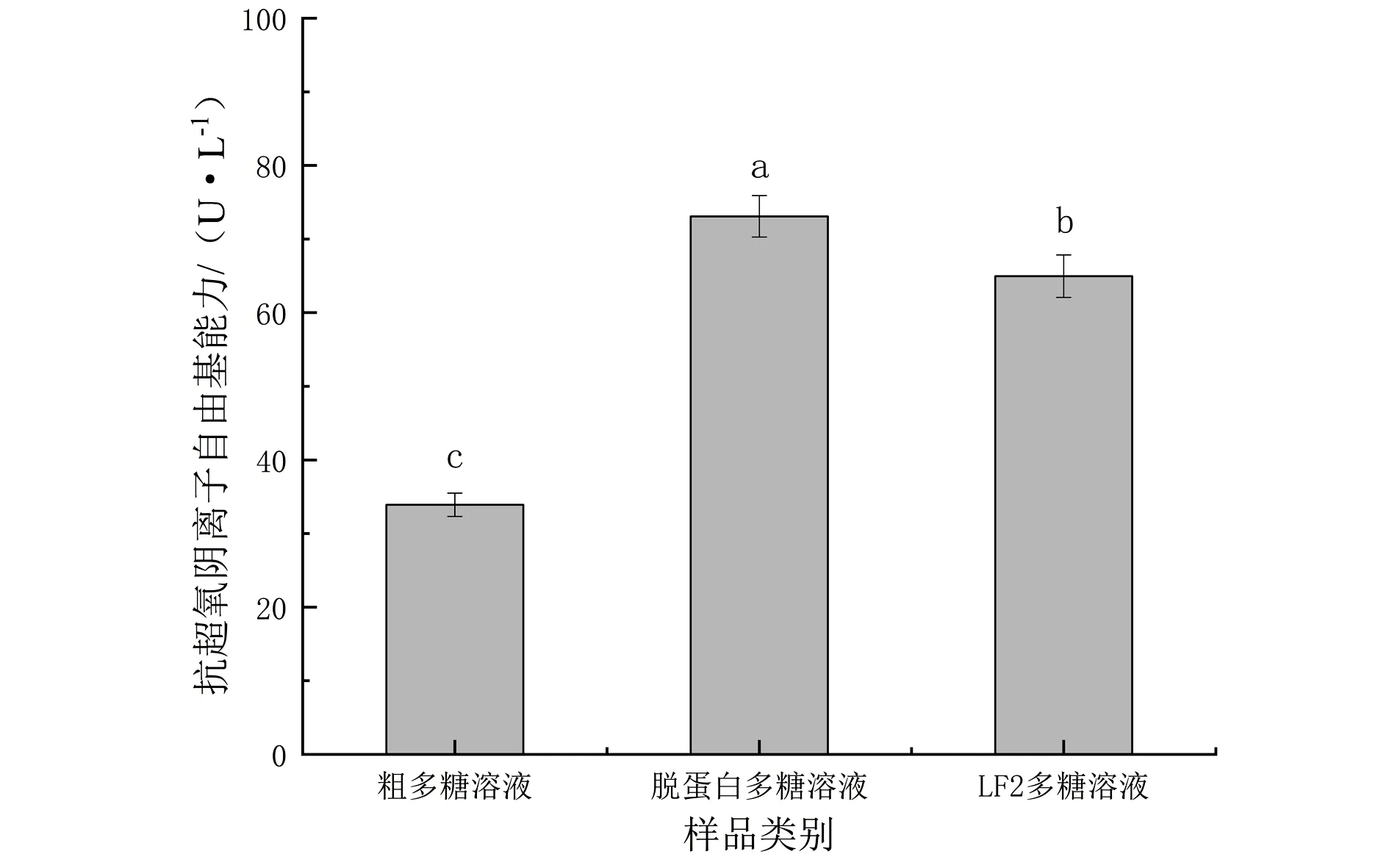
图中的不同字母表示具有统计学意义(P<0.05)图5 牡蛎多糖样品抗超氧阴离子自由基能力Fig.5 Anti-superoxide anion radical capacity of oyster polysaccharides samples
2.2 抗氧化能力
2.2.1 清除羟自由基能力
羟自由基是一种氧化能力很强,会危害体内组织的物质.过量的羟自由基是造成生物有机体氧化损伤的原因之一,会对人体造成一定程度的危害[19].牡蛎多糖抑制羟自由基能力测定结果如图4,3种样品抑制羟自由基的能力均在10~15 U·mL-1范围,LF2多糖溶液抑制羟自由基能力(12.83 U·mL-1)与脱蛋白多糖溶液抑制羟自由基能力(14.96 U·mL-1)相比存在显著差异(P<0.05),且较粗多糖溶液的抑制羟自由基能力(13.82 U·mL-1)虽也有所下降,但二者相比不显著(P>0.05).以上结果表明,牡蛎多糖具有一定抑制羟基自由基的能力,但经过一系列提取纯化操作后,丙氨酸等具有抑制羟自由基能力的氨基酸物质被除去,导致抑制羟自由基能力略有下降.
2.2.2 抗超氧阴离子自由基
2.2.3 总抗氧化能力的测定
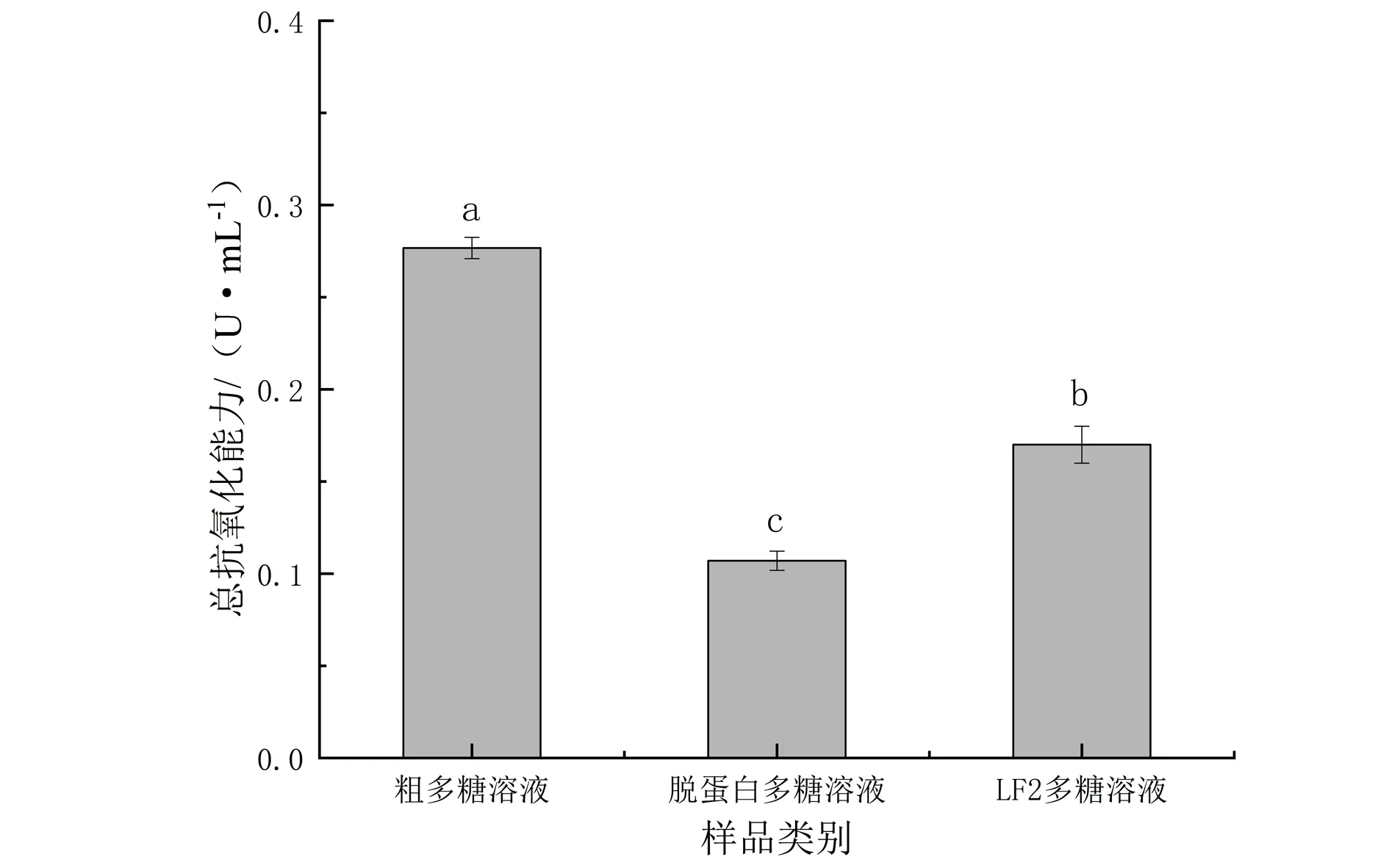
图中的不同字母表示具有统计学意义(P<0.05)图6 牡蛎多糖样品的总抗氧化能力Fig.6 Total antioxidant capacity of oyster polysaccharides samples
总抗氧化能力是反应机体抗氧化防御的重要指标之一[21],人体含有许多抗氧化物质,具备一定的还原能力,通过比色法的原理可以测定其还原能力的高低,试剂盒检测3种样品的总抗氧化能力结果见下图6.由图6可知,粗多糖溶液的总抗氧化能力最强(0.28 U·mL-1),其余2种样品的总抗氧化能力较粗多糖溶液均有显著下降(P<0.05).粗多糖溶液未经加工纯化,其中含有较多利于提高总抗氧化能力的组分,例如蛋白质和微量元素锌等,故它的总抗氧化能力显著高于脱蛋白多糖溶液及LF2多糖溶液(P<0.05).张剑等[22]的研究中发现纯化工艺有降低金针菇多糖的总抗氧化能力的趋势,且总抗氧化能力均低于抑制羟自由基能力和DPPH自由基清除能力,与本研究结果一致,针对此问题仍有待进一步探究.
2.3 红外光谱分析纯化牡蛎多糖LF2


表2 LF2的红外特征吸收光谱与分析Tab.2 FTIR analysis of functional group in LF2
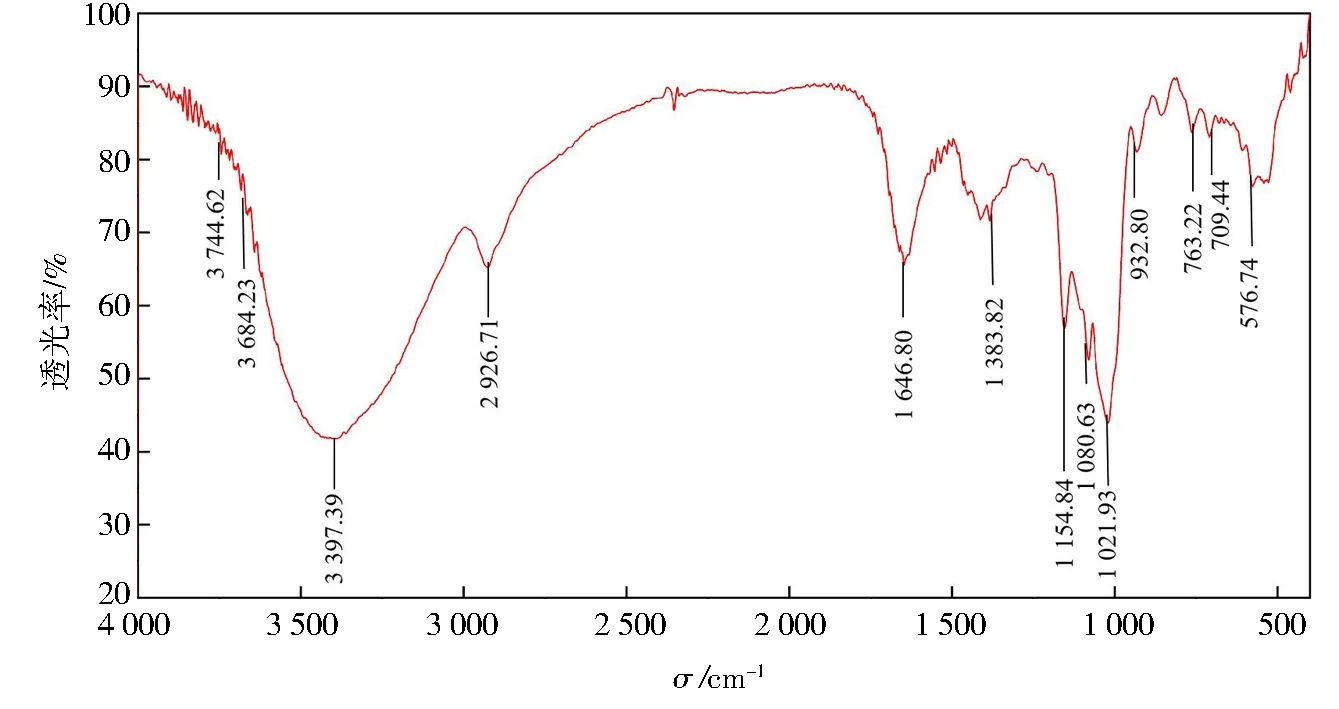
图7 LF2的红外光谱图Fig.7 FTIR spectrum of LF2
3 结论
研究通过木瓜蛋白酶在一定条件下对新鲜牡蛎进行酶解并通过乙醇醇沉的方法制备牡蛎粗多糖,使用Sevage法除去粗多糖中的蛋白质后,再经Sephadex G-200凝胶柱层析,可得到纯化后的牡蛎多糖LF2.而后对制得的牡蛎粗多糖溶液、脱蛋白牡蛎粗多糖溶液、纯化牡蛎多糖LF2这3种样品进行体外抗氧化活性测定,表明纯化的牡蛎多糖具有良好的抗超氧阴离子活力,可能是一种良好的超氧阴离子清除剂.经傅里叶红外光谱分析,纯化的牡蛎多糖LF2具备多糖类物质的相似吸收峰型,且含有吡喃糖苷3个特征吸收峰的结构和各种糖类特征基团,为α型吡喃糖.

