金属硫化物在电催化二氧化碳还原反应中的应用
许翠萍,阮铖涛,邢 舟,2,3,施源德,李忠水,2,3,,林 深,2,3
(1.福建师范大学化学与材料学院,福建 福州 350117;2.福建省高分子材料重点实验室,福建 福州 350117;3.福建省先进材料化工基础重点实验室,福建 福州 350117;4.近海流域环境测控治理福建省高校重点实验室,福建 福清 350300)
化石燃料的大量使用,导致CO2的排放量增大,从而引发了“温室效应”等一系列环境问题,对地球的生态系统造成严重的破坏,使生态平衡失调[1-4].为了解决大气中CO2含量持续增加的问题,我国在2020年提出了力争在2030年前CO2排放量达到峰值,2060年前实现碳中和的战略目标.目前为降低大气中CO2的浓度,科学家们提出了一系列解决方案,包括CO2捕获、封存或化学还原技术[5],其中化学还原方法包括光化学法[6-7]、热化学法[8]和电化学法[9]等.电化学催化法因具有条件温和、操作简便等优点备受关注,是未来实现碳中和战略最有效的途径之一.但CO2的分子非常稳定,是一种高度惰性的气体,通常需要一个较高的过电位来激活.因此,寻找具有高法拉第效率(FE)和低过电位的催化剂,对电催化CO2还原反应(eCO2RR)具有至关重要的意义.
近年来,科学家已经开发出多种类型的eCO2RR催化剂,例如金属材料[10]、金属氧化物[11-12]、核壳材料[13]、MOFs材料[14]、金属硫化物[15-17]以及二维纳米材料[18-19]等,其中金属硫化物因具有能带结构可调、电子转移快、电化学性能优异等特点[20-21],作为eCO2RR催化剂持续受到化学与材料科学工作者的关注.相对于金属氧化物,金属硫化物作为催化剂材料具有高稳定性、金属边缘活性和硫空位的协同效应等优势,对CO2电还原表现出更好的活性和更多的选择性,有望成为高效的CO2电还原催化剂的主要成分.另外,元素周期表中多数金属能与硫形成金属硫化物,但目前应用于催化CO2还原的金属硫化物大部分位于第四、第五和第六周期,不同周期的金属元素因自身电子结构的差异,对金属硫化物电催化性能影响显著.因此,本文将着重总结这3个周期的金属硫化物在eCO2RR中的研究发展现状,试图探讨硫元素对金属硫化物催化性能的影响及调控规律,并对其未来的研究发展方向提出展望.
1 第四周期金属硫化物
1.1 铁、钴、镍、锌硫化物
Li等[28]通过化学气相沉积合成了一种新型ZnS/Zn/ZnS三明治纳米结构,将ZnS纳米层涂到电极锌片上,可适当改变Zn单质的吸附能力,提高催化活性,从而实现对*COOH中间体的吸附,促进CO2的还原并抑制HER副反应的发生.在ZnS/Zn/ZnS催化剂中CO2还原的活性位点是催化剂表面的Zn原子,由于S原子接受Zn的部分4s轨道电子,使Zn与吸附物之间的电子密度显著增加,因此降低了*COOH的吸附能,有利于CO的生成.Nam等[29]使用两种不同的硫源,通过水热法合成了两种不同形貌的ZnS电催化剂,其中硫脲为硫源合成的ZnS纳米颗粒(TU-ZnS)在Zn箔上的形貌较为团聚,相比之下,硫代乙酰胺为硫源合成的ZnS(TA-ZnS)呈现出互连的珊瑚状形貌特征(如图2所示).这两种ZnS催化剂中,TA-ZnS的活性表面积明显更大,能够降低过电位,生成CO的FE可达80%,表现出良好的eCO2RR性能.目前对于Zn硫化物的研究仍相对较少,但现有的研究表明Zn硫化物在eCO2RR领域有着特殊的潜能,通过引入适量的S可显著改善其催化性能,但对其催化作用机理有必要做进一步深入的研究.
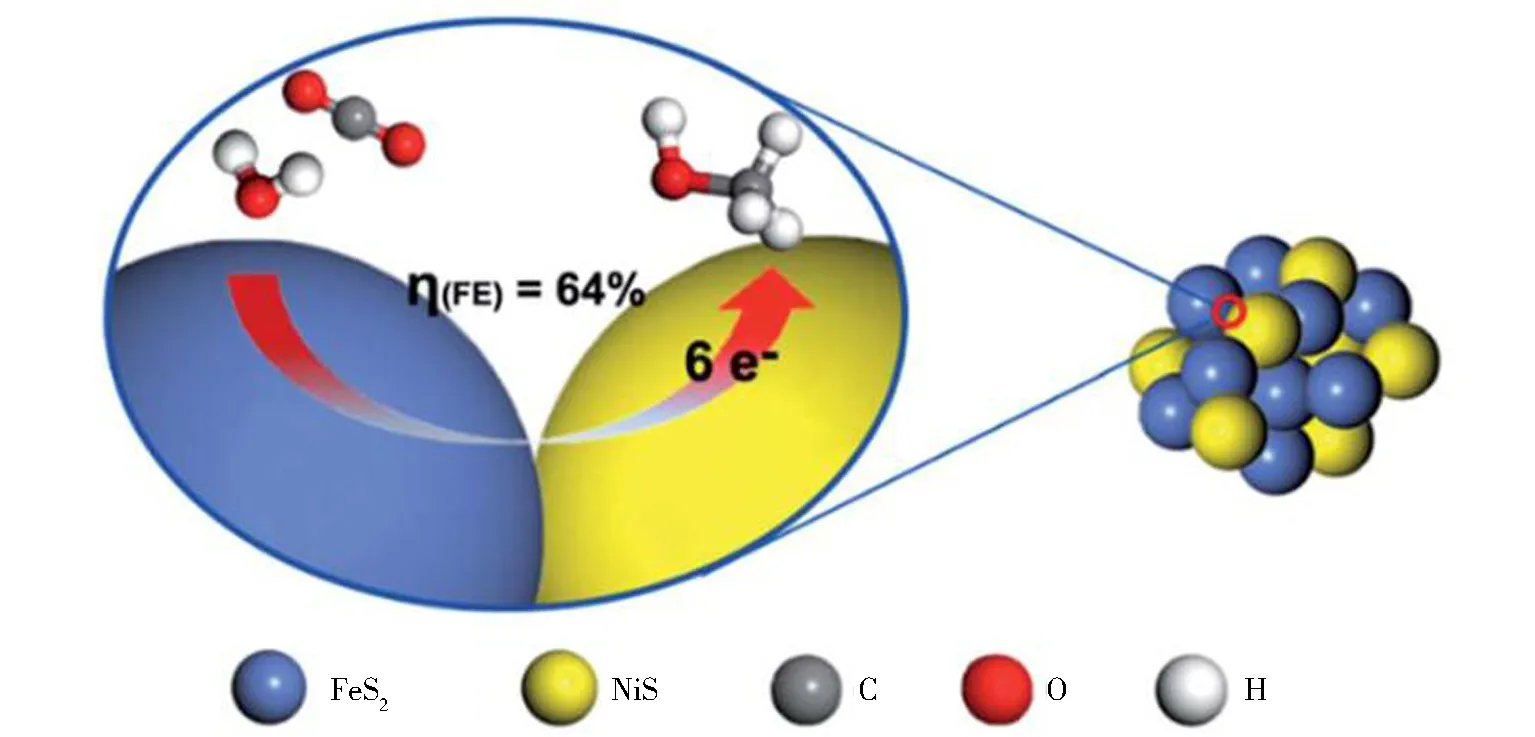
图1 FeS2/NiS纳米复合电催化剂电还原CO2的反应机理[15]Fig.1 Reaction mechanism of CO2 reduction by FeS2/NiS nanocomposite electrocatalyst[15]

图2 TU-ZnS (a,b)和TA-ZnS(c,d)的拓扑和截面SEM图[29]Fig.2 SEM images of topology and cross-section images of (a,b) TU-ZnS and (c,d) TA-ZnS[29]
1.2 铜硫化物
Cu基催化剂在电催化领域应用广泛,是目前唯一能较为高效电催化CO2还原产生碳氢化合物的催化剂,其在eCO2RR的应用研究最早始于1985年,Hori等[30]在对多种电极材料进行实验时,发现Cu及其氧化物修饰电极具有催化CO2生成乙烯、乙酸、乙醇等产物的特性.这是因为Cu基催化剂对中间产物具有中等的结合能,是一种能够通过多电子反应生成包括乙烯、丙醇等在内的C2+/3+化合物的特殊金属,同时也能有效抑制HER[31].由于硫原子和氧原子化学性质相似,Cu硫化物具有催化CO2生成甲酸及C2+/3+产物的高活性和选择性,近年来得到持续广泛的研究.Huang等[16]研究发现S掺杂对Cu催化剂的性能有一定的影响,表明S的引入显著改变Cu催化剂的选择性.特别是在一定浓度范围内随着S掺入量的增加,生成甲酸的电流密度和FE也逐渐增大,而生成H2的电流密度逐渐减小.从图3可见S掺杂Cu可以有效促进甲酸的生成,充分说明S和Cu的协同作用能够显著提高电催化CO2生成甲酸的选择性和稳定性.Wu等[32]报道了小尺寸CuS纳米颗粒被限制在氮和碳共掺杂的还原氧化石墨烯中(CuS/N,S-rGO),用于电化学还原CO2生成甲酸.实验表明,氮和硫的掺杂可以在石墨烯纳米片上形成丰富的活性位点,从而加速eCO2RR.CuS/N,S-rGO电极表现出对eCO2RR具有优异的催化性能,这是由于N,S-rGO与CuS之间的协同作用,石墨烯的存在可以提高复合材料的催化稳定性.该研究为制备eCO2RR铜基复合材料提供了一种简便、环保的方法.Deng等[33]通过比较活性CuSx(AC-CuSx)、脱硫CuSx(DS-CuSx)和裸Cu催化剂对CO2还原的催化性能,并应用密度泛函理论计算(DFT)来预测甲酸和CO生成的反应路径,以解释S在反应中的作用机理.研究发现甲酸产物是通过中间体HCOO*途径形成,CO则是通过*COOH中间体形成的.实验结果显示,AC-CuSx比裸Cu具有较低的生成甲酸起始电位,这主要是因为S掺杂的作用,当其覆盖范围增大时,会在更大程度上减弱对HCOO*的吸附.
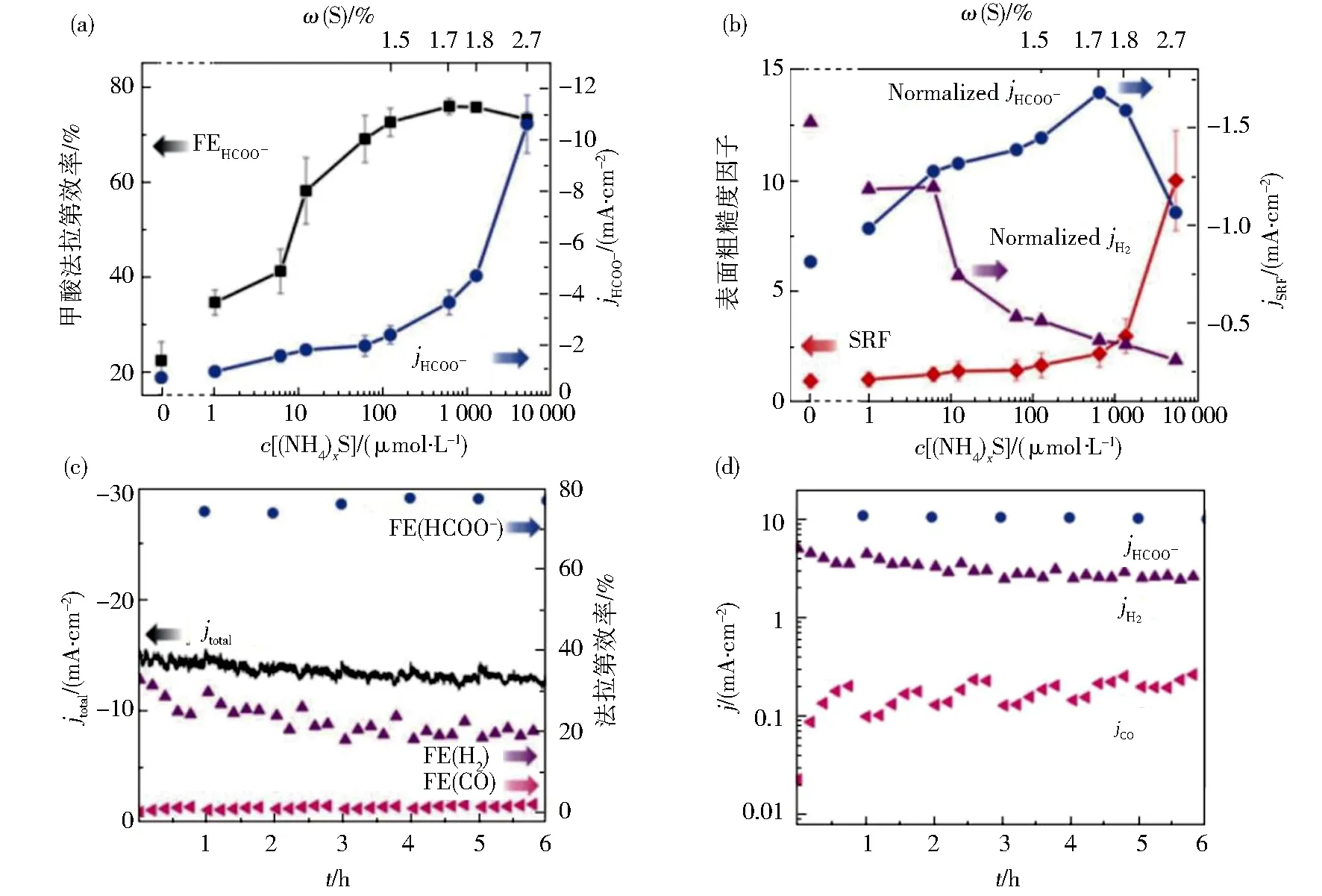
(a)甲酸法拉第效率及电流密度与前驱体多硫化铵的关系;(b)电极表面粗糙度因子(SRF)以及SRF归一化后甲酸、H2电流密度与多硫化铵浓度的关系;(c)使用Cu-5000 S(5 000 S表示多硫化铵浓度为5 000 mmol·L-1)电极材料电解6 h的CO2总电流密度以及甲酸、H2和CO法拉第效率;(d)在6 h催化稳定性实验中生成甲酸、H2及CO的分电流密度图3 S掺杂对Cu催化剂性能的影响[16]Fig.3 Effect of sulfur doping on the performance of copper catalyst[16]
He等[34]通过Cu2-xS脱硫和表面重构获得了具有丰富高折射率面的多晶Cu纳米颗粒(Cu-s).研究发现,在表面重构过程中出现的高折射率切面有利于赋予碳碳耦合的活性位点,从而提高C2H4的生成.在初始阶段使用Cu2-xS进行电催化CO2转化的主要产物是HCOOH,这是由于Cu晶格中存在S原子引起的,可以显著降低生成HCOOH的主要中间体HCOO*的吉布斯自由能.在这个阶段之后,随着S原子进入电解液,Cu2-xS开始被还原,导致Cu2-xS发生晶格塌陷,最后形成Cu-s.超过此阶段后,C2H4的FE随反应的进行逐渐增加,并在反应2 h后达到68.8%的稳定值.更重要的是,在随后催化反应的5 h中C2H4的FE几乎不变,这表明脱硫和表面重构在前2 h内已经完成,形成了稳定的催化结构.研究结果突出了Cu电催化剂结构与性能间的关系,为生成多碳产物电催化剂的设计合成提供了新的思路.离子空位被证明是一类非常有效的催化活性位点,可用于增强CO2活化和*C1吸附以生成C≥2的产物[35-37].例如,通过电化学还原产生表面氧空位的CuO将CO2转化为C2H4的FE为63%[37].因此,应用锂电化学调控方法来获得一系列具有可控的离子空位,作为电催化活性位点的新结构是一种很有吸引力的策略.Peng等[17]通过锂电化学调控方法在六晶相CuS中形成了双硫空位.双硫空位可以作为eCO2RR的电催化活性中心,使CO*和OCCO*二聚体稳定,并进一步耦合CO-OCCO形成正丙醇的关键*C3中间体.双硫空位CuS催化剂在H型电解池中生成正丙醇的FE提高到15.4%,在流动电解池中分电流密度提高到9.9 mA·cm-2.表1总结了不同铜硫化物的催化性能以及主要的结构与性能关系.
综上所述,元素周期表第四周期中,铁、钴、镍是同属于第一过渡系中的3种元素,它们的性质很相似,由3种元素所组成的催化剂主要是以析氢反应为主,但当与S反应形成相应的硫化物后,可通过S抑制析氢反应,提高eCO2RR的催化性能.而第四周期中铜是能够将CO2电化学还原为多碳产物的一种特殊元素,但选择性较差,把S引入到铜基催化剂中,能够有效提高铜基催化剂的选择性和稳定性.因此,该周期元素的金属硫化物(特别是Cu基硫化物)在eCO2RR领域中具有十分广阔的应用前景.

表1 铜硫化物催化剂结构性能关系Tab.1 Relationship of structure and performance of copper sulfide catalysts
2 第五周期金属硫化物
2.1 钼硫化物
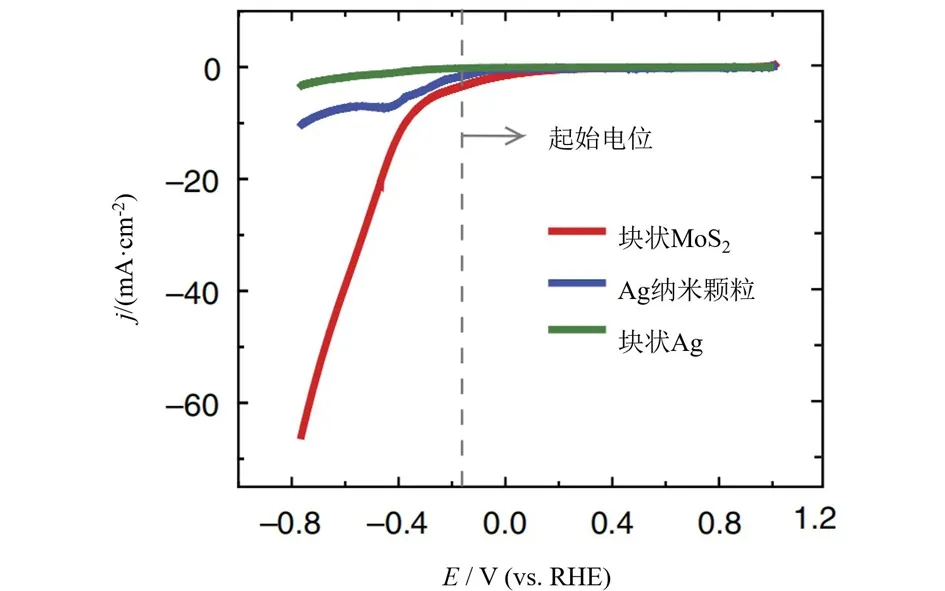
图4 MoS2、Ag纳米颗粒和块状Ag在CO2气氛中测得的循环伏安曲线[40]Fig.4 Cyclic voltammetry curves of massive MoS2,Ag nanoparticles and massive Ag measured in CO2[40]
二硫化钼(MoS2)是一种二维层状结构的过渡金属硫化物,由于其独特的电子、光学和催化性能,已在多个领域中得到应用[38-39].近年来的理论和研究表明,MoS2也是一种很有前景的,应用于eCO2RR的电催化剂.Asadi等[40]发现以Mo为边缘原子的MoS2拥有良好的电催化CO2还原性能.在物质的量分数4%的1-乙基-3-甲基咪唑四氟硼酸盐(EMIM-BF4)和物质的量分数96%的水组成的混合电解液中,因EMIM-BF4离子液体具有助催化性能,提高了生成CO的选择性.为了揭示EMIM+离子在CO2分子活化中的作用,他们对水中的[EMIM-CO2]+络合物进行了模拟研究,结果显示[EMIM-CO2]+通过C4/5质子结合得到的复合物更稳定,可以防止CO2转化为HCO3-和CO32-物种,并且CO2分子周围EMIM+离子的存在可以降低电子进入CO2的反应势垒.进一步系统的电化学测试分析发现,与贵金属Ag电极相比,MoS2作为电极材料具有更高的还原电流密度(图4),这是因为边缘Mo原子的电子密度比Ag原子高一个数量级,因此高的CO2催化还原反应可归因于MoS2催化剂和EMIM-BF4离子液体的协同作用.
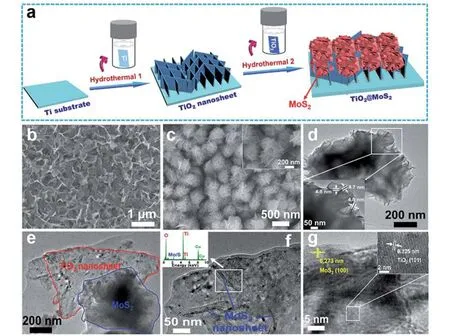
(a)TiO2@MoS2结构形成示意图;(b)TiO2纳米片阵列;(c)TM3结构的SEM图(插图为高倍SEM图);(d)MoS2的TEM图;(e)放大倍率下TM3的TEM图;(f)高放大倍率下TM3的TEM图(插图为所示区域的EDX光谱);(g)TM3的HRTEM图(插图是白色虚线部分的详细图)图5 3D多孔TiO2@ MoS2催化剂的合成及形貌[41]Fig.5 Synthesis and morphology of 3D porous TiO2@MoS2 catalyst[41]
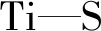
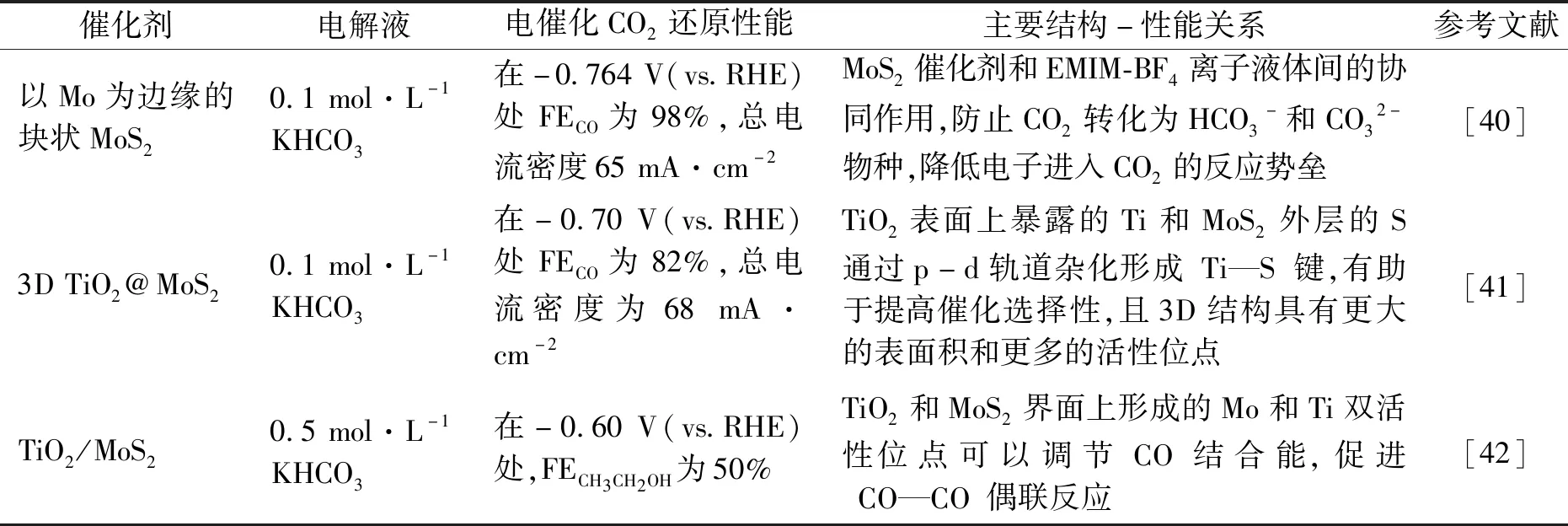
表2 钼硫化物催化剂结构性能关系Tab.2 Relationship of structure and performance of molybdenum sulfide catalysts
2.2 银、镉硫化物
银作为一种用途广泛的催化剂材料,早就在CO2的电化学催化还原中有所应用.但受其成本的影响,在工业应用中降低Ag基材料中贵金属含量将更具吸引力.因此为改变银基催化剂的活性和选择性,同时降低成本,引入其他组分是一种很有效的策略.Chen等[43]报告了一种Ag修饰的硫掺杂氮化碳/碳纳米管纳米复合材料(Ag-S-C3N4/CNT),用于有效地电催化CO2转化为CO,实验结果和计算结果表明,高效的eCO2RR性能来自Ag纳米粒子、硫元素、C3N4支架和CNT载体的协同作用.Zeng等[44]采用低温水热法在N和S共掺杂的还原氧化石墨烯上合成Ag2S纳米颗粒(Ag2S/N-S-doped rGO),用它作为催化剂,催化CO2转化为CO的选择性为87.4%,过电位为0.23 V.催化性能的提升可归因于Ag2S中的Ag+与掺N和S的rGO结合产生有效的活性位点,以及N和S共掺杂的rGO提高了催化剂的导电性和比表面积,从而加速了eCO2RR中的电荷转移.这种高效、耐用、高选择性和较低成本的催化剂为eCO2RR催化剂的开发开辟了一条新的途径.
CdS纳米材料由于具有活性比表面积较大、电子转移能力强等性质,引起了人们的极大关注[45-47],Qin等[48]制备CdS和碳纳米管(CdS-CNTs)组成的复合材料,所制备的样品具有可控的硫空位,且表面的硫空位随反应时间的增加而增加.硫空位的形成改变了催化剂表面的电子密度,降低了COOH*向CO*转化的能量势垒,提高了电催化生成CO的选择性(FE>95%).此外,Wang等[49]通过在Ti3C2表面制备具有富硫空位的CdS纳米颗粒,合成一系列二维层状结构的复合催化剂.具有良好导电性的二维骨架能够实现电子快速转移,改善电解液渗透,并增加电化学表面积,有利于富硫空位的CdS纳米颗粒附着在Ti2C3二维骨架表面,为CO2还原提供活性位点.
2.3 铟、锡硫化物
铟和锡同位于元素周期表的P区,含量丰富,且均是环境友好型金属元素.目前,这两类金属基材料作为eCO2RR制HCOOH催化剂已取得一系列进展,催化剂的活性、选择性、电流密度、稳定性等都在逐步提高.特别是Sn基电催化材料因其良好的活性、高选择性、无毒性等特点,被认为是选择性将CO2还原为HCOOH最有潜力的电催化剂之一[50].Xu等[51]通过简单的加氢辅助低温煅烧成功合成了亚稳相的SnS2催化剂,再通过相变工程将SnS2从半导体相(1T-SnS2)转变成半金属相(1H-SnS2).1H-SnS2中部分S原子消失,产生空位,其独特的原子结构,对eCO2RR表现出良好的催化活性,在抑制HER方面也具有显著的效果.与1T-SnS2相比,1H-SnS2具有很高的CO选择性,在-0.8 V时生成CO的FE高达98%,而1T-SnS2催化剂生成CO的最大FE仅为13.7%.同时,1H-SnS2的CO分电流密度也比1T-SnS2高,这表明1H-SnS2催化剂对CO2还原生成CO具有更优异的选择性.高性能的1H-SnS2催化剂为金属硫化物电催化剂在eCO2RR上的应用提供了一种新的选择,并展示了相变工程调节催化产物选择性的新策略.Ning等[52]利用氧化石墨烯(GO)为模板制备了二维In2S3纳米材料.二维结构与可控晶面的协同作用使In2S3催化剂在催化CO2电还原生成HCOOH方面具有良好性能.在宽的电位范围内,二维结构的In2S3与还原氧化石墨烯结合的复合物(In2S3-RGO)电催化生成HCOOH的FE远高于块状In2S3-RGO和块状In2S3.在-1.2 V(vs.RHE)下,块状的In2S3最高FE是26%,而二维In2S3-RGO的最高FE则是91%.此外,在-1.2 V(vs.RHE)下对催化剂进行稳定性测试,发现二维结构的In2S3-RGO催化剂表现出非常好的稳定性,在超过6 h的连续电解后电流密度没有明显衰减,生成甲酸的FE保持在85%以上.
第五周期中Mo、Ag、Cd 3种硫化物电催化CO2还原的产物以CO为主,而In和Sn两类硫化物则主要以生成HCOOH为主.这是因为前三者对*CO中间体的结合能较弱,有利于CO的生成,而In和Sn的硫化物能够优化HCOO*中间体结合能,降低反应势垒,从而促进催化中间体转化为HCOO-,进而催化生成HCOOH.
3 第六周期金属硫化物
3.1 钨、金、铅硫化物
钨与钼是同族元素,硫化钨(WS2)结构与MoS2结构相似,因此也可作为eCO2RR的电催化剂.Asadi等[53]报道了WS2纳米二维薄片材料及其电催化性能,通过与EMIM+相互作用,WS2纳米薄片在-50 mV的低过电位下电流密度可达18.95 mA·cm-2,生成CO的FE达到24%.与贵金属Ag相比,CO*在WS2上更稳定,这说明CO2在WS2纳米薄片上比在Ag上更有利于CO*的形成,且W边缘的d带中心比Ag(111)表面更接近费米能级,因此在更低的过电位下有利于CO的还原生成.金(Au)材料是将CO2电还原成CO的经典材料,它对CO的生成表现出特别高的选择性,这是因为Au表面与*CO中间体的结合较弱,很容易从表面解吸并成为主要的反应产物.Tan等[54]利用生物分子原位合成策略,在N掺杂的碳载体上合成了具有均匀S掺杂的Au纳米颗粒催化剂(S-Au/NC),它在-0.75 V (vs.RHE)时,生成CO的FE>95%,而Au/NC(不含S)的FECO仅为58%,说明S-Au/NC对催化CO2生成CO表现出较高的活性和选择性.这是因为S可通过降低电位来限制决定步骤(*COOH中间体的形成)的自由能变化,从而提高活性.铅硫化物在电催化CO2还原反应中也有所应用.Pander等[55]对电催化生成甲酸的活性与Pb形态间的关系进行了研究.他们通过还原PbS来制备硫衍生物(SD)-Pb,发现(SD)-Pb可沿边缘定向形成晶片结构,实验表明该晶片结构的存在有利于提高电催化生成甲酸的FE(高达90%)及活性.
3.2 铋硫化物
铋基材料是电催化CO2还原成甲酸产物很有前景的催化剂,因为铋能在速率决定步骤中显著降低反应所需的能量,提高催化材料的选择性.正是因为铋及其复合物具有低毒性、低成本、高稳定性且生成甲酸的高选择性等特点[56-58],铋硫化物近年来也得到研究者的广泛关注.Shao等[59]采用一锅水热法制备了Bi-Bi2S3催化剂,在-1.0 V(vs.RHE)电位下,甲酸的FE达85%,最大的电流密度为17 mA·cm-2,且具有良好的催化稳定性.Bi-Bi2S3催化剂中的Bi0可以在不影响催化性能的情况下提高硫化物的导电性,特别是和Bi2S3进行协同作用后,能提高催化剂在高电位下的催化选择性.Yang等[60]采用部分沉淀法制备了一种具有丰富缺陷位点和高效催化界面的Bi2S3-Bi2O3@rGO复合催化剂,可用于电催化CO2还原生成HCOOH,其所构筑的复合界面优化了中间产物HCOO*的结合能,降低反应的能垒,有利于HCOOH的生成.为了探究硫对催化剂的影响,他们还比较了不同硫含量催化剂的性能,结果发现适度硫化可以有效提高Bi2O3对eCO2RR的催化性能.为了进一步提高Bi基催化剂的选择性和催化活性,Shao等[61]报道了一种新的O和S共掺杂的铋催化剂(Bi2S3-0.075-D),氧和硫原子共掺杂改善了材料表面的电子结构,进一步影响了CO2的吸附和反应中间体的形成.与Bi2O3相比,Bi2S3-0.075-D的Bi 4f峰发生正移,这是因为S的电负性低于O,它会导致Bi2O3中Bi原子周围的电子密度发生改变,当Bi原子周围的电子密度增加时,有利于电子从催化剂转移到吸附的CO2,由此导致更快的中间体形成过程和更好的催化性能.Wang等[62]报告了通过引入S原子来调节二维亚碳酸铋Bi2O2CO3(BiOC)纳米片的电子结构.CO2还原反应的速率决定步骤是第一次电子转移到表面吸附的CO2*上,与O元素相比S的电负性较低,S掺杂可以提高Bi活性位点周围的电子密度(如图6所示),而Bi活性位点周围的高电子密度有利于第一个电子向表面吸附的CO2*转移.此外,富电子结构还可以加速H2O分子活化为H*,H*将吸附的CO2*质子化形成HCOO*中间体,然后HCOO*中间体接受另一个电子转化成甲酸并从催化剂表面解吸,由此产生较高的甲酸选择性.特别值得注意的是,当S掺杂的含量超过阈值时,Bi周围过量的电子密度反过来促进了HER.他们的研究结果进一步说明适量的S掺杂是调节Bi的电子结构,提高Bi基催化剂对CO2还原的电催化活性的一种有效策略.表3总结了铋硫化物催化性能与结构间的关系.总体而言,在铋基材料中S的适量引入能够提高Bi周围的电子密度,从而提高铋硫化物催化生成甲酸的性能.
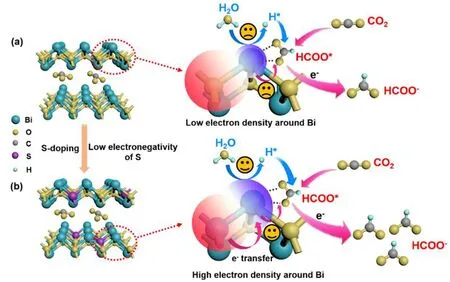
(a)BiOC;(b)S-BiOC图6 S掺杂促进CO2还原为甲酸盐的示意图[62]Fig.6 Schematic diagram of S doping promoting reduction of CO2 to formic acid [62]
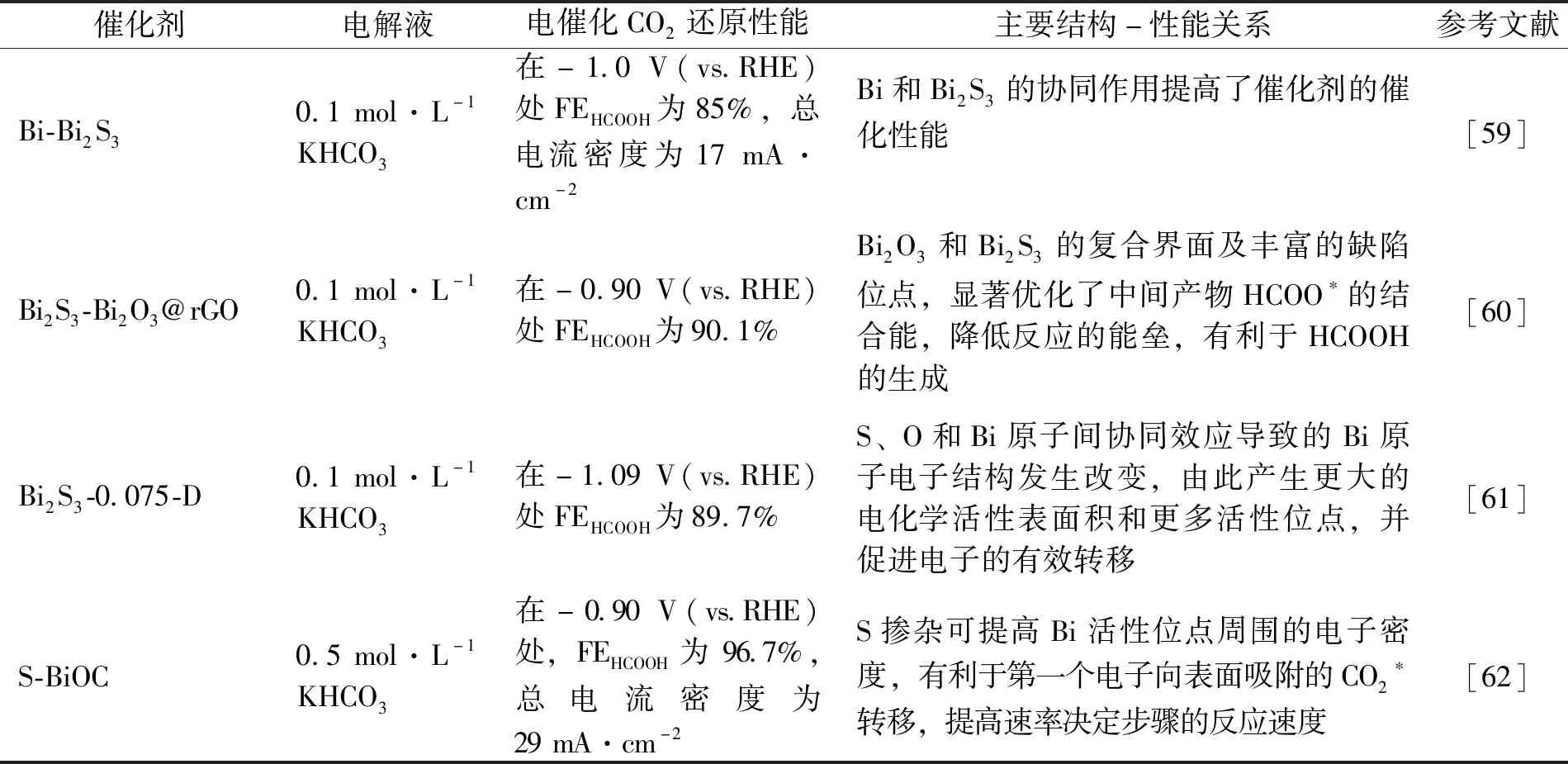
表3 铋硫化物催化剂结构性能关系Tab.3 Relationship of structure and performance of bismuth sulfide catalysts
第六周期中,W是良好的析氢材料、Au是贵金属、Pb对环境不够友好,导致三者的硫化物在eCO2RR上的研究和应用相对较少,这3类硫化物催化生成的产物主要是CO.Bi自身是一种优良的电催化CO2生成甲酸的催化剂材料,特别是与S掺杂后,可显著提高Bi活性位点周围的电子密度、增大电化学表面积,从而进一步提高eCO2RR的电催化性能.
4 总结与展望
金属硫化物在电催化CO2还原方面具有优异的性能,S组分的引入能够增强催化剂的稳定性,抑制催化剂失活,明显提高电催化的选择性,特别是S含量的调控能显著降低CO2活化分子的吸附能、降低还原电位并提高电流密度等,这都有利于在低能耗下实现电催化CO2还原转化,加上其广泛的来源和低廉的价格更有利于该类催化剂应用到未来的碳中和工业中.但迄今为止,金属硫化物在eCO2RR上突破性的研究和应用相对较少,特别是硫元素调控对eCO2RR催化反应机理的影响尚不清晰,如何解析硫空位的存在对催化性能的提升作用仍是一个待解决的难点;另外若要提高催化反应的效率,就需要进一步突破金属硫化物在第二代/第三代电解池中的有效应用;除此之外,金属硫化物在实际应用中会面临高浓度的强碱电解液体系,如何保障该条件下金属硫化物催化时的稳定性仍然是个棘手的问题.因此,今后需要进一步系统研究并开发活性面积大、催化位点多且结构可控的金属硫化物,并利用相工程调控等技术对电催化剂组分、相结构、形貌等进一步修饰改性,结合量化计算和原位表征等技术手段解析硫掺杂、硫含量调控、硫空位等对催化性能的影响规律和反应机理,以期获得高性能、低成本、高稳定性的金属硫化物,以应用于实现碳中和的目标.

