羊栖菜多酚的制备及抗氧化活性研究
王艳英,田周萍 ,康臆玲 ,陈慧斌 ,黄鹭强
(1.福建师范大学生命科学学院,福建 福州 350117;2.华南理工大学材料工程学院,广东 广州 510641;3.中山大学生命科学学院,广东 广州 510275)
羊栖菜(Sargassumfusiforme)是一类暖温带海域一年生大型海藻.羊栖菜中含的多酚具有抗炎、抑制肿瘤生长、降低血糖[1]、抗氧化[2]等活性.多酚是一种天然的强抗氧化剂,结构单元为间苯三酚,其中·OH作为褐藻多酚化学性质和生物活性的特征官能团,羟酚基可作为氢供体[3],参与氧化过程并产生自由基反应形成稳定羧酸或水,也可以在氧化起始阶段抑制自由基产生或与金属离子络合,从而发挥抗氧化作用[4].王君虹等[5]对微波-浸提辅助法羊栖菜多酚展开研究,在该工艺下羊栖菜多酚得率可达2.33%.蔡圣宝等[6]研究发现超声波提取法下不同因素条件对褐藻多酚提取率影响不同,其中对羊栖菜褐藻多酚浸提量影响最深的为料液比和超声功率.张丽斌等[7]为得到较为单一的组分,通过比较10种不同型号树脂的静态吸附量与动态解吸率,分析出型号为XDA-7的大孔树脂对羊栖菜多酚表现出较强的吸附与解吸能力,进而确定较为适宜的羊栖菜多酚大孔树脂柱层析工艺条件.
体外抗氧化活性的评估接近真实的物理环境,包括特定的pH、温度和环境湿度[8-9].其中,细胞氧化模型也已广泛运用于研究植物化学物质与人类健康有关的潜在机制[10],有效的抗氧化剂摄入可以保护机体免受自由基的影响,并调节氧化还原平衡[11-12].王长秀等[13]研究发现中、高用量的羊栖菜多酚对S-180荷瘤小鼠的瘤生长具有一定的抑制效果;有研究表明[14],褐藻多酚对受铅威胁的上海青生长及抗氧化系统起作用,能缓解铅对上海青造成的氧化损伤与毒害作用;Yang等[15]制备的螺旋藻-SeNPs在水溶液中可稳定保存3个月,可通过诱导细胞凋亡抑制癌细胞增殖.本研究以羊栖菜为原料,采用不同提取方法考察其制备方案,通过纯化获得多酚提取物,并测定其体外抗氧化能力,开展Caco-2细胞氧化损伤模型的抗氧化评价[16],可为拓展羊栖菜多酚的开发和利用提供参考依据.
1 材料与方法
1.1 材料与试剂
羊栖菜(Sargassumfusiforme),干制品,福建省水产研究所惠赠;Caco-2 (克隆人结直肠腺癌细胞),福建农林大学食品科学学院惠赠.
1.2 仪器
LGJ-10型真空冷冻干燥机,北京松源华兴科技;XH-300A型电脑微波超声波组合合成仪,北京祥鹄科技;DHL-A电脑数显恒流泵,DBS-100电脑全自动部分收集器,上海沪西分析仪器厂有限公司;RC600型旋转蒸发仪,凯恩孚科技(上海)有限公司;5418R型超高速冷冻离心机,EPPENDORF公司;OPTIMA型酶标仪,德国BMG FLUOstar;MCO-170AICDL-PC型细胞培养箱,日本Panasonic公司;388A 型-80 ℃超低温冰箱,青岛海尔集团有限公司.
1.3 实验方法
1.3.1 样品制备
将羊栖菜冷冻干燥30 h左右,用研磨机进行粉碎,过80目筛,包装于真空密封袋,称质量,保存至-20 ℃待用,得到粗多酚.
1.3.2 不同浸提方式和不同料液比对粗多酚浸出率的影响
根据不同浸提方式对粗多酚浸出率的变化影响,在料液比(1∶20)、乙醇(体积分数40%)、提取温度(70 ℃)相同的条件下,分别精确称量1.00 g羊栖菜粉末加入20 mL体积分数40%乙醇中,于水浴锅中浸提60 min,超声波提取30和60 min.取10.00 g羊栖菜粉末于200 mL体积分数40%乙醇中,在微波功率600 W下持续加热5 min.3 500 r·min-1离心10 min,重复3次,取上清液,稀释50倍.
同时,为比较不同料液比所带来的影响,配制350 mL的体积分数60%的无水乙醇,称取羊栖菜粉末2.00 g,依次按照料液比1∶5、1∶10、1∶15、1∶20、1∶25、1∶30、1∶35混匀.在超声功率200 W,70 ℃的条件下,浸提60 min.3 500 r·min-1离心10 min,取上清液并稀释50倍.
1.3.3 羊栖菜粗多酚浸出率的测定
采用福林酚法测定羊栖菜粗多酚浸出率,以没食子酸为标准品.分别吸取1.3.2中不同质量浓度溶液、蒸馏水和羊栖菜溶液各1 mL到10 mL的比色管中,在每个比色管加入5 mL的10%福林酚试剂,摇匀.反应3~8 min内,加入4 mL 7.5%Na2CO3摇匀.室温下放置60 min,在765 nm波长条件下用分光光度计测其吸光度值(A).以吸光度为纵坐标,没食子酸浓度为横坐标,绘制标准曲线,计算得出线性回归方程为Y=0.009 4X+0.083 7(R2=0.999 5).样品中多酚浸出率按照公式(1)计算.
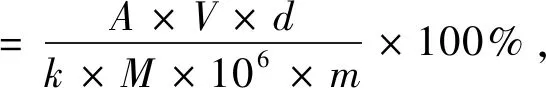
(1)
式中:A为待测液的吸光度,V为羊栖菜提取液体积,d为稀释因子,k为没食子酸标准曲线的斜率,M为样品干物质的含量(%),m为羊栖菜的质量(g).
1.3.4 羊栖菜粗多酚的纯化
1.3.4.1 大孔树脂吸附预处理
将XDA-7型大孔吸附树脂在体积分数95%的乙醇溶液中浸泡20 h,双蒸水清洗去除乙醇,后用5% HCl溶液洗涤大孔吸附树脂3 h,过滤保留大孔吸附树脂;洗至溶液呈中性,再用3~5倍大孔吸附树脂体积的NaOH(体积分数6%)洗柱3 h,洗涤沉淀大孔吸附树脂至流出液pH=7,过滤保留大孔吸附树脂.
1.3.4.2 浓缩
将羊栖菜多酚粗提液进行初步过滤并用旋转蒸发仪进行旋蒸,将旋蒸得到的产物缓慢加入250 mL蒸馏水,利用超声波将贴壁的多酚溶解下来,在11 000 r·min-1条件下离心15 min,取上清液,进行滤膜抽滤,取1 mL待测液进行梯度稀释,置于酶标仪中进行吸光值测定以确定待测液的含量.
1.3.4.3 上柱与回收
将羊栖菜多酚提取液用双蒸水稀释至3 mg·mL-1的质量浓度[17],用锡纸包裹层析柱,以1 BV·h-1的上样流速将羊栖菜多酚提取液上柱吸附,吸附完全用双蒸水冲洗直至流出溶液为无色.用体积分数60%的乙醇洗脱液进行洗脱,回收相应管洗脱液,后进行浓缩并冷冻干燥,称取适量冻干粉溶解于水得到样品母液,进行梯度稀释,利用福林酚法计算纯度.
1.3.5 抗氧化活性评价
为探讨羊栖菜多酚的体外抗氧化能力,以间苯三酚为标准品,Vc为参照物进行羊栖菜多酚体外抗氧化活性评价.
1.3.5.1 总抗氧化能力
将羊栖菜多酚、Vc、间苯三酚分别溶于双蒸水并进行梯度稀释,依次得到100~1 000 μg·mL-1的待测液,依据T-AOC检测试剂盒提供的方法检测总抗氧化能力.
1.3.5.2 抑制羟自由基能力
将羊栖菜多酚、Vc、间苯三酚分别溶于双蒸水并进行梯度稀释,依次得到100~1 000 μg·mL-1的待测液,依据羟自由基(·OH)检测试剂盒提供的方法测定羟自由基能力.
1.3.5.3 抑制超氧阴离子能力
1.3.6 Caco-2细胞评价羊栖菜多酚抗氧化作用
1.3.6.1 Caco-2细胞培养
克隆人结肠直肠腺癌细胞Caco-2用含有体积分数为10%胎牛血清的培养液,于37 ℃、体积分数5%的CO2条件下培养传代.
1.3.6.2 细胞活力测定
为了检测羊栖菜多酚对炎性细胞因子释放的影响,方法参照CCK-8检测试剂盒并略有调整.其中,设计实验组(细胞液+药物+CCK-8),药物颜色对照组(培养基+药物+CCK-8),空白组(细胞液+CCK-8),零组(培养基+CCK-8),实验组和空白组中加入100 μL细胞液,其他孔加入100 μL培养基,在加样孔的外圈加入PBS防止培养基蒸发.后将96孔板放入培养箱中培养过夜至细胞状态恢复稳定.实验组与对照组依次加入质量浓度为0、0.001、0.005、0.01、0.05、0.1 mg·mL-1的羊栖菜多酚、儿茶素、间苯三酚水溶液处理6 h,H2O2处理3 h,使用酶标仪测量D450 nm值.如细胞存活率大于等于90%,说明样品溶液没有细胞毒性,样品浓度安全[18].
1.3.6.3 血清的收集
细胞铺板6孔板,设计空白组(细胞液),刺激组(细胞液+过氧化氢),药物组(细胞液+药物)及药物对照组(细胞液+药物+过氧化氢),在每组加入1 mL细胞液,然后将96孔板放入培养箱中培养.在药物组和药物对照组中分别加入羊栖菜多酚、儿茶素、间苯三酚,刺激6 h,再向刺激组、药物对照组中加入H2O2刺激3 h.将每孔中的血清收集在EP管中,用于后续指标检测.
1.3.7 抗氧化酶指标检测
根据试剂盒提供的方法测定细胞培养上清液中的丙二醛(MDA)、过氧化氢酶(CAT)、总超氧化物歧化酶(SOD)、谷胱甘肽过氧化物酶(GSH-Px),评价羊栖菜多酚的体外抗氧化能力.
1.3.8 数据处理
通过SPSS软件中的单因素方差分析(ANOVA)对数据进行统计分析,结果以“平均数±标准差”形式表述,数据重复3次;所有图形采用Origin 2021软件进行绘制.
2 结果与分析
2.1 不同提取方法与不同料液比对羊栖菜多酚浸出率的影响
在相同料液比(1∶20)、相同溶剂(体积分数40%乙醇)、相同提取温度(70 ℃)的相同实验条件下,用超声波提取60 min所得浸出率最高,为12.47%(见图1a),表明超声波可增强对海藻中提取羊栖菜多酚的能力[19].由图1b得知,当料液比为1∶20~1∶30之间,浸出率大幅度上升,且料液比为1∶30时羊栖菜多酚浸出率最高,达7.65%,说明多酚与溶剂充分接触使大部分物质都被提取出.因此,在综合考虑下选取最佳料液比为1∶30.
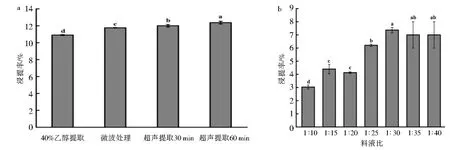
图1 不同提取方法与不同料液比对羊栖菜多酚浸出率的影响Fig.1 Effects of several extraction methods and different material-to-liquid ratios on how quickly polyphenols from Sargassum fusiforme
2.2 大孔吸附树脂分离羊栖菜多酚结果
收集流出液,280 nm测定吸光度,经XDA-7型大孔树脂柱层析纯化、冷冻干燥后的羊栖菜多酚质量浓度达29.94 mg·mL-1,纯度达到(21.45±0.56)%.
2.3 羊栖菜多酚的体外抗氧化活性能力
总抗氧化活性测定通常用于确定天然产品(如多酚和多糖)的抗氧化能力[20].以Vc和间苯三酚作为对照组,将羊栖菜粗多酚进行梯度稀释,测定不同浓度下的羟自由基的抑制率和超氧阴离子清除能力,结果见图2.在图2a可以看出三者的抑制能力都随浓度的增大而升高,羊栖菜多酚对羟自由基的抑制能力大于Vc和间苯三酚,表明羊栖菜多酚类含有大量酚羟基,具有很强的还原性,能够抑制氧化反应[21];超氧阴离子清除能力见图2b,在400~800 μg·mL-1范围内,羊栖菜多酚对超氧阴离子的清除能力呈现稳定上升状态,说明纯化后的多酚能有较强的清除作用.羊栖菜多酚的总抗氧化值为69.69 U·mL-1,体现出较好的抗氧化活性.
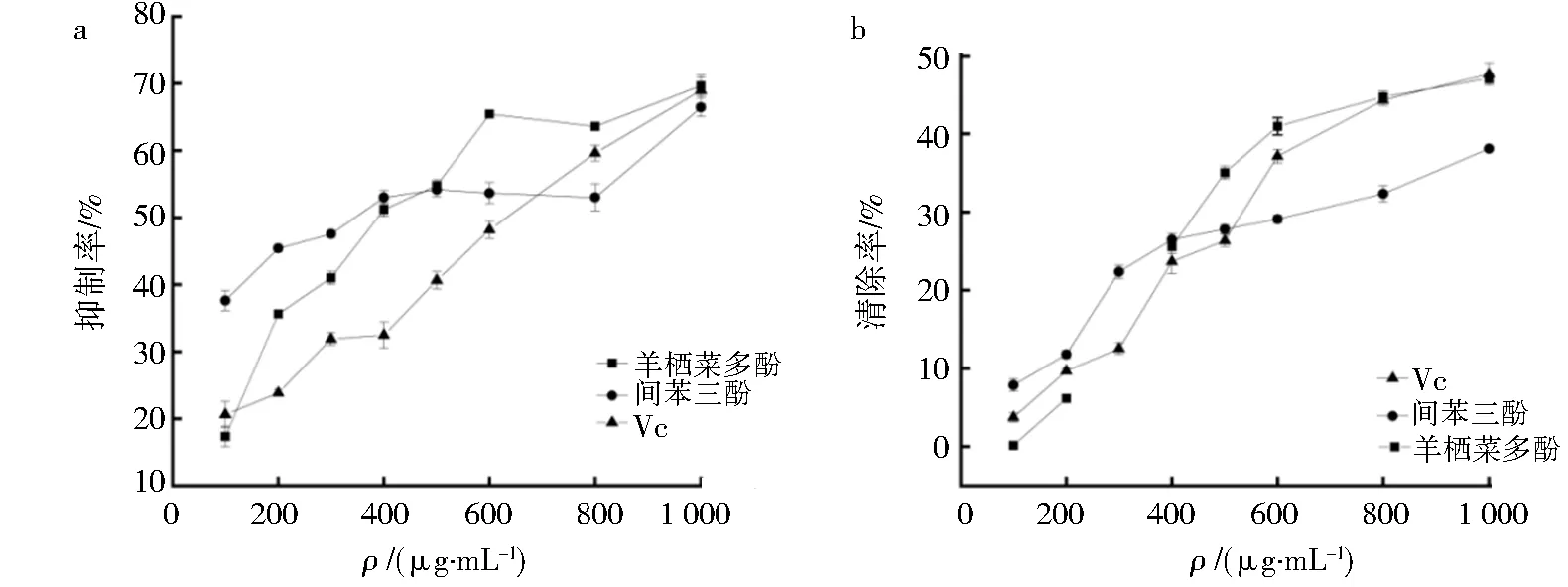
图2 羊栖菜多酚、间苯三酚、Vc对·OH抑制率(a)与清除能力(b)的比较Fig.2 Comparison of·OH inhibition (a) capacity (b)of Sargassum fusiforme polyphenols,m-benzotriazoles and Vc
2.4 羊栖菜多酚对H2O2诱导的Caco-2细胞活力的影响
为了检测羊栖菜多酚对炎性细胞因子释放的影响,选取0、0.001、0.005、0.01 、0.05、0.1 mg·mL-1质量浓度的纯多酚分别刺激Caco-2细胞,结果见图3.
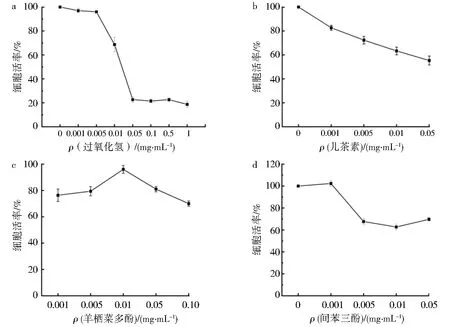
图3 CCK-8 法检测药物对Caco-2细胞活力的影响Fig.3 The effect of drugs on the viability of Caco-2 cells was detected by CCK-8 method
如图3a所示,添加不同质量浓度的H2O2处理Caco-2 细胞后,细胞活度明显下降,说明H2O2不仅能够直接氧化脂质和蛋白质,导致细胞损伤和死亡,提高其质量浓度还会导致对Caco-2 细胞的损伤;图3c为羊栖菜多酚,其诱导的Caco-2细胞活力均在80%~90%范围内,表明该质量浓度范围对细胞无明显的毒性,不会影响活力.从而选定0.01 mg·mL-1的质量浓度作为后续试验刺激条件,选择0.01 mg·mL-1的质量浓度作为间苯三酚后续试验刺激条件;选择0.005 mg·mL-1的质量浓度作为儿茶素后续试验刺激条件;选择0.005 mg·mL-1的质量浓度作为H2O2后续试验刺激条件.
2.5 羊栖菜多酚对H2O2诱导的Caco-2细胞氧化还原状态的影响
Caco-2细胞能够有力的与肠细胞壁的活跃膜运输联系,维护机体的氧化还原平衡[22].经过刺激处理后,MDA的浓度有明显上升,CAT、SOD和GSH-Px活性均有下降趋势.结果如图4所示.
经过H2O2诱导后,药物刺激组中MDA浓度较空白组高(图4a),最高为(13.86±2.83) nmol·mL-1,一般正常上清液MDA处于较低水平,而在受伤或应激细胞的上清液中,细胞受自由基的刺激产生大量的MDA;而药物处理组中羊栖菜MDA浓度(2.45±1.38)nmol·mL-1与空白组相比浓度较高,说明在细胞受到刺激时,先加入羊栖菜多酚的细胞能够较少产生MDA,减少细胞受到应激作用;CAT活力的增加与氧化应激的反应有关[23],在空白对照组中,药物处理组体内CAT活力值均显著升高,其中儿茶素处理组CAT值为(26.82±4.79)U·mL-1(图4b),在羊栖菜多酚的干预下,抗氧化酶活性显著升高,能够抵御H2O2对抗氧化防御系统的损害,这结果与Zhang等[24]研究的抗氧化活性一致.SOD可以预防细胞中的有害氧,图4c中各处理组SOD活力值均显著升高;GSH-Px是保护细胞膜免受脂质过氧化的主要抗氧化酶[25],通过和空白对照组GSH-Px活力值(2.33±0.21)U·mL-1相比,刺激组机体内GSH-Px活力值(1.37±0.45)U·mL-1显著下降(图4d),导致细胞引起损伤而使得谷胱甘肽氧化酶活力降低.
3 结论