脂肪酶催化微拟球藻磷脂制备二十碳五烯酸
兰 英,李韶峰,2,陈必链,2,何勇锦,2
(1.福建师范大学生命科学学院,福建 福州 350117;2.福建师范大学工业微生物教育部工程研究中心,福建 福州 350117)
微藻被认为是能进行光合作用的单细胞生物,其在淡水和海洋水生环境中都能生长,不与粮食作物竞争耕地[1].微藻富含蛋白质、脂质、多糖、维生素等多种生物活性物质,被广泛应用于食品、饲料、保健品、生物燃料等领域[2].中国卫健委(2016年)、欧盟新食品管理局、美国食品监督管理局等机构已批准微拟球藻、小球藻、螺旋藻、雨生红球藻、杜氏盐藻等藻种为新资源食品[3].在众多的海洋微藻中,微拟球藻(Nannochloropsissp.)具有生长速率快、油脂合成能力强、二十碳五烯酸(EPA)含量高等特点,受到微藻科技工作者的关注.众所周知,微拟球藻可用于生产可再生和可持续的生物柴油,在脂肪酶TL乙醇醇解催化下,微拟球藻(NannochloropsisoculataZ-1)生物柴油转化率高达90.24%[4].已有大量研究表明,EPA可预防或降低某些疾病的风险,如心血管疾病、癌症、炎症和精神疾病等[5-6].因此,微拟球藻是一种潜在开发EPA的海洋微藻.
前期的研究表明,微拟球藻合成的EPA主要分布在磷脂上.例如,Sánchez等[7]研究发现,微拟球藻合成的中性脂和磷脂的EPA含量分别为9.8%和24.2%.Mitra等[8]也发现,微拟球藻磷脂的EPA含量高于其所合成中性脂和糖脂的EPA含量.因此,本研究拟利用微拟球藻磷脂开发EPA.
目前,市售的EPA主要是乙酯型EPA.因此,亟需研发一种可将微拟球藻磷脂EPA转化为乙酯型EPA的绿色经济的方法.化学法和脂肪酶法是当前制备乙酯型EPA的常见方法.化学法制备乙酯型EPA往往需要酸碱试剂、高温、长反应时间等条件,会氧化EPA,影响目的产物的品质[9].与化学法不同的是,脂肪酶催化制备乙酯型EPA是将含有EPA底物在脂肪酶的作用下发生乙醇醇解反应获得乙酯型EPA,具有反应条件温和、催化效率高等特点,受到科研工作者和油脂企业家的关注,被认为是最为潜力用于制备乙酯型EPA的方法[10].本课题组使用脂肪酶CALA通过一步酶解反应将n-3多不饱和脂肪酸从三酰甘油中的25%~27%浓缩到单酰甘油中的88%~92%[11].此外,利用脂肪酶CALA乙醇醇解催化酶解破壁的微拟球藻,藻油的EPA含量可达到60.81%[12].因此,利用脂肪酶醇解催化微拟球藻磷脂EPA,可生产制备高附加值EPA.
目前,商用脂肪酶常见的形态有固定化和液体形式.固定化脂肪酶用于催化油脂具有易于回收、较好的热稳定性和pH稳定性等优点,成为改性油脂领域的重要生物催化剂.为此,本研究工作以富含EPA的微拟球藻磷脂为底物,选择Lipozyme RM IM、Lipozyme TL IM和Novozym 435脂肪酶为生物催化剂,筛选最适合乙醇醇解催化微拟球藻磷脂EPA的脂肪酶;随后,以最适合的固定化脂肪酶为研究对象,优化其乙醇醇解催化微拟球藻磷脂EPA生产制备乙酯型EPA的工艺条件(见图1),旨在为高值化开发海洋微藻油脂提供实践依据.
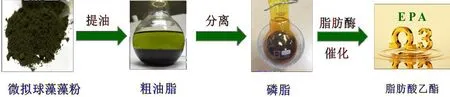
图1 微拟球藻磷脂制备乙酯EPAFig.1 Nannochloropsis phospholipids to prepare ethyl-EPA
1 材料与方法
1.1 藻种来源
微拟球藻粉(Nannochloropsissp.),购于山东饵料微藻公司.
1.2 实验试剂
氢氧化钾、甲醇、磷酸二氢钠一水合物、磷酸氢二钠七水合物均为分析纯,购自国药集团化学试剂有限公司;硫酸铵、无水乙醇、正己烷、异丙醇均为分析纯,购于西陇科学股份有限公司;纤维素酶(酶活:100 000 U·g-1)购自南宁鹏博生物工程有限公司;固定化Novozym 435、Lipzoyme TL IM和Lipzoyme RM IM 由丹麦诺维信公司提供.
0.5 mol·L-1KOH-CH3OH溶液:使用电子天平称量28.05 g氢氧化钾溶于少量甲醇中,然后将溶液倒入1 L的容量瓶中,用甲醇定容到1 L.
1.3 实验仪器
台式高速离心机-TG16-WS(湖南湘仪实验仪器开发有限公司);气相色谱仪-Scion 436(广州多谱科学仪器有限公司);数显恒温水浴锅-HH-4(国华电器有限公司);智能磁力搅拌器-ZNCL-BS(巩义市科华仪器设备有限公司);旋转蒸发器-RE52CS-1(上海亚荣生化仪器厂);电子分析天平-BASA124S(赛多利斯科学仪器有限公司);微型旋涡混合仪-WH-3(上海沪西分析仪器厂有限公司);循环水式多用真空泵-SHB-Ⅲ(上海予捷仪器有限公司)等.
1.4 微拟球藻磷脂的提取
取1 kg微拟球藻藻粉,加入5 L浓度为0.2 mol·L-1的磷酸缓冲液(pH=5)和0.01 kg纤维素酶,置于恒温水浴摇床(50 ℃)中酶解2 h,加入硫酸铵(质量分数为20%),随后加入与悬浮液同体积的叔丁醇,充分混匀后,于恒温水浴摇床(80 ℃)反应1 h后取出转移至分液漏斗中静置[13].取出上层液,在8 000 r·min-1、4 ℃条件下离心,收集上清液,经旋转蒸发仪去除有机溶剂后,得到微拟球藻粗油.
取0.4 kg微拟球藻粗油,加入3.2 L正己烷-异丙醇混合液(体积比3∶1),充分混匀后在温度40 ℃的水浴摇床充分振荡2 h,随后将样品进行低速离心(4 000 r·min-1,5 min),取异丙醇层,旋蒸去除有机溶剂获得粗磷脂样品;随后,再用丙酮冲洗脱油脱水,重复3次,获得微拟球藻磷脂.
1.5 脂肪酶催化醇解工艺参数优化
称取0.5 g的微拟球藻磷脂,加入4.5 g无水乙醇,溶解后加入酶载量为8%的3种固定化脂肪酶(脂肪酶Novozym 435、Lipozyme RM IM、Lipozyme TL IM),在反应温度35 ℃条件下,酶催化8 h,筛选最适合醇解催化微拟球藻磷脂的脂肪酶.
以所筛选到最适合的脂肪酶为研究对象,选择固定化形态的脂肪酶醇解催化微拟球藻磷脂,优化醇油质量比(1∶1、3∶1、5∶1、7∶1、9∶1、11∶1)、酶载量(1%、8%、15%、22%、29%)、反应温度(30、35、40、45、50、55 ℃)、含水量(0%、2%、5%、10%、15%、20%)、反应时间(2、4、6、8、10、12、24 h)等催化工艺.
1.6 分析方法
在脂肪酶的作用下,磷脂与乙醇会发生醇解反应,产生脂肪酸乙酯(FAEEs),脂肪酸乙酯可直接用于气相色谱仪分析.待反应完成后,取大约1 mg的反应产物,加入1 mL正己烷(含0.2 mg十七烷甲酯)充分溶解,进行气相色谱仪(SCION 436-GC,Bruker;色谱柱子,Omegawax®250毛细管,30 m × 0.32 mm × 0.25 μm)[14],分析总脂肪酸乙酯含量.乙酯转化率可按下列公式进行计算:

1.7 数据分析
所有实验条件进行3次,利用Microsoft Excel 2010和Origin 8.5软件对实验数据进行处理分析,结果用平均值标准差表示.IBM SPSS22.0软件进行单因素方差分析乙酯转化率的显著差异性(P<0.05).
2 结果与分析
2.1 微拟球藻磷脂的脂肪酸组成
本研究工作将利用纤维素酶进行酶解微拟球藻藻粉,随后用硫酸铵和叔丁醇介导的三相分离法提取微拟球藻粗油,用正己烷-异丙醇萃取所得微拟球藻粗磷脂,最后用丙酮萃取获得微拟球藻磷脂.将所得微拟球藻磷脂进行脂肪酸测定,结果见表1.从表1可知,微拟球藻磷脂的主要脂肪酸是棕榈酸(16.4%)、棕榈油酸(17.0%)和EPA(51.9%).Matsui等[15]研究发现,微拟球藻(Nannochloropsisoculata)在缺氮和缺磷条件下所合成磷脂的EPA质量分数分别为15.3%和28.2%.Callejón等[16]分析微拟球藻(Nannochloropsisgaditana)中性脂、糖脂和磷脂的脂肪酸时的结果表明,该藻的磷脂EPA质量分数约为22.0%.值得注意的是,本研究所得微拟球藻磷脂的EPA质量分数比前人所报道的结果更高.说明本研究所使用的微拟球藻磷脂更适合开发富含EPA制品.
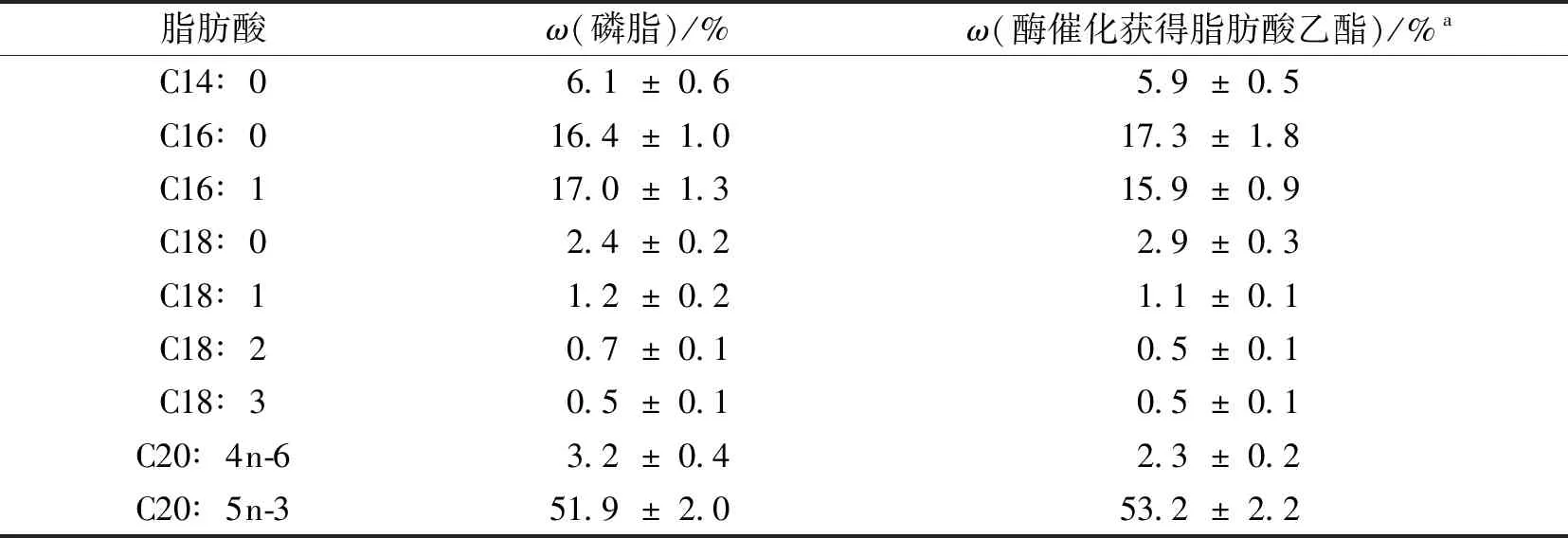
表1 微拟球藻磷脂的脂肪酸组成和酶催化所得脂肪酸乙酯的脂肪酸组成Tab.1 Fatty acid composition of Nannochloropsis-derived phospholipids and FAEEs catalyzed by enzyme
2.2 筛选乙醇醇解催化微拟球藻磷脂的脂肪酶
在酶载量8%(基于磷脂量)、醇油m(无水乙醇)∶m(磷脂)=9∶0.1、反应温度35 ℃、反应时间8 h、转速500 r·min-1的条件下,考察不同脂肪酶对醇解催化微拟球藻磷脂的乙酯转化率影响,结果如图2所示.
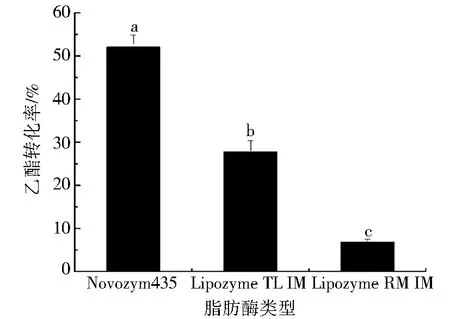
图2 不同脂肪酶对醇解催化微拟球藻磷脂的乙酯转化率的影响Fig.2 Effect of different lipases on the FAEEs conversion rates byenzymatic ethanolysis of Nannochloropsis-derived phospholipid
由图2可知,在所选择的3种脂肪酶中,Novozym 435催化微拟球藻磷脂获得最高的乙酯转化率(52.07%);Lipzome RM IM催化微拟球藻磷脂所得最低的乙酯转化率(6.83%).不同脂肪酶催化微拟球藻磷脂表现出明显差异的催化性能,这主要是因为不同来源的脂肪酶具有各自的氨基酸组成序列和酶空间结构,赋予其不同的催化特性.因此,由图2结果可得,最适合用于催化微拟球藻磷脂的生物催化剂为Novozym 435.
2.3 优化Novozym 435催化微拟球藻磷脂生产制备乙酯型EPA的工艺条件
图3A说明了不同酶载量对Novozym 435催化微拟球藻磷脂性能的影响,由图3A可知,当固定化脂肪酶Novozym 435的酶载量从1%增加到15%时,Novozym 435催化微拟球藻磷脂的乙酯转化率呈上升趋势,即32.38%提高到76.08%.但是,当酶载量继续增加至22%或29%时,脂肪酶的乙酯转化率则表现下降趋势(如图3A).这可能是因为随着酶载量的增加,底物的反应位点达到饱和,过量的酶会增加反应过程的传质阻力,导致乙酯转化率降低.因此,基于图3A的结果,最佳Novozym 435酶载量为15%.
有研究表明,适量的水分子可促进脂肪酶催化油脂,表现出最佳的催化性能.图3B的结果是关于不同含水量对Novozym 435催化微拟球藻磷脂性能的影响.从图3B可清楚看出,当反应体系中的含水量从0%增加到2%,固定化脂肪酶Novozym 435催化微藻磷脂的乙酯转化率呈现显著上升趋势.但是,当催化体系中的含水量超过2%,脂肪酶催化所得的乙酯转化率随含水量的增加而降低.这可能的原因是,过多的水分子会对脂肪酶中亲水基团发生非共价键、范德华力等作用,影响酶分子结构和构象,阻碍底物分子与脂肪酶催化中心的作用,导致酶催化性能的降低.因此,最适合Novozym 435催化微拟球藻磷脂的含水量为2%.
不同的醇油质量比会影响脂肪酶催化微藻磷脂,其结果见图3C.从图3C可得,当乙醇与微藻磷脂底物质量比为1∶1时,Novozym 435催化磷脂所得的乙酯转化率仅为45.35%;当醇油质量比继续增加至9∶1时,脂肪酶催化磷脂的乙酯转化率呈现明显的上升趋势,最高乙酯转化率达到82.13%.当醇油质量比大于9∶1时,Novozym 435催化磷脂所得的乙酯转化率反而明显下降.这主要是因为一个乙醇分子含有一个羟基基团,过多的乙醇分子会使其羟基基团与酶分子的Glu、Arg等氨基酸残基作用,影响酶分子的空间结构,降低其催化性能.因此,Novozym 435催化微藻磷脂的最佳醇油质量比为9∶1.
图3D评估了不同反应温度影响Novozym 435催化磷脂性能.当反应温度从30 ℃增加到40 ℃时,固定化脂肪酶Novozym 435催化微拟球藻磷脂的乙酯转化率呈上升趋势,从69.66%提高到92.68%.但是,当催化体系的反应温度超过40 ℃,Novozym 435催化所得的乙酯转化率随反应温度的增加而降低.反应温度为55 ℃时,Novozym 435催化磷脂所得的乙酯转化率最低,仅为55.01%.这主要原因是过高的反应温度会破坏酶的三级结构,造成酶的失活,从而降低了反应速率[17].因此,由图3D可知,固定化脂肪酶Novozym 435催化微藻磷脂最适合的反应温度为40 ℃.
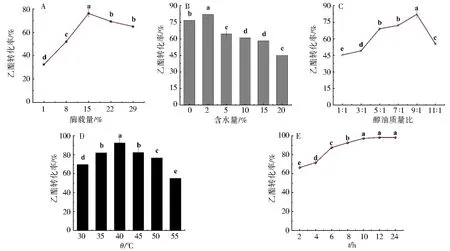
图中小写字母表示显著性差异,P<0.05图3 不同酶催化条件对脂肪酶醇解催微拟球藻磷脂的乙酯转化率的影响Fig.3 Effects of different enzyme catalysis conditions on the FAEEs conversion rates by enzymatic ethanolysis of Nannochloropsis-derived phospholipids
在酶催化反应中,为获得最优的反应条件,需要考虑反应时间这个因素.图3E的结果为不同反应时间对固定化脂肪酶Novozym 435催化微拟球藻磷脂性能的影响.从图3E可明显看出,反应时间为2~12 h时,固定化脂肪酶Novozym 435催化微藻磷脂的乙酯转化率表现上升趋势,最高乙酯转化率从66.51%上升到98.33%.当反应时间为12~24 h,脂肪酶催化磷脂所得的乙酯转化率则无显著差异.这可能的原因是,当催化反应进行到一定时间,脂肪酸乙酯的浓度升高,抑制了脂肪酶催化微拟球藻磷脂的性能.因此,基于图3E的结果,Novozym 435催化微藻磷脂的最优反应时间为12 h.
本研究利用Novozym 435乙醇催化富含EPA微拟球藻磷脂,最高的乙酯转化率为98.33%.本研究工作所得的结果与Yang等[18]和Yasuda等[19]催化大豆磷脂的结果存在较大差异[18-19](见表2).这主要是因为本文与这两篇论文的催化反应条件不一样,使Novozym 435表现明显不同的催化特性(如位置选择性),有利于催化磷脂甘油骨架上的sn-1和sn-2脂肪酸,与乙醇反应转化为脂肪酸乙酯.Novozym 435在不同催化条件下会表现sn-1,3位置选择和非位置选择两种催化特性[20].因此,本研究工作中,高浓度的乙醇(乙醇与微拟球藻磷脂质量比9∶1)可能是Novzoyme 435催化磷脂表现非位置选择性的一个原因.今后将利用蛋白质工程、分子模拟等技术,进一步分析Novozym 435催化磷脂的分子机制,旨在定向研发新型南极假丝酵母脂肪酶B高值化开发海洋微藻油脂.
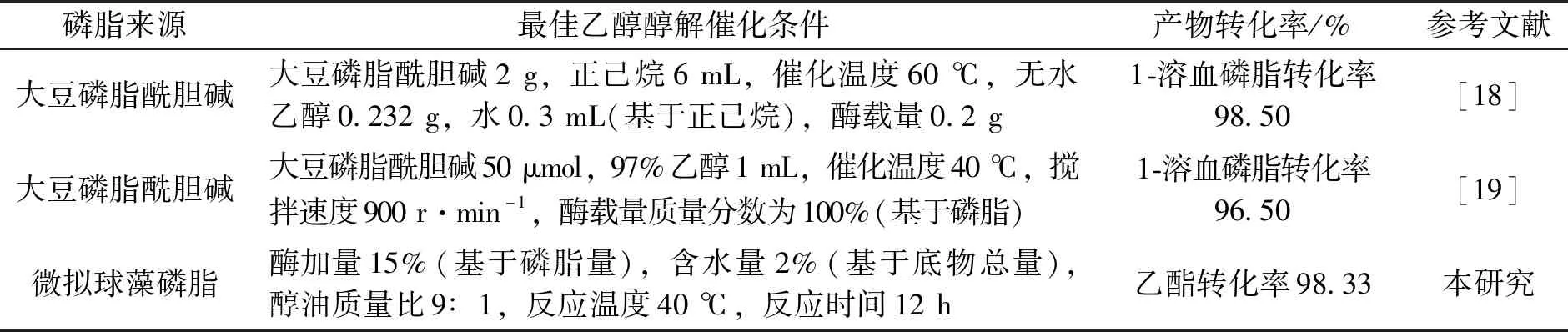
表2 Novozym 435催化微拟球藻磷脂和大豆磷脂酰胆碱的结果比较Tab.2 Comparison of Novozym 435 to catalyze Nannochloropsis phospholipids and soybean phosphatidylcholine
3 结论
在3种商用固定化脂肪酶中,Novozym 435是最适合乙醇醇解催化富含EPA的微拟球藻磷脂的脂肪酶,其乙酯转化率为52.07%.Novozym 435可获得最高乙酯转化率的催化条件为:酶加量为磷脂量的15%,含水量为底物总量的2%,醇油质量比9∶1,反应温度为40 ℃,反应时间为12 h.在所优化的条件下,脂肪酶乙醇醇解催化磷脂的最大乙酯转化率为98.33%.基于本研究的结果,Novozym 435是一种最有潜力用于乙醇醇解微拟球藻磷脂生产制备EPA的生物催化剂,为今后高值化开发海洋微藻油脂提供依据.

