自然杀伤细胞活性与结直肠癌发病风险的关系
梁 敏,薛大伟,张念杰,马志卫
(河北三河燕郊福合第一医院外科,河北 三河 065201)
自然杀伤细胞(natural killer cell,NKC)属于大颗粒淋巴细胞,可参与抗感染、肿瘤早期防御及免疫调节过程。固有免疫系统的NKC 与适应性免疫系统共同协调,可通过释放趋化性细胞因子,促进免疫细胞靶向清除恶性肿瘤细胞[1]。研究发现,NKC 活性降低与肿瘤发病风险增高相关。与健康对照组相比,结直肠癌(colorectal cancer,CRC)患者的NKC 活性显著降低。NKC 活性降低与晚期CRC 和CRC 术后复发、转移或低生存期等预后不良情况相关[2]。目前,尚不清楚NKC 活性是否与癌前病变,包括结直肠腺瘤的发病有关。本研究主要观察CRC、结直肠腺瘤及健康者之间NKC 活性是否有差异,分析NKC 活性与结直肠癌风险之间的关系。
1 资料与方法
1.1 研究对象
选择2016 年1 月至2021 年12 月在本院外科行结肠镜检查者1536 例进行研究对象的筛选。其中有385 例接受了NKC 活性测试。受检者均自愿接受内镜检查,且已签署知情同意书。
1.2 纳入与排除标准
纳入标准:年龄38 ~78 岁;接受结肠镜和组织病理学检查及NKC 活性测试。排除标准:存在炎症性肠病;存在自身免疫性疾病;存在病毒性肝炎;近半年内使用过免疫抑制药物、糖皮质激素或抗生素;不配合结肠镜检查者。
1.3 结肠镜和组织病理学检查
受检者经肠道清洁准备后行结肠镜检查。检查均由副主任以上有经验的内镜医师进行。若发现有肠道息肉、腺瘤样病变或其他可疑肠道病变,可行息肉切除术、内镜下黏膜切除术,并钳夹肠道病变组织,由专业病理医师行活体组织病理学评估。其中,结直肠腺瘤按病理分型分为管状腺瘤、绒毛状腺瘤和绒毛管状腺瘤(不考虑腺瘤大小及不典型增生的级别,不包括增生性息肉或炎性息肉)[3]。
1.4 NKC 活性测定
在结肠镜检查当天,静脉穿刺抽取1 mL 全血样本,直接转入NKC 活性检测专用管中。其中含有刺激性细胞因子(Promoca),主要是通过NKC 导致IFN-γ 分泌到血浆中。收集后30 min 内,置于37℃培养箱中孵育20 ~24 h。收集上清液,室温下离心3 min。采用酶联免疫吸附测定(ELISA)法检测标本中IFN-γ 的表达水平[4]。
1.5 统计学方法
应用SPSS 20.0 统计软件包进行数据处理分析,符合正态分布的定量数据以±s示,样本均数间比较采用F检验;非正态分布定量数据以中位数( 四分位数间距) 表示,组间比较采用秩和检验;计数资料以% 表示,样本率的比较采用χ² 检验。P<0.05为差异有统计学意义。
2 结果
2.1 CRC 组、结直肠腺瘤组、无瘤组基线临床特征的比较
将符合入组条件的385 例接受结肠镜检查者按结肠镜活体组织病理结果分为CRC 组16 例(4.16%)、结 直 肠 腺 瘤 组68 例(17.67%)、无 瘤 组301例(78.18%)。三组的年龄、性别、BMI、吸烟史、饮酒史、患高血压、糖尿病和血脂异常情况均无统计学差异(P>0.05),既往有结直肠息肉情况有统计学差异(P<0.001)。三组的NKC 活性水平有统计学差异(P<0.001)。CRC 组的NKC 活性水平低于结直肠腺瘤组(中位数638 pg/mL VS 931 pg/mL,P=0.026)。结直肠腺瘤组的NKC 活性水平低于无瘤组( 中位数931 pg/mL VS 1319 pg/mL,P=0.031)。见表1。
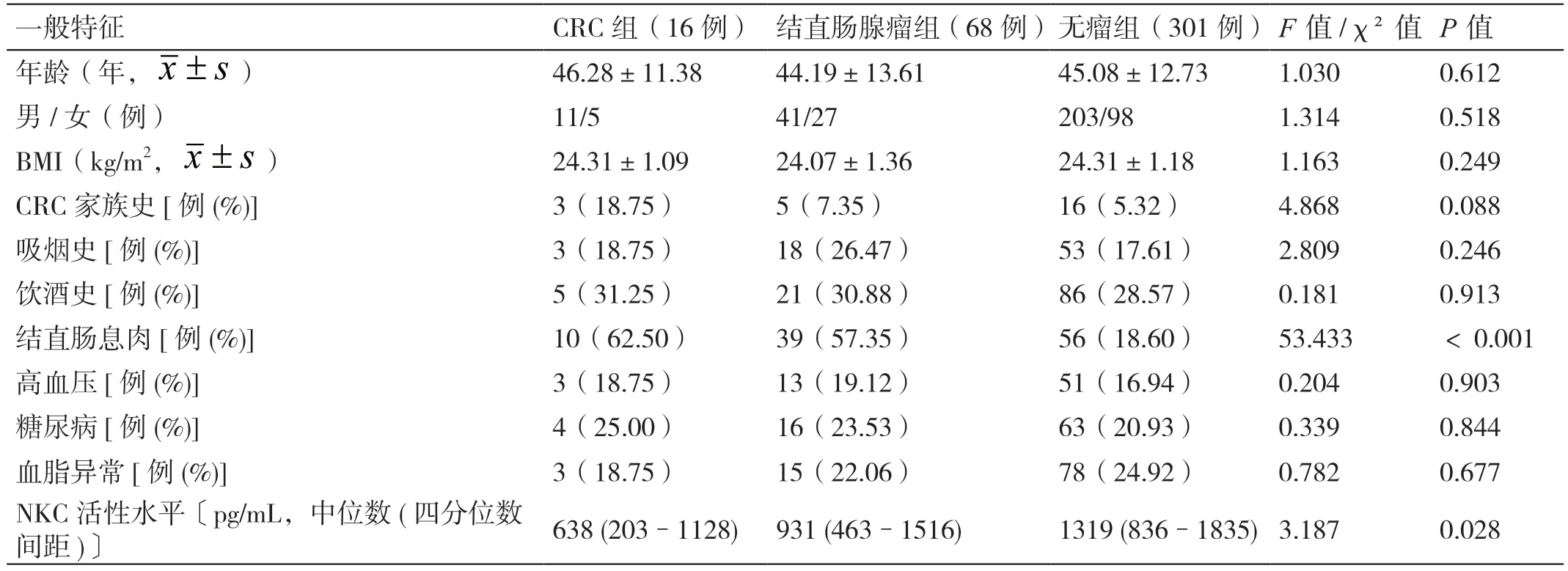
表1 三组基线临床特征的比较
2.2 NKC 活性与结直肠癌发病风险的关系
根据NKC 活性水平绘制受试者工作曲线,将所有受检者分为高活性组(≥268 pg/mL)和低活性组(<268 pg/mL)。低活性组与高活性组比较,前者CRC(6.22% VS 2.07%,P=0.041) 和结直肠腺瘤(22.28% VS 12.95%,P=0.016) 的发生率更高,组间比较均有显著性差异(P<0.05)。
3 讨论
细胞免疫是一种保护性免疫反应,涉及免疫细胞的激活。一类是固有免疫细胞如巨噬细胞、中性粒细胞和NKC 的非特异性免疫应答,通过吞噬作用或诱导细胞毒性作用杀死靶细胞;另一类是通过适应性免疫细胞如抗原特异性细胞毒性T 淋巴细胞和B 细胞介导的获得性和特异性反应,破坏在细胞表面表达特异性抗原的肿瘤细胞[5]。其中,NKC 是防止细胞恶性转化的重要免疫监视细胞,可直接诱导恶性肿瘤细胞的死亡。肿瘤细胞表面通常缺乏主要组织相容性复合体I 的表达,这可以被NKC 识别。NKC 可释放细胞毒性颗粒到靶细胞上,导致细胞裂解[6]。研究发现,中高活性外周血NKC 可降低肿瘤风险,而低活性与癌症风险增加相关,提示宿主天然免疫防御机制对肿瘤防御发挥着重要作用[7]。鉴于NKC 在肿瘤监测中的作用,CRC中NKC 的抑制可作为病情进展的参考指标之一。本研究显示,CRC 组的NKC 活性水平低于结直肠腺瘤组( 中位数638 pg/mL VS 931 pg/mL,P=0.026)。结直肠腺瘤组的NKC 活性水平低于无瘤组( 中位数931 pg/mL VS 1319 pg/mL,P=0.031)。低活性组与高活性组比较,前者CRC(6.22% VS 2.07%,P=0.041)和结直肠腺瘤(22.28% VS 12.95%,P=0.016)的发生率更高,组间比较均有显著性差异(P<0.05)。研究表明,与非CRC 患者相比,CRC 患者的NKC 活性显著降低。遗传学研究发现,与高NKC 活性相关的等位基因可能是CRC 的独立保护因素。有研究通过ELISA 检测NKC分泌的IFN-γ,发现微卫星稳定型CRC 患者的NKC活性水平〔(263.6±54.5)pg/mL〕显著低于健康受试者〔(867.5±50.2)pg/mL〕(P<0.0001)。低NKC 活性受试者的CRC 风险是高NKC 活性受试者的10 倍[8-9]。NKC活性可在临床上用于评估患者的CRC 风险。本研究表明,NKC 活性降低与结直肠腺瘤发病相关,而结直肠腺瘤是CRC 的癌前病变,大多数CRC 病例是通过腺瘤-癌序列发展而来的。本研究中CRC 患者的NKC 活性水平(中位数638 pg/mL)低于结直肠腺瘤患者(中位数931 pg/mL),结直肠腺瘤患者的NKC 活性水平低于无瘤受检者(中位数1319 pg/mL)。有研究指出,NKC 活性可能在腺瘤-癌序列的后期阶段下降,这与肿瘤的进展有关。NKC 活性可能在癌前阶段的宿主免疫防御机制中发挥重要作用。NKC 的肿瘤监视作用很大程度上归因于其直接识别和杀伤肿瘤细胞的能力。众所周知,NKC 活性低是CRC 进展至晚期的潜在风险指标[10]。最近的一项病例研究也提示,对肿瘤细胞具有高细胞毒性的大量循环NKC 的存在可能与对化疗的较好应答和较长的无进展生存期相关。也有研究发现,接受根治性切除术的CRC 患者中,2 年内复发患者的术前NKC 活性较低,提示术前低NKC 活性可预测CRC 复发。NKC 活性降低是预测CRC 根治性手术后远处转移的重要因素,并与CRC 患者的不良预后相关。在手术前,Ⅱ期和Ⅲ期CRC 患者的NKC 活性低于健康对照者,而CRC 切除后有助于患者NKC 活性的恢复[11-12]。有研究认为,NKC 活性检测可能缺乏预测非晚期腺瘤的能力。NKC 活性对非晚期腺瘤的预测性低于晚期腺瘤。有研究报道,在CRC 高危人群中,筛选确定CRC 患者的NKC 活性最佳临界值为181 pg/mL。NKC 活性检测用于确定CRC 受试者的敏感度为87.0%,阴性预测值为99.4%[13-14]。但用NKC 活性检测诊断进展期结直肠腺瘤或CRC 的最佳临界值临床上尚未得出一致结论,需通过进一步研究加以明确。
总之,在结肠组织病变的发展过程中,NKC 活性会随病变进展而逐渐降低。NKC 活性可为判断结直肠病变性质提供参考。今后需要进行更多的前瞻性研究,以进一步阐明结直肠病变发展中NKC 活性的动态改变,为确定结直肠恶性病变的性质提供参考。

