基于TCGA 数据库的胃腺癌铜死亡相关lncRNA预后模型构建
胡梦奕 屠小龙 王永生 张婷素
作者单位:315010 宁波市中医院肿瘤科
我国恶性肿瘤的新发病率约为456.88/14 万,有300.3 万例患者因此而死亡,其中胃癌的新发病率和死亡率均位居全国第三[1]。胃癌起病隐匿,早期常无明显症状或体征,当发现时常常已进入晚期。腺癌是胃癌中最常见的病理类型,约占胃癌的90%以上[2]。手术仍是主要的治疗手段,对于无法手术的患者,经常使用姑息性化疗,然而二线化疗失败后缺乏公认的有效治疗方案,5 年生存率不到10%,给临床治疗带来了极大的挑战[3]。因此,目前迫切需要构建一个可靠的预后模型为胃腺癌的诊疗提供新思路。
铜死亡是最近提出的一种铜和线粒体依赖的独立的细胞死亡机制,多个研究证实相较于正常细胞,癌细胞对铜的需求更高,铜离子含量增加可促进癌细胞的增殖与转移、促进肿瘤血管生成等[4],铜死亡将是癌症研究的一个有前景的领域。长链非编码RNA(long non-coding RNA,lncRNA)在肿瘤细胞增殖、分化、浸润、转移、耐药等方面发挥重要作用[5]。目前关于胃腺癌患者铜死亡相关lncRNA 特征及其与生存预后的相关性研究较少,本研究基于癌症基因组图谱(the Cancer Genome Atlas,TCGA)数据库构建铜死亡相关lncRNA 预后模型,并对其肿瘤微环境(tumor microenvironment,TME)、肿瘤突变负荷(tumor mutational burden,TMB)、微卫星状态以及药物敏感性等方面进行探索分析,以期为胃腺癌的临床治疗提供新的思路和依据。
1 材料和方法
1.1 数据下载整理 从TCGA 数据库(https://portal.gdc.cancer.gov)中下载343 例胃腺癌组织和30 例正常组织的转录组数据和对应临床数据,并提取其中lncRNA。根据目前已发表的文献[6]获得19 个铜死亡相关基因。运用Pearson 相关分析将上述19 个基因与TCGA 数据库中提取获得的lncRNA 进行共表达分析,获得铜死亡相关lncRNA,筛选条件为|r|>0.4,P<0.01。
1.2 构建铜死亡相关lncRNA 预后模型 对1.1 中确定的铜死亡相关lncRNA 采用单因素Cox 回归分析,将其中P<0.05 的铜死亡相关lncRNA 通过套索算法回归进行降维,然后采用多因素Cox 回归分析筛选出最有预后价值的lncRNA 建立预后模型,并计算风险评分(risk score,RS)。计算公式:RS=coefi×xi,其中coefi代表预后相关lncRNA 的相关系数,xi代表每个lncRNA 的表达量。以RS 中位值为分界点,将患者分为低风险组和高风险组。
1.3 预后模型验证 采用主成分分析将分组可视化,以判断参与构建模型的lncRNA 是否可以区分高低风险组。采用对数秩检验,应用Kaplan-Meier 曲线评估高低风险组的生存差异。通过ROC 曲线评价预后模型的预测效能。
1.4 独立预后分析及建立列线图 对患者性别、年龄、组织学分级、临床分期、RS 分别进行单因素和多因素Cox 回归分析,从而获得独立预后因子。对鉴定出的独立预后因子进行综合分析,构建列线图预测胃腺癌患者1、3、5 年生存率,绘制列线图的校准曲线以评估其预测值与实际观测值之间的一致性。
1.5 预后模型的TME 分析 利用ESTIMATE 算法推断基质成分和免疫细胞的水平,估算每个样本的肿瘤纯度。从TIMER 2.0 数据库(http://timer.comp-genomics.org/)获得免疫浸润样本,应用TIMER、CIBERSORT、CIBERSORTABS、QUANTISEQ、MCPCOUNTER、XCELL、EPIC 等计算方法分析免疫细胞在高低风险组中的浸润情况,以P<0.05 为筛选条件提取有差异的免疫细胞绘制热图。对高低风险组进行免疫功能的单样本基因集富集分析(single sample GSEA,ssGSEA),并评估两组免疫功能、免疫检查点基因的差异,绘制箱线图。
1.6 预后模型的TMB、微卫星状态分析 从TCGA 数据库下载胃腺癌患者的体细胞突变数据,计算TMB。根据TMB 最佳阈点值将预后模型中的胃腺癌患者分为高、低TMB 两组,采用对数秩检验方法,通过Kaplan-Meier 曲线比较高、低TMB 组患者生存差异,并对TMB 和RS 进行联合生存分析。比较高低风险组中微卫星状态差异。
1.7 预后模型的免疫逃逸和药物敏感性分析 应用肿瘤免疫功能障碍和排斥(tumor immune dysfunction and exclusion,TIDE)工具(http://tide.dfci.harvard.edu/)计算每个样本的TIDE 评分,比较高低风险组TIDE 评分的差异。使用oncoPredict 包预测高低风险组患者对常见抗癌药物的治疗反应,根据半抑制浓度(half maximal inhibitory concentration,IC50)进行药物敏感性预测,评估高低风险组药物敏感性的差异。
1.8 统计学处理 采用R 4.1.3 软件及相关的R 程序包。计量资料两组间比较采用Wilcoxon 秩和检验。P<0.05 为差异有统计学意义。
2 结果
2.1 确定铜死亡相关lncRNA 并构建预后模型 19 个铜死亡相关基因均在TCGA 转录组数据中有表达,经过共表达分析后获得434 个铜死亡相关lncRNA,通过单因素Cox 回归分析进一步筛选出20 个具有预后作用的lncRNA,再将上述lncRNA 进行套索算法回归和多因素Cox 回归分析,最终确定10 个关键lncRNA 纳入构建预后模型。RS=(-0.390 7×AC016394.2 表达量)+(-0.852 8×LINC00571 表达量)+(0.495 9×LINC01094 表达量)+(0.559 1×LINC02863 表达量)+(0.382 0×HAGLR 表达量)+(1.102 9×SLC6A1-AS1 表达量)+(-0.555 5×AC108693.2 表达量)+(0.564 6×LINC01150 表达量)+(0.947 2×AC008915.2 表达量)+(-0.394 1×PINK1-AS 表达量)。
2.2 预后模型生存分析 高风险组患者总生存期(overall survival,OS)、无进展生存期(progression free survival,PFS)均明显短于低风险组(均P<0.01)(图1A、B,见插页)。纳入构建模型的10 个lncRNA,AC016394.2、LINC00571、AC108693.2、PINK1-AS 在高风险组呈低表达,而LINC01094、LINC02863、HAGLR、SLC6A1-AS1、LINC01150、AC008915.2 呈高表达(图1C,见插页)。

图1 铜死亡相关lncRNA 预后模型生存分析(A:高、低风险组患者OS 的生存曲线;B:高、低风险组患者PFS 的生存曲线;C:预后模型10 个lncRNA 表达热图)
2.3 验证预后模型预测效能 主成分分析结果表明,该预后模型能够很好地区分高、低风险组(图2A,见插页)。应用预后模型预测所有患者1、2、3 年生存率的AUC 分别为0.711、0.730 和0.759(图2B,见插页)。预后模型预测所有患者1 年生存率的AUC 大于性别、年龄、组织学分级、临床分期、肿瘤TNM 分期,提示构建的预后模型在生存预测上优于以上临床参数(图2C,见插页)。

图2 预后模型验证(A:预后模型主成分分析;B:预后模型预测所有患者1、3、5 年生存率的ROC 曲线;C:风险评分和其他相关临床参数的ROC 曲线)
2.4 预后模型的临床价值 单因素和多因素Cox 回归分析显示年龄、临床分期和RS 是预后的独立因子(图3A、B)。基于上述独立预后因子,构建列线图预测患者1、3、5 年生存率,结果显示患者1、3、5 年生存率分别为71.1%、32.0%和22.2%(图3C),结合校准曲线,表明预测的生存率与实际生存率基本一致(图3D)。说明结合临床特征和铜死亡相关lncRNA 预后特征的列线图稳定准确,可用于胃腺癌患者的临床观察。

图3 独立预后因素评估及生存预测(A:单因素Cox 回归分析评估风险评分和相关临床参数与OS 之间的关系;B:多因素Cox 回归分析评估风险评分和相关临床参数与OS 之间的关系;C:基于独立预后因子的胃腺癌患者1、3、5 年生存率的列线图;D:列线图对胃腺癌患者1、3、5 年生存率预测的校准曲线)
2.5 不同风险组的免疫差异分析 基质成分和免疫细胞在高风险组患者中含量更高(图4A,见插页),高低风险组间多种免疫细胞、免疫功能、免疫检查点相关基因比较差异均有统计学意义(均P<0.05)(图4BD,见插页)。

图4 高低风险组的免疫细胞及免疫功能差异比较(A:高低风险组中基质成分、免疫细胞及综合评分比较;B:高低风险组中不同算法免疫细胞分布热图;C:基于ssGSEA算法,高低风险组免疫功能差异的箱线图;D:高低风险组免疫检查点基因表达差异的箱线图)
2.6 高低风险组的TMB 及微卫星状态分析 低风险组TMB 高于高风险组(图5A,见插页),且高TMB 患者预后优于低TMB 患者(图5B,见插页)。根据中位RS与中位TMB,将人群划分为高TMB+高风险、高TMB+低风险、低TMB+高风险、低TMB+低风险4 组,高TMB+低风险患者表现出更显著的生存优势(图5C,见插页)。低风险组患者具有高度微卫星不稳定(high-level microsatellite instability,MSI-H)(图5D、E,见插页)。
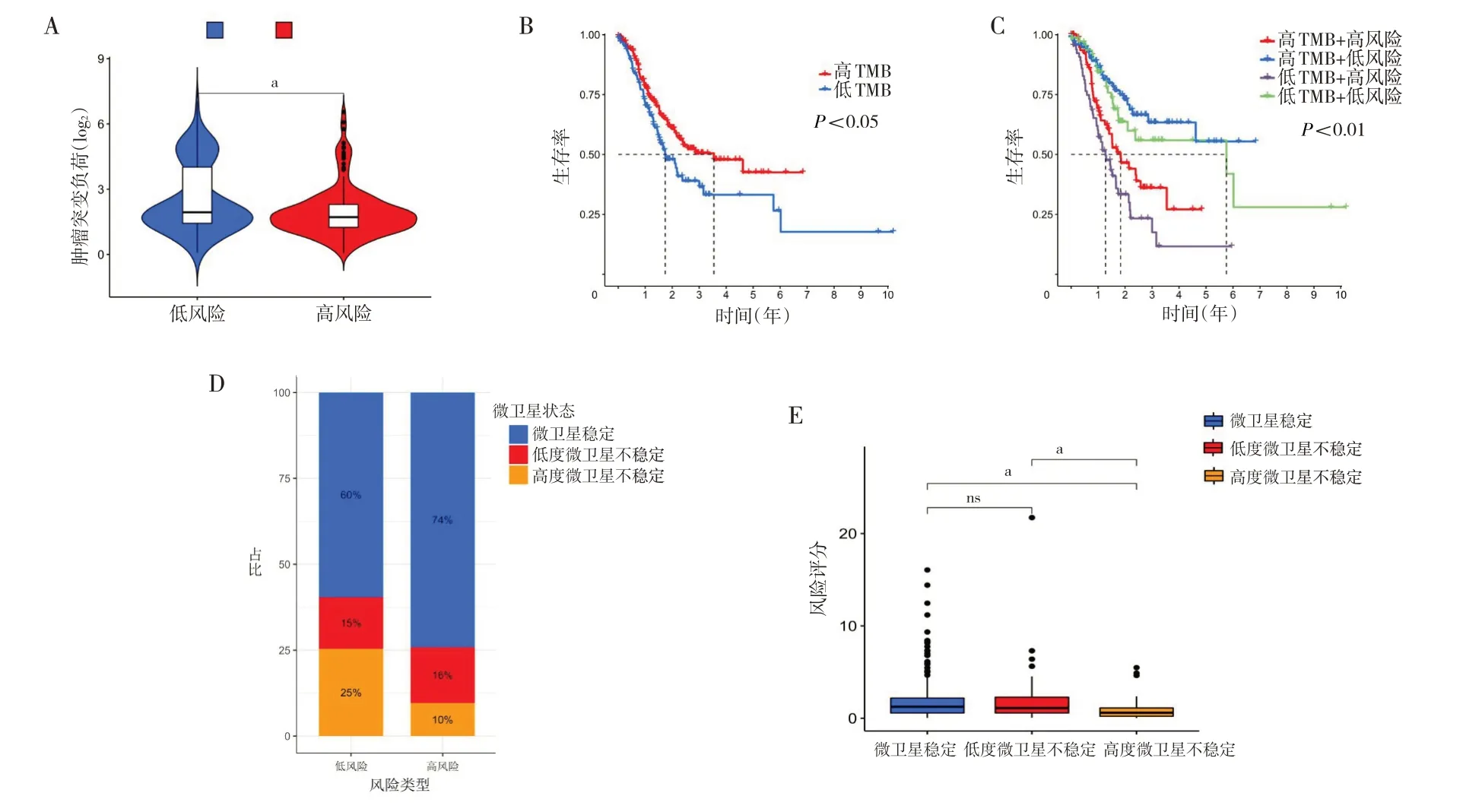
图5 高低风险组患者TMB、微卫星状态的差异比较(A:高低风险组TMB 比较;B:高、低TMB 患者OS 的生存曲线;C:高TMB+高风险、高TMB+低风险、低TMB+高风险、低TMB+低风险4 组间OS 的生存曲线;D:高低风险组微卫星状态分布占比;E:风险评分与微卫星状态相关性分析)
2.7 免疫治疗分析和药物筛选 低风险组患者TIDE评分较低,提示低风险组患者能从免疫治疗中获益更多(图6A)。oncoPredict 包预测了胃腺癌患者对198 种抗癌药物治疗的IC50评分,结果发现高风险组患者对AZD8055、CZC24832、达沙替尼、WZ4003、XAV939 等药物更敏感(图6B-F),低风险组患者对BMS-345541、二氢鱼藤酮、地胆草新内酯、ERK_6604、KRAS(G12C)Inhibitor-12、司美替尼、优立替尼、长春新碱等更敏感(图6G-N)。
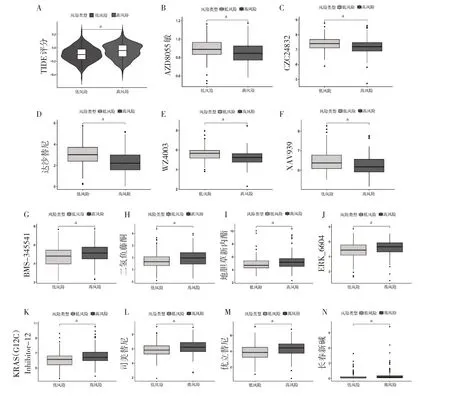
图6 TIDE 评分及药物敏感性分析(A:高低风险组患者TIDE 评分比较;B-N:高低风险组患者药物敏感性差异分析,其中B:AZD8055;C:CZC24832;D:达沙替尼;E:WZ4003,F:XAV939;G:BMS-345541;H:二氢鱼藤酮;I:地胆草新内酯;J:ERK_6604;K:KRAS(G12C)Inhibitor-12;L:司美替尼;M:优立替尼;N:长春新碱)
3 讨论
全球43.9%的胃癌新发病例和48.6%的胃癌致死病例发生在我国[7],但是与日韩等国家不同,我国早期胃癌比例较低,仅占19.7%[8],30%~40%的患者确诊时已无根治性手术指征,预后较差[9],尽管放化疗、靶向、免疫等治疗已广泛用于胃癌治疗,但胃癌患者的存活率仍然较低。
铜稳态与多种肿瘤的发展密切相关,其失衡引起的细胞毒性可调节癌细胞生长和增殖的速率[10]。Tsvetkov 等[11]发现铜离子可以通过直接结合三羧酸循环中的脂质酰化成分,导致脂质酰化蛋白聚集和铁硫簇蛋白丢失,引发蛋白质毒性应激反应并最终介导细胞死亡,这种新型的细胞死亡方式被定义为铜死亡。不同细胞死亡途径的启动者和效应者是癌症研究领域的热点[12],破译癌细胞中铜死亡的生物学过程可能发现新的治疗靶点。lncRNA 参与调控转录激活、核内运输、基因组表达、细胞分化等多种生物学功能[13],随着研究的深入,大量胃癌相关的lncRNA 被发现,它们通过多种信号通路参与胃癌的发生和发展,并可作为胃癌的生物标志物和潜在的治疗靶点[14],但是仍有大量胃癌相关的lncRNA 未被发现,目前关于铜死亡相关基因的报道较少,也缺乏将铜死亡相关基因与lncRNA 结合起来预测胃癌患者预后的研究。
本研究基于TCGA 数据库建立了铜死亡相关lncRNA 预后模型,该模型能较好地区分高低风险人群,由此模型区分的高低风险人群显示出理想的生存差异,并在ROC 曲线中达到良好的AUC 值,与传统的临床预后因素相比,该模型对于胃腺癌预后预测的效能明显提高。同时,该模型区分的高低风险人群对药物治疗的反应性存在差异,提示该模型在后续的治疗方案选择中或可作为参考。本模型共纳入10 个lncRNA,根据lncRNA 在高低风险组间差异表达的热图可以看出,模型中大多数lncRNA 倾向于在高风险组中高表达,其中部分lncRNA 被报道与各种肿瘤的发生、发展密切相关,如lncRNA-HAGLR 在胃癌细胞中上调,可促进胃癌细胞增殖、导致氟尿嘧啶耐药,并与预后不良相关[15]。在胃癌细胞中沉默PINK1-AS 可抑制胃癌细胞进展,PINK1-AS 上调则产生相反的结果[16],而在本研究的预后模型中,PINK1-AS 却在高风险组人群中表达较低。LINC01094 则已被证实可促进卵巢癌[17]、胰腺癌[18]细胞的增殖、侵袭和迁移能力。
免疫细胞是TME 的重要组成部分,并在其中发挥关键作用[19]。免疫细胞在TME 中存在时有助于肿瘤进展,癌细胞和近端免疫细胞之间的串扰最终导致促进肿瘤生长转移的环境[20]。本研究显示,低风险组患者TME 免疫浸润水平较低,两组间免疫功能也存在差异。同时本研究还发现高风险组患者基质成分和免疫细胞含量更高,这说明高风险患者的肿瘤纯度较低,低肿瘤纯度与肿瘤进展、耐药以及预后等密切相关[21],以上这些可能是导致两组预后差异的重要因素。
传统化疗药物治疗晚期胃癌已在瓶颈期[22-23],本研究探索了不同风险组的潜在敏感药物,这些药物可能有助于缓解耐药性和改善临床结果,胃腺癌患者生存时间的差异或与他们对药物的敏感性不同有关。胃癌治疗正在经历从化疗到靶向、再到免疫的变迁,晚期胃癌免疫治疗相关的临床研究也从三线向一线治疗靠拢[24]。研究表明胃癌患者TMB 越高则预后越好,且高TMB 与免疫检查点抑制剂(immunecheckpoint inhibitors,ICI)治疗有效性、化疗有效性相关[25]。MSI-H 是晚期胃癌ICI 有效治疗的预测标志物,MSI-H 型胃癌患者的生存期更长,有着更佳的预后[26]。本研究发现低风险组患者TMB 高于高风险组,且呈现MSI-H,而且低风险组患者多种免疫检查点的表达量更低,以上结果表明低风险组患者更能从ICI治疗中获益。
综上所述,本研究通过对TCGA 数据库中胃腺癌相关数据的挖掘,构建了铜死亡相关lncRNA 预后模型,该模型能够较好地预测患者预后。然而本研究仍有一定的局限性,如该预测模型是基于公共数据库的回顾性数据所建立的,固有的选择偏倚可能会影响其稳健性,还需要更多的临床数据来加以验证;构建模型纳入的lncRNA 影响肿瘤发生、发展的机制有待进一步实验研究。

