CircPVT1在子痫前期中的表达意义及其对胎盘绒毛外滋养层细胞的功能影响和作用机制
刘 岩,陈琪珍,邹倩茹,陈佳静,张 瑜,陈 雄
(上海市宝山区吴淞中心医院妇产科,上海 200940)
子痫前期(preeclampsia,PE)是妊娠期所特有的一种高血压疾病,在世界范围内孕产妇中的发病率介于3%~5%,是导致孕产妇和围产儿死亡的主要原因[1]。目前,治疗PE最有效的方法是分娩。PE对孕产妇和围产儿的严重危害以及治疗措施的缺乏,使对PE发生发展中相关的分子机制进行深入研究的任务变得十分紧迫。PE的发病机制复杂,现已知胎盘滋养层细胞的凋亡和异常侵袭是PE发生的基础[2]。近年来研究[3-4]发现,母胎界面环状RNAs(circular RNAs,circRNAs)的异常与胎盘绒毛外滋养层(extravillous trophoblasts,EVTs)细胞凋亡、增殖、血管形成、侵袭、迁移、免疫等生物学行为相关,可能参与PE的发生和发展,但此方面研究尚处于起步阶段。有研究[5]显示,circPVT1在胃癌、非小细胞肺癌和乳腺癌等肿瘤中表达升高,促进肿瘤细胞的增殖、迁移、侵袭和血管形成等过程。鉴于胎盘病理在PE中的重要作用,结合EVTs细胞与癌细胞具有相似的生物学功能(增殖、迁移和侵袭等)[6],且目前尚未见circPVT1在PE中的研究报道,本研究拟探究circPVT1在PE胎盘组织中的表达意义,以及在EVTs细胞中的作用及作用机制,为探索PE诊疗的新靶点提供参考依据。
1 材料与方法
1.1 研究对象
选取2018年1月至2020年12月上海市宝山区吴淞中心医院收治的无宫缩行剖宫产分娩的孕妇60例为研究对象,其中PE组和Con组(拒绝阴道试产的健康孕妇)各30例。入组标准:1)符合PE诊断标准[7];2)孕妇本人签署知情同意书。排除标准:双胎妊娠、妊娠合并内外科疾病和其他妊娠并发症。本研究经本院伦理委员会审批通过。
1.2 取材和检测方法
1.2.1 胎盘样本采集
标本采集于胎盘娩出后5 min内迅速完成。从胎盘母面的中心区域切取大小约1 cm×1 cm×1 cm 组织,置于-80 ℃冰箱保存备用。
1.2.2 细胞培养和稳转细胞株的建立
人绒毛膜滋养层细胞株(HTR-8/SVneo)购于美国模式培养物集存库(American type culture collection,ATCC),细胞复苏后,在含10%FBS(胎牛血清,赛默飞世尔科技(中国)有限公司)的RPMI-1640培养基(赛默飞世尔科技(中国)有限公司)中培养,培养条件37 ℃,5%CO2。将circPVT1过表达、干扰和相应的对照含有嘌呤抗性的慢病毒(购自上海吉玛制药技术有限公司)分别转染适宜密度的HTR-8/SVneo细胞,72 h后,使用嘌呤霉素对稳转细胞株进行筛选,定期换液、细胞传代。2周后,利用qRT-PCR技术,对circPVT1稳定表达的效率进行检测,获得circPVT1的稳定干扰细胞株(lv-shcircPVT1)和稳定过表达细胞株(oe-circPVT1),用于后续实验。
1.2.3 RNA提取和qRT-PCR分析
使用Total RNA提取试剂盒(生工生物工程(上海)股份有限公司)提取胎盘组织和EVTs细胞的total RNA,并使用逆转录试剂盒(宝生物工程(大连)有限公司)将1 mg RNA用于合成cDNA。使用SYBR Premix Ex Taq检测circPVT1和miR-145-5p的表达。GAPDH和u6分别用于使circRNA和miRNA的相对表达水平正常化。使用2-ΔΔCt方法计算不同基因的相对表达水平。所有引物由生工生物工程(上海)股份有限公司合成,引物序列如下:circPVT1,上游认识5′-GGTTCCACCAGCGTTATTC-3′,下游5′-CAACTTCCTTTGGGTCTCC-3′;GAPDH(内参照),上游5′-GGA-GCGAGATCCCTCCAAAAT-3′,下游5′-GGCTG-TTGTCATACTTCTCATGG-3′;U6(内参照),上游5′-CTCGCTTCGGCAGCACA-3′,下游5′-AAC-GCTTCACGAATTTGC-3′;MiR-145-5p,上游5′-GUCCAGUUUUCCCAGGA-3′,下游5′-GTGCA-GGGTCCGAGGT-3′;Wnt3a,上游5′-ATGAACC-GCCACAACAAC-3′,下游5′-GCTTCTCCACCA-CCA-TCT-3′;Wnt5a,上游5′-CTTGGTGGTCG-CTAGGTA-3′,下游5′-TCGGAATTGATACTGGCATT-3′;β-catenin,上游5′-ACACCAAGAAGCAGAGATG-3′,下游5′-CGAATCAATCCAAC-AGTAGC-3′。
1.2.4 细胞增殖能力测定
将上述circPVT1过表达或者干扰的稳转细胞株(oe-circPVT1组、lv-shcircPVT1组),以及对应的阴性对照细胞系(lv-NC组)分别接种在96孔板中,待细胞完全贴壁后进行检测(每12 h),检测前2 h,每孔加10 μL的CCK-8试剂(江苏凯基生物技术股份有限公司),酶标仪采集OD450值。
1.2.5 细胞迁移能力检测
细胞消化、重悬后,将上述稳转细胞系均匀接种于6孔板中,次日待细胞贴壁后用微量加样器枪头垂直于6孔板底做标记,分别于划痕后0、24和48 h拍照,划痕愈合率代表细胞迁移能力。
1.2.6 细胞侵袭能力检测
基质胶溶液均匀铺在transwell上室(康宁(上海)管理有限公司),向24孔板孔内加入含10%FBS的培养基作为趋化因子诱导细胞穿膜。将各组细胞消化、收集、离心并重悬在不含FBS的培养基中,接种至上室内,培养24 h,用棉签擦去残留在上室的细胞,已侵入底部隔室的细胞经固定、染色后,在显微镜下拍照并计数。
1.2.7 MicroRNA的合成与瞬时转染
miR-145-5p的mimics和inhibitor试剂由上海吉玛制药技术有限公司设计并合成,引物序列如下:Mimics NC,上游5′-UUAUCAGAAUCUCCAGG-GGUAC-3′,下游5′-GUACCCCUGGAGAUUCU-GAUAA-3′;MiR-145-5p mimics,上游5′-GUCCAGUUUUCCCAGGAAUCCCU-3′,下游5′-AGGG-AUUCCUGGGAAAACUGGAC-3′;Inhibitor NC,5′-AUAUCUUAAUCUCUCUCAUCCAA-3′;MiR-145-5p inhibitor,5′-AGGGAUUCCUGGGA-AAACUGGAC-3′。利用Lipofectamine3000(美国英杰生命技术有限公司)进行瞬时转染HTR-8/SVneo细胞,构建表达miR-145-5p NC、miR-145-5p mimics、miR-145-5p inhibitor的绒毛膜滋养层细胞株。
1.2.8 双荧光素酶报告系统验证miR-145-5p与circPVT1的靶向调控关系
环状RNA相互作用数据库(https://circinteractome.nia.nih.gov和http://starbase.sysu.edu.cn)预测circPVT1与miR-145-5p之间有结合位点,利用双荧光素酶报告系统实验进行验证。通过分子克隆技术将WT-circPVT1和MUT-circPVT1分别克隆进入荧光素酶报告质粒(pGL3-basic)中,筛选阳性克隆,测序,扩增克隆并提纯质粒备用,将WT-circPVT1、MUT-circPVT1分别转染上述构建的表达miR-145-5p NC(WT-circPVT1+miR-145-5p NC组、MUT-circPVT1+miR-145-5p NC组)、miR-145-5p mimic(WT-circPVT1+miR-145-5p mimics组、MUT-circPVT1+miR-145-5p mimics组)的绒毛膜滋养层细胞株,24 h后荧光素酶报告实验检测细胞内的荧光素酶活性。
1.2.9 免疫印迹实验
用RIPA裂解液裂解各组细胞,收集各组细胞总蛋白,蛋白定量后进行聚丙烯酰胺凝胶电泳和转膜。4 ℃封闭膜过夜、洗膜、4 ℃摇床孵育一抗过夜、洗膜、室温摇床避光孵育二抗1 h、洗膜、化学发光显色、灰度值分析(β-actin作为内参)。
1.3 统计学方法
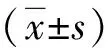
2 结果
2.1 Con组和PE组孕妇一般临床资料比较
2组孕妇的分娩年龄、分娩时体重指数(body mass index,BMI)和是否吸烟比较,差异均无统计学意义(P>0.05),2组孕妇收缩压、舒张压、尿蛋白、分娩孕周和新生儿出生体重比较,差异有统计学意义(P<0.05),见表1。
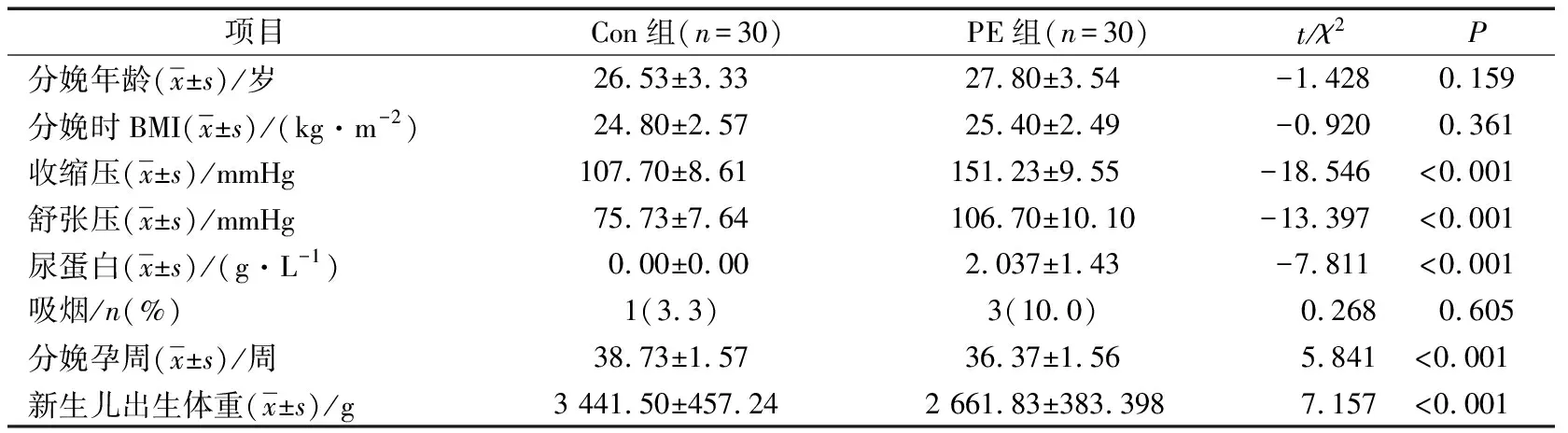
表1 Con组和PE组孕妇一般临床资料比较
2.2 CircPVT1表达与孕妇一般临床资料相关性分析
胎盘组织中circPVT1 mRNA表达与孕妇收缩压、舒张压和尿蛋白呈负相关(均P<0.01),与孕妇分娩孕周和新生儿出生体重呈正相关(均P<0.01),与孕妇年龄和分娩时BMI无明显相关性(均P>0.05)。见表2。

表2 circPVT1表达与孕妇一般临床资料相关性分析
2.3 CircPVT1在Con组和PE组孕妇胎盘组织标本中的表达水平
qRT-PCR实验结果显示,Con组和PE组胎盘组织中circPVT1相对表达量分别为1.00±0.08、0.517±0.07,2组比较差异有统计学意义(t=7.569,P=0.002)。
2.4 CircPVT1对EVTs细胞生物学功能的影响
CCK-8增殖实验表明,在HTR-8/Svne细胞中,与lv-NC组相比,oe-circPVT1组细胞增殖能力显著增加、lv-shcircPVT1组细胞增殖能力显著降低(P<0.01),见图1A。细胞划痕实验表明,在HTR-8/Svne细胞中,与lv-NC组[24、48 h划痕愈合率分别为(61.67±2.89)%、(79.33±1.15)%]相比,oe-circPVT1组[24、48 h划痕愈合率分别为(75.00±5.00)%、(87.67±2.52)%]细胞迁移能力显著增加(P=0.016、P=0.006),lv-shcircPVT1组[24、48 h划痕愈合率分别为(54.00±3.61)%、(65.00±5.00)%]细胞迁移能力显著降低(P=0.045、P=0.008),见图1B。Transwell实验表明,在HTR-8/Svne细胞中,与lv-NC组(343.33±35.19)相比,lv-shcircPVT1组(466.67±30.55)细胞侵袭能力显著增加(P=0.010),而lv-shcircPVT1组(240.00±20.00)细胞侵袭能力显著降低(P=0.011),见图1C。

A:CCK-8增殖实验检测circPVT1过表达或抑制circPVT1表达后HTR-8/Svneo细胞增殖能力的变化,n=3,*P<0.05,**P<0.01; B:细胞划痕实验检测circPVT1过表达或抑制circPVT1表达后HTR-8/Svneo细胞迁移能力的变化。
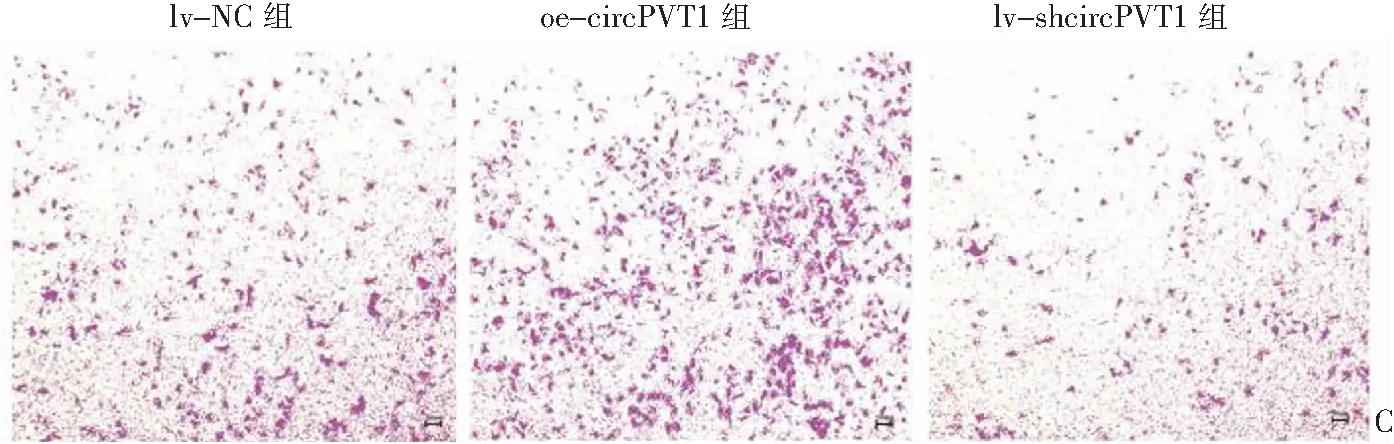
C:transwell实验检测circPVT1过表达或抑制circPVT1表达后HTR-8/Svneo细胞侵袭能力的变化。
2.5 circPVT1对miR-145-5p的调控
公共数据库预测提示miR-145-5p与circPVT1之间存在结合位点,见图2A。双荧光素酶报告基因实验结果显示,在HTR-8/Svneo细胞中,WT-circPVT1+miR-145-5p NC组和WT-circPVT1+miR-145-5p mimics组相对荧光素酶活性分别为1.00±0.10、0.40±0.10,2组比较差异有统计学意义(t=7.348,P=0.002),而MUT-circPVT1+miR-145-5p NC组和MUT-circPVT1+miR-145-5p mimics组相对荧光素酶活性分别为1.00±0.17、1.00±0.10,2组比较差异无统计学意义(P=1.000),见图2B。同时,qRT-PCR结果显示,miR-145-5p在Con组和PE组患者胎盘组织中相对表达量分别为1.00±0.20、1.93±0.40,2组比较差异有统计学意义(t=-3.585,P=0.023),见图2C;在HTR-8/Svneo细胞中,与lv-NC组(1.00±0.20)相比,oe-circPVT1组(0.50±0.10)miR-145-5p的表达降低(P=0.018),而lv-shcircPVT1组(2.50±0.50)miR-145-5p的表达增加(P=0.008),见图2D。
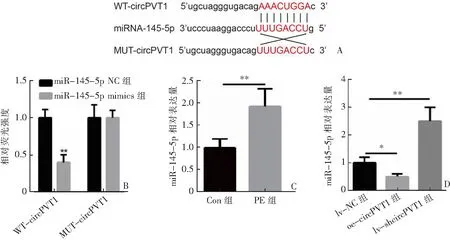
A:miR-145-5p与circPVT1和突变的miR-145-5p预测结合位点示意图;B:在HTR-8/Svneo细胞中,利用双荧光素酶报告实验验证circPVT1与miR-145-5p的结合关系,n=3;C:qRT-PCR检测miR-145-5p在Con组(n=30)和PE组(n=30)患者胎盘组织中的表达情况;D:qRT-PCR检测circPVT1过表达和抑制circPVT1表达后miR-145-5p的表达情况,n=3。*P<0.05,**P<0.01。
2.6 circPVT1通过miR-145-5p/Wnt/β-catenin通路促进EVTs细胞增殖和侵袭
qRT-PCR和western blot实验分别显示,circPVT1过表达能够促进Wnt3a、Wnt5a和β-catenin mRNA和蛋白表达,然而这种情况可以被miR-145-5p的类似物所抑制(P<0.01),见图3A—B。CCK-8实验显示,miR-145-5p抑制物能够挽救circPVT1沉默介导的HTR-8/Svneo细胞增殖能力降低(P<0.01),见图3C。
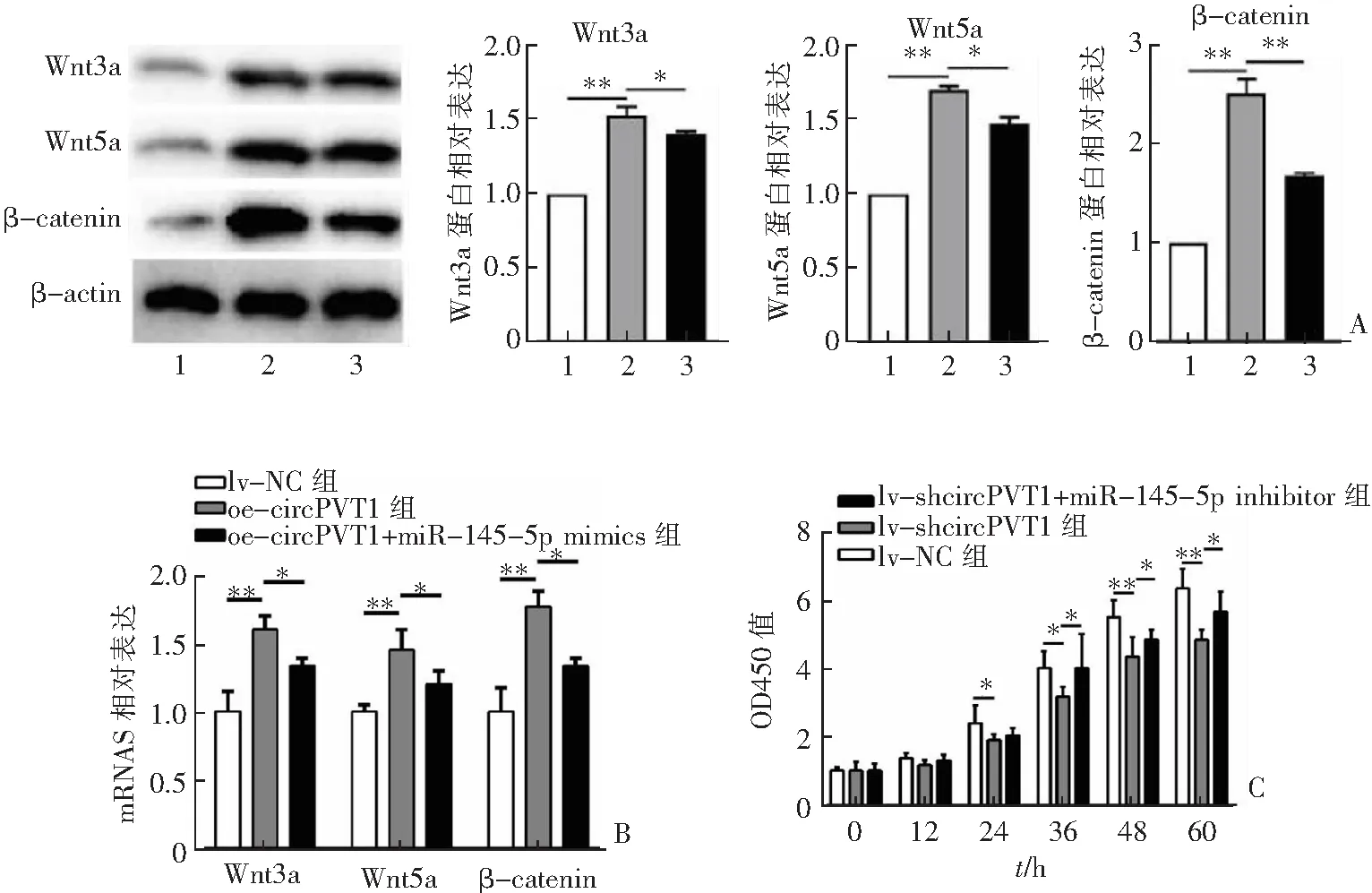
A:western bolt实验检测HTR-8/Svneo细胞转染oe-circPVT1和(或)miR-145-5p mimics后Wnt3a、Wnt5a和β-catenin蛋白表达情况;B:qRT-PCR实验检测HTR-8/Svneo细胞转染oe-circPVT1和(或)miR-145-5p mimics后Wnt3a、Wnt5a和β-catenin mRNA表达情况;C:CCK-8实验检测,HTR-8/Svneo细胞转染lv-shcircPVT1和(或)miR-145-5p inhibitor后细胞增殖能力的变化。n=3,*P<0.05,**P<0.01。1:lv-NC组;2:oe-circPVT1组;3:oe-circPVT1+miR-145-5p mimics组。
3 讨论
近年来,学界普遍认为PE发生的首要病因是胎盘发育异常,滋养细胞浅植入和不完全浸润是PE的基本病因[8]。CircRNAs是共价闭合的单链转产物,随着高通路测序和生物信息学技术的发展,circRNAs被证实参与调控多种细胞类型的不同生物学过程[9]。例如,ZHOU等[10]发现circZDHHC20通过结合miR-144上调GRHL2的表达,从而阻断滋养细胞的增殖、迁移和侵袭能力。另有研究[11]报道,环状RNA circ_0111277通过调控miR-494/HTRA1/Notch-1信号通路减弱PE人滋养细胞的侵袭和迁移。以上研究显示,circRNAs的异常表达与胎盘滋养细胞的生物学行为异常相关,提示circRNAs可能在PE发病机制中发挥重要作用。
CircPVT1又称hsa_circ_0001821,源于癌基因长链非编码RNA PVT1的第2个外显子,该基因位于chr8:128902834—128903244,一个癌症易感基因座[5],circPVT1可充当miR-125a、miR-145-5p、miR-149和miR-203等miRNAs的海绵,还可调节PI3K/AKT和Wnt5a/Ror2等信号通路的活性,在胃癌、非小细胞肺癌和乳腺癌等多种肿瘤的发生、药物耐药和预后过程中发挥至关重要的作用[12]。胎盘滋养层细胞与癌细胞有相似的生物学活性,即增殖、迁移和侵袭性等,胎盘滋养细胞的功能失调被认为是PE的基本病因[2]。CircPVT1在PE及其胎盘滋养层细胞中表达水平和临床意义尚未见报道。本研究利用qRT-PCR检测,发现相比于正常胎盘组织,circPVT1在PE胎盘组织中低表达,临床数据统计分析结果显示,胎盘组织中circPVT1表达与孕妇收缩压、舒张压和尿蛋白呈负相关,与孕妇分娩孕周和新生儿出生体重呈正相关。提示circPVT1可能参与了PE的发生,可能是PE不良妊娠结局的潜在分子标志物。有研究[13]报道,在胃癌中,circPVT1通过miR-423-5p/Smad3通路介导上皮-间充质转化调控细胞迁移和侵袭。本研究为探讨circPVT1在PE胎盘滋养层细胞中的生物学功能,首先利用慢病毒侵染并构建了circPVT1的稳定干扰细胞株(lv-shcircPVT1)和稳定过表达细胞株(oe-circPVT1),并进行了一系列细胞功能实验,结果显示,circPVT1过表达后EVTs细胞的增殖、迁移和侵袭能力增强,而抑制circPVT1表达后EVTs细胞的增殖、迁移和侵袭能力降低。
CircPVT1促进EVTs细胞增殖、迁移和侵袭能力的作用已经明确,但其中的作用机制尚需进一步探讨。MicroRNA(miRNAs)是一种非编码的小RNA,在转录后水平调控基因的表达,与疾病的发生发展密切相关[14]。有研究[15]显示,circRNAs通过对miRNAs海绵吸附作用,阻止miRNAs对特定mRNAs结合,进而影响细胞功能,导致疾病的发生。本研究通过生物信息学分析,发现miR-145-5p是circPVT1潜在的靶miRNAs之一。应用双荧光素酶报告实验和挽救实验在EVTs细胞中检验circPVT1与miR145-5p之间的相互作用,结果显示circPVT1可以海绵吸收并负向调控miR-145-5p。Wnt信号通路是一种复杂的途径,以高度依赖细胞和组织的方式调节许多信号转导途径,并调节多种生物功能,在人类中有3种Wnt信号通路:典型的Wnt/β-catenin通路,非典型的Wnt/Ca2+通路和非典型的平面细胞极性通路[16]。最近的研究[17]表明,Wnt/β-catenin信号通路的失调可能与PE有关。另有研究[18]报道,miR-145-5p通过调控Wnt/β-catenin信号通路抑制银屑病的发展。此外,circRNA和Wnt/β-cateinin通路在多种生物学过程之间有很多联系[19]。例如,ZHANG等[20]证实,circRNA_069718通过激活Wnt/β-cateinin通路介导三阴性乳腺癌的进展。本研究发现,在EVTs细胞中circPVT1显著促进Wnt/β-Catenin mRNA和蛋白表达,然而这种情况可以被miR-145-5p的类似物所抑制。随后的细胞增殖实验显示miR-145-5p抑制物能够挽救circPVT1沉默介导的EVTs细胞增殖能力降低。以上结果表明,circPVT1可能通过调控miR-145-5p/Wnt/β-catenin信号通路促进EVTs细胞增殖和侵袭参与PE发生。
综上所述,circPVT1在PE患者胎盘中低表达,与PE患者的不良妊娠结局相关。CircPVT1过表达后EVTs细胞的增殖、迁移和侵袭能力增强,而抑制circPVT1表达后EVTs细胞的增殖、迁移和侵袭能力降低,可能是通过miR-145-5p/Wnt/β-catenin信号通路发挥作用。这些发现可为探索PE诊疗的潜在靶点提供参考。然而本研究尚存在一定的局限性,如样本量偏少、circPVT1具体的作用机制有待完善,需要更深入的体内外实验进一步验证其在PE中的临床价值。

