CWF19L1抑制细胞周期以抑制胶质瘤细胞的增殖和迁移
刘俊哲,王利平,雷锟坚,罗 敏,杨新宇,杨璐菲,叶敏华
(1.南昌大学第二附属医院神经外科,南昌 330006; 2.婺源县人民医院神经外科,江西 上饶 333200)
胶质瘤是成年人中最常见的颅内肿瘤之一[1],主要起源于神经胶质细胞,具有高度的侵袭性,易在颅内进行广泛播散,患者的预后通常很差,中位生存时间仅为12个月甚至更少[2]。临床上对胶质瘤常用的治疗手段为外科手术切除,加以辅助放化疗,但由于其在颅内播散广泛,难以通过手术治疗进行肿瘤全切[3]。此外,胶质瘤对放化疗易产生抗性的特征也使得术后的放化疗难以获得满意的疗效,探索新的诊断及预后标志物及治疗靶点对胶质瘤的诊治具有重要的参考意义[4]。
细胞周期紊乱是肿瘤发生发展的重要因素,通过调控细胞周期能为肿瘤发展及治疗提供新的治疗方向,而细胞周期调控分子的研究可为特异性靶向药物的筛选与研发提供依据。大量研究[5-6]证明,抑癌基因编码的蛋白质对于细胞周期过程有关键的调控作用,被证明与细胞周期密切相关。在本课题组前期研究[7]中已经表明CWF19L1(CWF19 Like cell cycle control factor 1)在胶质瘤的进展中参与关键的调控作用,但其具体作用机制尚未被完全揭示,本文进一步设计相应实验,探究CWF19L1对细胞周期的影响以及在肿瘤细胞增殖,迁移与浸润中的作用,进而影响其恶性进展,为进一步探索针对胶质瘤治疗寻找新的靶点和诊疗思路。
1 材料与方法
1.1 主要实验材料与仪器
人正常神经细胞SVG、人胚肾细胞HEK293T和胶质瘤细胞系U87、T98、U118、LN229及U251均购自美国典型培养物保藏中心(ATCC)。DMEM、MEM培养基、opti-MEM培养基及0.25%胰蛋白酶购自美国Gibco生物科技公司。胎牛血清购买自苏州依科赛生物科技公司,CWF19L1、GAPDH单克隆抗体山羊抗兔与山羊抗鼠二抗购自美国Proteintech公司;细胞周期试剂盒、CCK-8试剂盒及BCA试剂盒购买自上海碧云天生物技术有限公司,超敏化学发光检测试剂盒(Super ECL Plus)购自苏州优逸兰迪生物科技有限公司,sh-NC、sh-CWF19L1-1、sh-CWF19L1-2、sh-CWF19L1-3慢病毒质粒购自吉凯基因生物科技有限公司,LipofectamineTM3000购自美国Invitrogen生命技术有限公司。本研究使用的主要仪器有低温高速离心机(美国Thermo Fisher生物科技公司)、超净工作台(苏洁净化设备有限公司)、荧光显微镜(德国Leica公司)、流式细胞仪(美国Beckman公司)、多功能酶标仪(美国Thermo Fisher生物科技公司)、细胞培养箱(美国BD公司)、细胞计数仪(江苏卓微生物科技有限公司)、蛋白质电泳仪(美国Bio-Rad公司)等。
1.2 细胞培养
除U87细胞培养于含10% FBS的MEM培养基外,上述其余细胞系均培养在含10%FBS的DMEM培养基中,培养环境为37 ℃,5% CO2。细胞铺板后,均待其进入对数生长期再进行操作。细胞消化均使用含有EDTA的0.25%胰蛋白酶,37 ℃ 环境下消化3 min,等量完全培养基中止消化,离心后取得细胞沉淀以进行后续实验。
1.3 慢病毒包装
在六孔板上进行HEK293T细胞铺板,使用慢病毒包装体系(psPAX2、pMD2.0+慢病毒质粒)进行慢病毒的包装,使用LipofectamineTM3000转染试剂进行质粒共转,转染后6 h换液,去除转染试剂后36 h收集上清,即为病毒溶液。将收集的病毒溶液通过0.22 μm细胞筛进行过滤,使用慢病毒浓缩试剂盒进行慢病毒浓缩后置于-20 ℃冰箱备用。
1.4 稳转细胞系构建
将U251胶质瘤细胞接种于六孔板中,细胞生长至50%~60%密度时进行慢病毒转染操作。将收集的慢病毒溶液加入六孔板中进行孵育,12 h后进行细胞换液重置培养箱中培养,待细胞长至适宜密度使用嘌呤霉素进行细胞筛选。收集筛选后的稳定CWF19L1敲低细胞系进行大量扩增并部分在-80 ℃冰箱中冻存备用,同时保留部分细胞进行后续实验。
1.5 蛋白质提取及蛋白质印迹法(WB)实验
待CWF19L1敲低稳转细胞和阴性对照未做处理的细胞生长至合适浓度时,用RIPA细胞/组织裂解液裂解细胞,使用超声破碎仪进行细胞破碎,提取细胞蛋白质通过BCA法测定蛋白质浓度。进行WB实验时,每孔的上样量为30 μg,以确定蛋白质电泳时蛋白质样品的上样量。将样品蛋白与loading buffer进行混合,置于100 ℃金属浴锅中煮沸至蛋白质变性,置于-20 ℃保存备用。WB实验采用SDS-聚丙烯酰胺凝胶进行电泳,每孔上样量为30 μg。电泳条件分别为浓缩胶:90 V、30 min;分离胶:120 V、60 min,待电泳结束后,用湿转法将分散开的电泳蛋白质转移到事先用甲醇溶液激活的聚偏二氟乙烯膜(PVDF)上,转膜条件为400 mA、60 min。转膜完成后用5%脱脂牛奶将膜封闭4 h,之后用1:10 000稀释的CWF19L1单克隆抗体在4 ℃ 条件下进行过夜孵育。次日,TBST清洗3次后,用山羊抗兔抗体(1:3000)孵育4 h,继续用TBST清洗3次,最后在显影液中孵育并通过显影仪(Tanon-5200Multi)在暗室中进行荧光拍照。将最终获得的图像用ImageJ软件进行灰度值读取,并取GAPDH作为内参对照对目的蛋白的表达进行半定量统计学分析。
1.6 细胞周期实验
分别取CWF19L1稳定敲低细胞和正常对照组细胞,胰酶消化细胞后用PBS清洗。将润洗后的细胞使用80%乙醇在-20 ℃条件下过夜进行细胞固定。再使用RedNucleus Ⅰ对细胞的双链DNA染色,再通过流式细胞仪上638 nm为激发波长的FL2通道中检测荧光强度,将结果在Flowjo软件中进行细胞周期分析。
1.7 细胞增殖实验
分别取未做处理以及稳转sh-CWF19L1-2慢病毒的U251胶质瘤细胞进行消化重悬及铺板,将两种细胞以每孔3000个的密度接种于96孔板中,充分摇匀,置于37 ℃培养箱中培养1~4 d。分别在培养第1、2、3、4天时,根据CCK-8试剂盒说明书进行操作,利用酶标仪在450 nm处进行吸光度的测量,根据结果确定细胞的增殖情况。根据测得的不同时期的细胞生长数差异,绘制细胞的生长特征曲线。
1.8 划痕实验
取前述转染敲低慢病毒的U251胶质瘤细胞,以5×105个细胞每孔进行铺板,待细胞贴壁过夜生长,待生长至大约60%密度,用1 mL枪头进行划痕操作(事先用marker笔在皿的反面进行标记),每隔0.5~1.0 cm一道划痕,用PBS清洗培养皿3次,洗去刮下的细胞,加入无血清培养基进行培养,重新放回5% CO2培养箱中进行培养,并且在0、6、12、24 h 分别进行拍照和取样,观察划痕周围肿瘤细胞向划痕进行迁移的程度和速率。迁移率=(0 h划痕宽度-24 h划痕宽度)/0 h划痕宽度。
1.9 Transwell实验
取转染敲低质粒慢病毒的U251胶质瘤细胞,经消化离心后,用无血清培养基进行细胞重悬,并用细胞计数仪进行细胞密度的计算,用培养基调整细胞密度至2.5×105个·mL-1,每个Transwell小室的上室中铺200 μL细胞悬液。同时,向下室中加入500 μL含FBS的培养基,在37 ℃恒温培养箱中培养24 h后,去除上室上膜残留的细胞,对已进入下室中的细胞用1%的结晶紫溶液进行染色10 min,通过显微镜对下室细胞进行观察并拍照记录,最后使用ImageJ软件对照片进行分析并计数。以上实验在相同的条件下均重复3次或以上,以避免偶然误差。
1.10 生物信息学分析
通过GEPIA网页工具(http://gepia.cancer-pku.cn/),分析CWF19L1在GBM与LGG两种肿瘤中分别与对应正常组织之间的表达差异。从TCGA和GTEx数据库下载TCGA、CGGA及GEO数据库中的胶质瘤RNA-seq数据,按照CWF19L1表达量高低分成2组,结合患者的生存时间应用R软件(Version:4.0.4)进行数据处理并绘图,最终确定CWF19L1的表达量与肿瘤之间的关系。匹配每位患者的生存与表达数据,使用“Survival”“Survminer”包分析CWF19L1基因表达与患者预后之间的关联。
1.11 统计学方法
所有数据均由实验所得原始数据通过SPSS 22.0软件进行分析所得,所有数据均以均数±标准差进行呈现,组间比较行t检验,变量之间使用Spearman相关分析。以P<0.05为差异有统计学意义。
2 结果
2.1 CWF19L1在胶质瘤组织中的表达
在GBM和LGG两种肿瘤中,CWF19L1的表达存在明显差异,其中在2组肿瘤样本中表现为肿瘤组表达均高于正常组(P<0.05)(图1A)。初步推断CWF19L1作为抑癌基因,在肿瘤组中高表达以抑制肿瘤的生长和侵袭,但这种抑制作用不足以抑制肿瘤的发展,因此设计了后续实验对上述猜想加以验证。通过提取各细胞系的全蛋白质进行蛋白质电泳,选择GAPDH作为内参,进行CWF19L1蛋白质的表达量比较,最终确定在U251胶质瘤细胞系中,CWF19L1蛋白质的表达最高(图1B)。
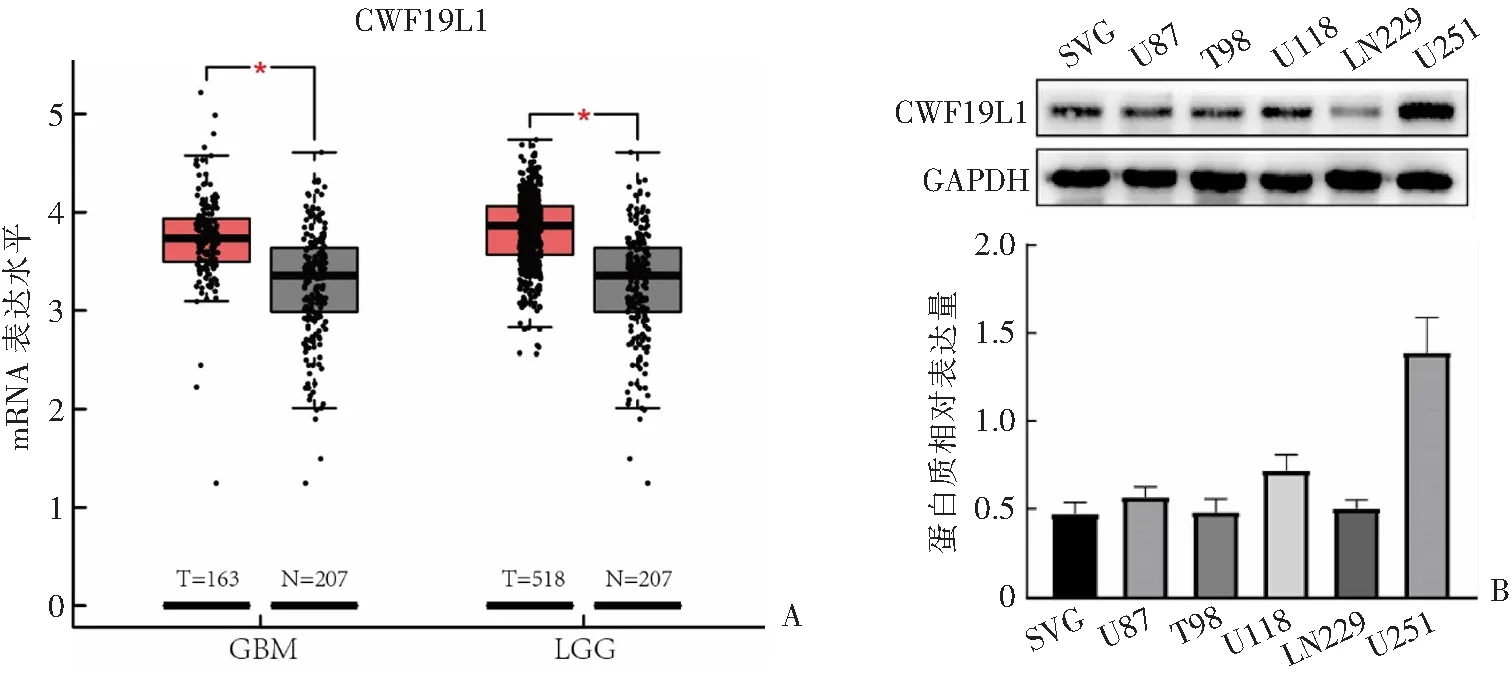
A:在TCGA与GTEx合并数据库LGG和GBM样品中,肿瘤组织相较于癌旁组织CWF19L1表达量更高。B:在6种基础细胞系中检测CWF19L1蛋白质的基础表达量,显示在U251细胞中CWF19L1表达最高。*P<0.05。
2.2 CWF19L1高表达对预后的影响
在3个数据库中各样本进行表达分析,将患者的CWF19L1表达量分成高低两组,对其生存时间进行统计学处理,结果如图2A—C,在TCGA、CGGA和GEO数据结果均显示,低表达组患者的生存时间通常较短,预示着CWF19L1对于胶质瘤属于保护基因,其高表达能有效限制胶质瘤细胞的恶性程度,减少胶质瘤细胞产生的损伤。

图2 TCGA、CGGA、GEO数据库中CWF19L1生存分析
2.3 sh-CWF19L1-2敲低效果
对实验组U251胶质瘤细胞进行转染敲低慢病毒(图3A),对照组U251胶质瘤细胞进行阴性对照慢病毒的转染,收集蛋白质进行WB检测,结果如图3B所示,CWF19L1蛋白表达相较于阴性对照组出现明显的敲低,并且sh-CWF19L1-2对CWF19L1基因具有最明显的敲低效果,后续亦选择该质粒进行功能实验。
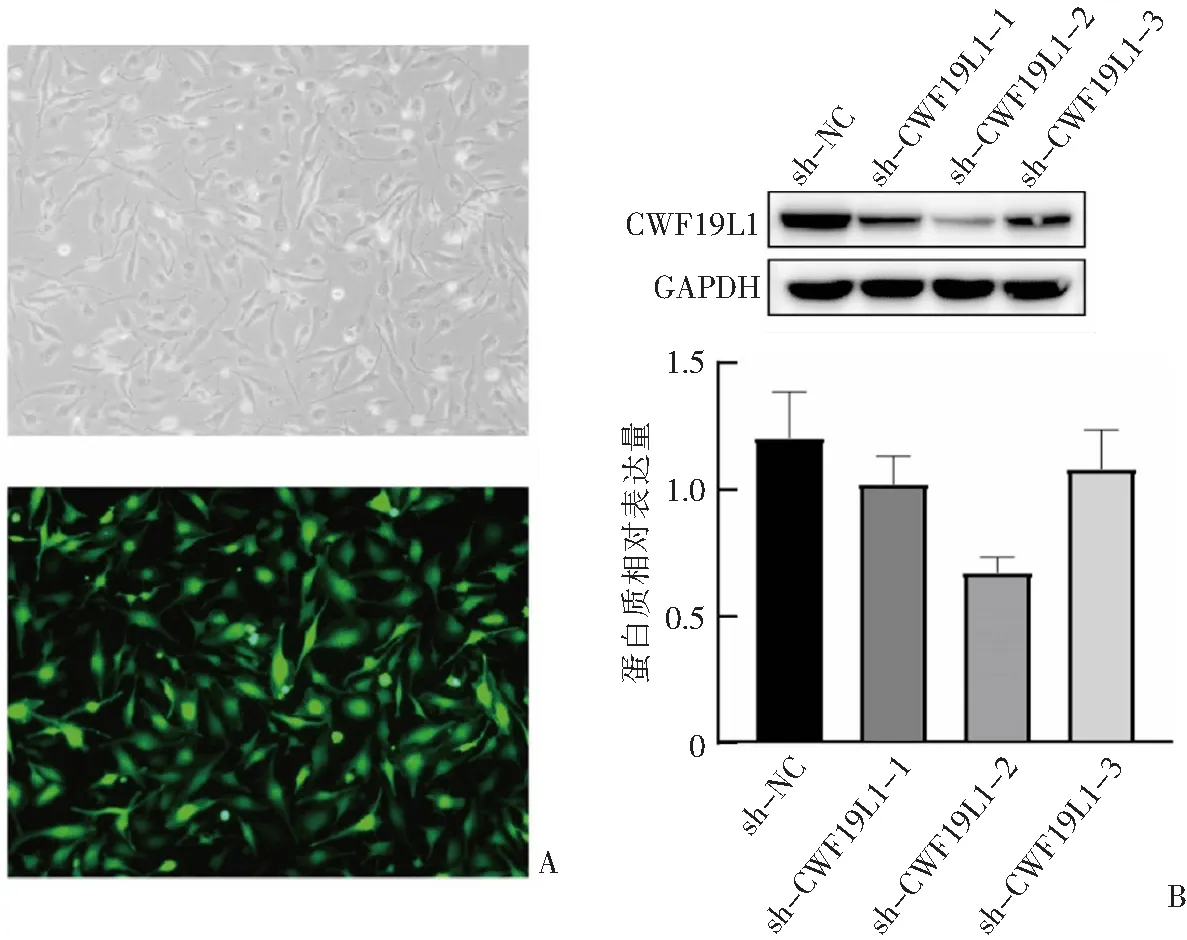
A:转染慢病毒后通过普通显微镜及荧光显微镜观察到的U251胶质瘤细胞;B:WB检测三保一敲低慢病毒转染情况各组之间的CWF19L1蛋白质表达量,n=3。
2.4 CWF19L1敲低在胶质瘤细胞周期中的表达
细胞周期实验的流式细胞术检测结果表明,CWF19L1敲低细胞系中处于DNA合成期与合成后期(S/G2期)的细胞比例相较于对照组明显上调(42.22%比33.00%,P<0.05),见图4。提示CWF19L1蛋白能抑制U251胶质瘤细胞的细胞周期G1/S期转化,表现为具有抑制细胞周期进展的作用。
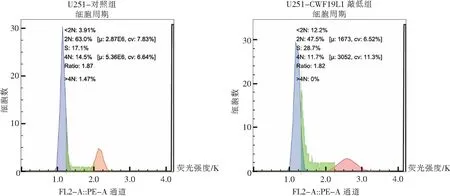
图4 流式细胞术检测CWF19L1敲低组与对照组对细胞周期的影响(n=3)
2.5 敲低CWF19L1对胶质瘤细胞的增殖、迁移和侵袭能力的影响
CCK-8实验结果显示,转染质粒的细胞样本吸光度明显升高(P<0.001),见图5,提示敲低CWF19L1后,胶质瘤细胞的增殖能力显著提升,这进一步验证了CWF19L1作为肿瘤抑制基因对肿瘤增殖的抑制作用。通过在不同处理组细胞中进行划痕实验,结果显示,敲低组中细胞通过相同时间的培养后,划痕间距较未处理组明显缩短(P<0.001),见图6,提示CWF19L1对于肿瘤细胞的迁移存在明显的抑制作用。Transwell结果进一步显示,敲低细胞内CWF19L1的表达后,细胞的侵袭能力显著增强,处理组细胞系在Transwell小室中出现的细胞数量超过对照组(P<0.001),见图7。
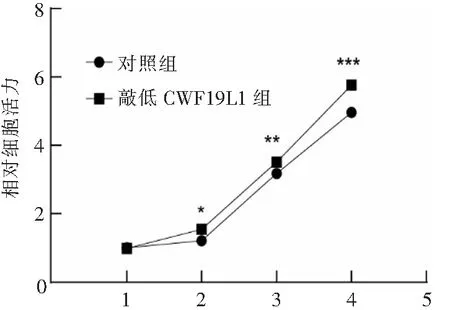
时间/dn=3。*P<0.05,**P<0.01,***P<0.001。图5 敲低CWF19L1的表达对细胞增殖能力的影响
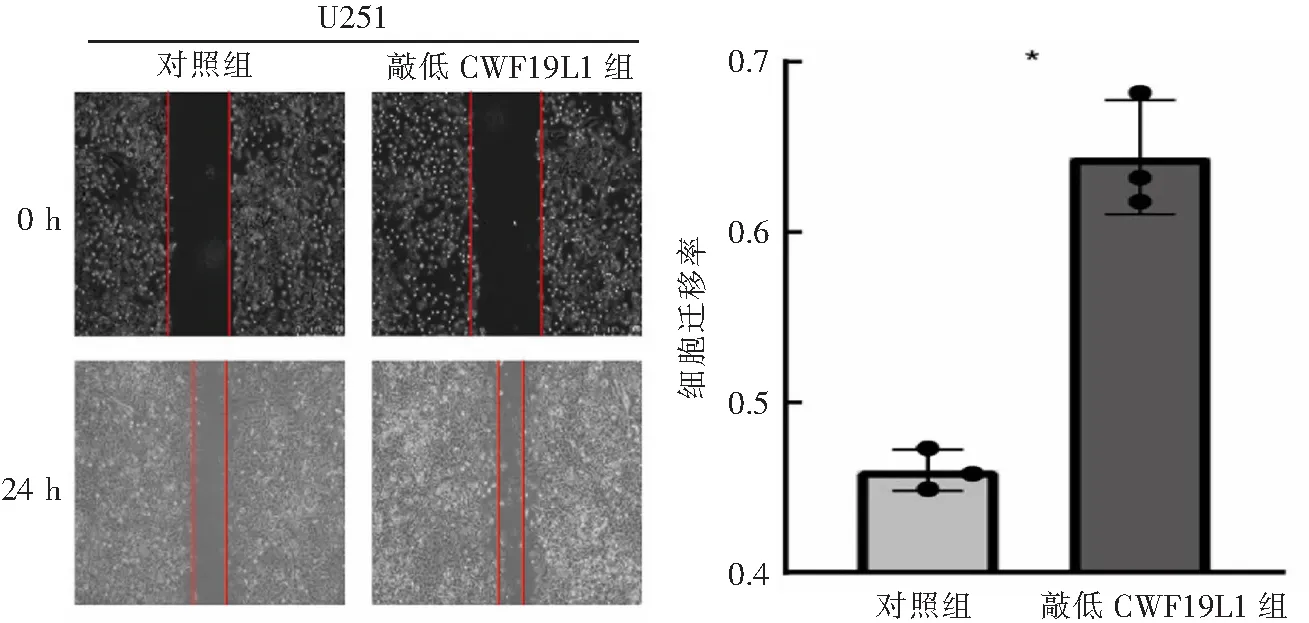
n=3,*P<0.001。图6 敲低CWF19L1的表达对细胞迁移能力的影响

n=3,*P<0.001。图7 敲低CWF19L1的表达对细胞迁移和侵袭能力的影响
3 讨论
胶质瘤是颅内最常见的恶性肿瘤,是神经系统致死率最高的肿瘤之一,对其发生发展机制的研究已持续几十年,已有一部分实验研究应用于胶质瘤的临床治疗,但由于血脑屏障的存在及其对大部分药物具有较强的阻隔效应,不能将药物扩散至颅内发挥作用,因此药物治疗往往收效甚微[8]。肿瘤的发生发展与细胞周期的进程密切相关,通过改变细胞周期的进展从而对肿瘤细胞的增殖与浸润产生影响[9-11]。表观遗传学说明了肿瘤的发生与基因改变之间的联系,原癌基因表达升高或抑癌基因表达抑制是肿瘤发生的主要因素之一,基因表达水平研究的不断深入能从分子水平解答肿瘤的病因及影响因素,并凭此开发新的肿瘤治疗方案。
鉴于在肿瘤样本中CWF19L1表达相较于正常样本普遍升高,但其在胶质瘤发生发展过程中并未发生明显的突变现象,而肿瘤细胞的恶性进程激发了CWF19L1抑制肿瘤细胞周期的作用[12]。在分子水平上表现为肿瘤组织中CWF19L1表达升高,但其发挥的抑癌作用的效力只能减缓肿瘤细胞的进展,不能达到杀伤肿瘤细胞的目的。
除了通过细胞周期调节肿瘤细胞生理特征的作用,还有研究[13]表明,CWF19L1基因突变可能导致其他脑部疾病。例如,CWF19L1发生基因突变导致早发常染色体隐形小脑共济失调,提示CWF19L1通过细胞通路调控细胞生物学行为的方式并不单一。CWF19L1通过直接影响细胞周期对细胞生命活动起到的调控作用有限,CWF19L1还可能通过作用于miRNA进而调节细胞过程,有实验[14-16]证明CWF19L1可调控细胞中miR-132-3p水平,对骨髓间充质干细胞的成骨分化加以调控,从而对成骨作用产生调控。临床亦有报道[17]称CWF19L1突变导致胎儿脊柱畸形与六指畸形,更确定了其在成骨过程中的调控作用。
敲低CWF19L1表达肿瘤细胞的增殖、迁移和侵袭能力均有所提高,但产生这种提高的可能原因有CWF19L1蛋白质对细胞周期的直接作用以及CWF19L1通过调控miRNA间接对肿瘤细胞的各种生理过程产生影响[18-21],但其具体调控机制或哪条途径对肿瘤恶性功能的影响更大,需要通过后续实验加以验证,探究新的CWF19L1相关调控轴。敲低CWF19L1改变肿瘤细胞特性也可能是通过调控轴实现,最终促进肿瘤的增殖、迁移与侵袭。应用相关药物改变调控轴中各分子的含量,从而定向调控细胞的各项生命活动,为限制肿瘤的进展,甚至达到治愈肿瘤提供了新的治疗靶点[22]。
综上所述,CWF19L1作为抑癌基因,其表达与细胞周期紧密联系,因此通过调控胶质瘤细胞中该蛋白的表达,能显著影响细胞周期,对肿瘤细胞的增殖,迁移及浸润产生作用,可作为治疗胶质瘤的潜在靶点。

