靶向鉴别、检测动物双歧杆菌的引物探针及应用
杜丽霞,李 典,禚惠荣,石梦楠,陈延宁,李岚芳,侯少阳
(菏泽学院药学院,菏泽 274015)
肠杆菌基因组间重复序列(enterobacterial repetitive intergenic consensus,ERIC)首先由Sharples等[1]在大肠埃希菌中发现的,后经曹又方等[2]对46株菌的全基因序列进行搜索分析,证明ERIC 序列是主要存在于肠杆菌基因组的重复序列。ERIC序列在基因组的位置分布及重复方式等方面有着较大差别[3],因此常被用作肠杆菌科细菌鉴定的方法[4-5]。Versalovic 等[6]根据ERIC 核心序列设计了一 对 特 异 性 引 物(ERIC1:5′-ATGTAAGCTCCTGGGGATTCAC-3′,ERIC2:5′-AAGTAAGTGACTGGGGTGAGCG-3′)用于扩增ERIC 序列,可获得不同肠杆菌的特异性DNA 指纹图谱[7-9]。ERIC 序列的高度保守性、通过ERIC-PCR技术获得的DNA指纹图谱的高度稳定性以及ERIC-PCR 反映细菌特征性条带的特点使得ERIC-PCR 技术相对于传统细菌鉴定方法较为简单、快速,目前被广泛应用于微生物学的肠杆菌鉴别分类方面[10-11]。
动物双歧杆菌作为一种可用于奶粉等乳制品的双歧杆菌,是一种提高机体免疫能力、促进婴幼儿免疫系统发育的重要益生菌[12-14]。动物双歧杆菌为革兰氏阳性菌,形态多样,但多呈分叉状,为专性厌氧菌,发酵产物中含有多种糖类;在抑制病原体生长、提高机体巨噬细胞活性、调节胃肠道功能、降低机体胆固醇水平等方面具有十分重要的作用[15-16],且已列入国家《可用于食品的菌株名单》。但传统的鉴别动物双歧杆菌的方法操作复杂且操作过程中容易被污染[17-19]。本研究基于ERIC-PCR 技术,设计的两对特异性引物探针,优化了目前相对传统的动物双歧杆菌纯培养及平板计数鉴定方法,相比较于通过16S rRNA 测序后进行基因比对更为简单快速,并在一定程度上解决了应用SNP 基因分型技术[20]的TaqMan-MGB 探针法[21]对于实验设备及试剂的限制,具有成本低、特异性强的特点,可在多种菌株中简单、方便、快速、靶向检出极低含量的动物双歧杆菌。在生产生活、科研活动及医药健康等方面的应用具有广阔的应用前景。
1 材 料
1.1 试 剂
高纯度耐热DNA 聚合酶(南京诺唯赞生物科技股份有限公司);琼脂糖(西班牙Biowest 公司);2K plus Ⅱ DNA marker(北京全式金生物技术有限公司);溴化乙啶(ethidium bromide,EB,美国Amresco 公司);琼脂糖凝胶DNA 回收试剂盒(康为世纪生物科技有限公司);三羟甲基氨基甲烷、十二烷基硫酸钠(德国Sigma公司);RNase A 酶(北京索莱宝科技有限公司);纯净水(杭州娃哈哈集团有限公司);T5 载体(北京全式金生物技术有限公司);卡那霉素(北京索莱宝科技有限公司);ERICPCR 通用型引物ERIC-F-D/ERIC-R-D、特异性引物1124-2-F/1124-2-R,1124-3-F-1/1124-3-R-1(苏州金唯智生物科技有限公司);其他试剂均为市售分析纯。
1.2 仪 器
T100 Thermal PCR 仪(美国Bio-Rad 公司);DYY-6C 电泳仪(北京六一生物科技有限公司);ZF-20D 暗箱三用紫外分析仪(骥辉分析仪器上海有限公司);H1650-W 高速台式离心机(长沙高新技术产业开发区湘仪离心机仪器有限公司);Eporator电转仪(德国艾本德股份公司)。
1.3 菌 株
动物双歧杆菌HP-B1124、乳酸片球菌HPB1099、植物乳杆菌HP-B1098、嗜酸乳杆菌HPB1079、鼠李糖乳杆菌HP-B1083、戊糖乳杆菌HPB1122、德氏乳杆菌HP-B1105,均为本实验室分离、鉴别、保藏菌株;大肠埃希菌GB05 由山东大学张友明教授馈赠;动物双歧杆菌ATCC 25527、动物双歧杆菌BCRC 14668、动物双歧杆菌CCRC 14668、动物双歧杆菌CCUG 24606、动物双歧杆菌CCUG 33907、动物双歧杆菌CGMCC 1.2268、动物双歧杆菌JCM 1190 均购买自山东振昂科技有限公司。
1.4 培养基
乳酸菌培养基(lactic acid bacteria culture medium,MRS培养基,北京路桥)。
LB(Luria-Bertani)培养基蛋白胨10 g,酵母浸粉5 g,氯化钠5 g,蒸馏水1 L,pH 7.2;121 ℃灭菌30 min;LB固体培养基需另加琼脂20 g。
2 方 法
2.1 动物双歧杆菌HP-B1124基因组DNA 的提取与纯化
本研究运用改良的SDS-碱裂解法[22]对动物双歧杆菌HP-B1124 基因组DNA 进行提取与纯化。具体方法为:将动物双歧杆菌HP-B1124 接种于MRS 固体培养基培养48 h,挑取少量菌体至EP 管中。按顺序加入碱裂解液Ⅰ(25 mmol/L pH 8.0 Tris-Cl,50 mmol/L 葡 萄 糖,10 mmol/L pH 8.0 EDTA)、溶菌酶(50 mg/mL)、RNase A 酶(10 mg/L)100 μL,950 r/min振摇1 min。其次,加入碱裂解液Ⅱ(1% SDS,0.2 mol/L NaOH 溶液)200 μL,碱裂解液Ⅱ需现用现配,上下振荡5 次使得混合均匀,后将其冰浴30 min。然后加入经过预冷的碱裂解液Ⅲ(冰乙酸11.5 mL,5 mol/L 醋酸钾60.0 mL,灭菌双蒸水28.5 mL)160 μL,上下振荡5次,冰浴5 min后12 500 r/min离心5 min。取上清液460 μL,加入苯酚-氯仿-异戊醇(25∶24∶1)460 μL 使其混合均匀,12 500 r/min 离心5 min,取上清液460 μL,加入2 倍体积的冰冻无水乙醇,混均,室温条件下使得DNA 沉淀10 min 后12 500 r/min 离心5 min,37 ℃条件下使沉淀干燥。加入70%的乙醇1 mL,上下颠倒混匀后离心,干燥沉淀。加入含有RNase A 酶(10 mg/L)的1 × TE 溶液50 μL,使得沉淀重悬,于−20 ℃保存备用。本研究中所涉及菌株的基因组DNA皆采用此方法进行提取与纯化。
2.2 动物双歧杆菌HP-B1124 ERIC-PCR 反应条件的优化
2.2.1 合成ERIC-PCR 相关引物序列 本实验由金唯智公司合成的ERIC-PCR引物为:
ERIC-F-D:5′-ATGTMAGCTCCTGKGGHTTCA C-3′;
ERIC-R-D:5′-AAGTABGTGACTWGGGTSAG CG-3′。
2.2.2 确定最佳ERIC-PCR 反应体系 通过多次对ERIC-PCR反应体系的退火温度、延伸时间、DNA浓度、引物浓度、Mg2+浓度等进行优化改善,即四因素三水平实验确定可以用于实验所涉及的动物双歧杆菌HP-B1124 的最佳ERIC-PCR 反应体系。四因素三水平实验相关数据如表1。后取四因素三水平实验所得ERIC-PCR 产物5 μL 采用0.8%琼脂糖凝胶电泳进行鉴定以寻找最佳反应体系。

Table 1 Data form related to the four factors at three levels
2.3 回收获得ERIC基因片段
对所得ERIC-PCR 产物采用0.8%的琼脂糖凝胶电泳鉴定。后采用康为世纪琼脂糖凝胶DNA 回收试剂盒对长度为750 bp 及1 000 bp 左右的片段进行胶回收。取胶回收产物3 μL 与上样缓冲液2 μL混合均匀后采用0.8%琼脂糖凝胶电泳验证。
2.4 将ERIC基因片段连接T载体后进行测序
从LB固体培养基上挑取大肠埃希菌GB05-dir接种至液体LB 培养基过夜培养,取培养液40 μL加入液体LB 培养基1.3 mL 中37 ℃培养1.5 h。9 300 r/min 离心30 s,弃上清液,加入双蒸水1 mL重悬。9 700 r/min 离心30 s;加入双蒸水1 mL 重悬。11 000 r/min 离心30 s,弃上清液,留液体约50 μL,即得感受态细胞。
向所得感受态细胞中加入胶回收ERIC-PCR片段2 μL及T载体0.5 μL,吹吸混匀,于25 ℃孵化器中连接25 min;1 350 V 电击,静置5 min。液体LB 培养基800 μL 洗出上述菌体,37 ℃、950 r/min复苏1 h;8 000 r/min 离心1 min;弃上清液,留液体LB 培养基约200 μL 重悬菌体。将重悬后菌液涂布于卡那抗性的LB 平板上,37 ℃倒置培养过夜,至有单克隆抗体长出。T 载体型号:T5 Simple Cloning Vector(北京全式金生物技术有限公司)。
挑取卡那抗性的LB平板上的单克隆抗体至液体卡那霉素抗性的LB 培养基1.3 mL 中培养2 h。取菌液1 μL 为模板,采用T7/T7-Term 通用型引物进行验证PCR 反应。将所得PCR 产物采用0.8%的琼脂糖凝胶电泳验证,将验证结果为阳性的PCR产物送至金唯智公司测序。
2.5 针对测序结果设计特异性引物探针
将测序结果运用DNAMAN 进行序列拼接,将序列拼接结果导入Primer Premier 5 和Oligo 7 中,根据引物设计原则,设计出特异性引物。
2.6 引物探针设计检验
以动物双歧杆菌HP-B1124 裂解后所得DNA为模板,使用高纯度耐热DNA 聚合酶,选用本文所设计的特异性引物探针进行PCR 反应。所涉及PCR 反应体系为四因素三水平实验所得优化后的ERIC-PCR 反应体系。对所得PCR 产物进行0.8%琼脂糖凝胶电泳验证。
2.7 引物探针特异性检验
将乳酸片球菌HP-B1099、植物乳杆菌HPB1098、嗜酸乳杆菌HP-B1079、鼠李糖乳杆菌HPB1083、戊糖乳杆菌HP-B1122、德氏乳杆菌HPB1105、大肠埃希菌GB05 作为引物探针特异性检验的对照,选用本实验所设计的特异性引物探针,分别对上述菌株及本文所研究的动物双歧杆菌HP-B1124 的 基 因 组DNA 进 行PCR 反 应,所 涉 及PCR 反应体系为四因素三水平实验所得优化后的ERIC-PCR 反应体系。对所得PCR 产物进行0.8%琼脂糖凝胶电泳验证。
2.8 引物探针可检测基因组DNA的含量限度检验
将乳酸片球菌HP-B1099、植物乳杆菌HPB1098、嗜酸乳杆菌HP-B1079、鼠李糖乳杆菌HPB1083、戊糖乳杆菌HP-B1122、德氏乳杆菌HPB1105、大肠埃希菌GB05 与动物双歧杆菌HPB1124 的基因组DNA 混合制成动物双歧杆菌HPB1124 基因组DNA 含量分别为100%(绝对含量1 300 ng/mL)、75%(绝对含量975 ng/mL)、35%(绝对含量455 ng/mL)、8%(绝对含量104 ng/mL)、0%(绝对含量0 ng/mL)的混合DNA 溶液,以此混合DNA溶液为模板,使用高纯度耐热DNA聚合酶,选用本文所设计的特异性引物探针,进行PCR 反应,所涉及PCR 反应体系为四因素三水平实验所得优化后的ERIC-PCR 反应体系。对所得PCR 产物进行0.8%琼脂糖凝胶电泳验证。
2.9 引物探针普适性检验
将动物双歧杆菌ATCC 25527,动物双歧杆菌BCRC 14668,动物双歧杆菌CCRC 14668,动物双歧杆菌CCUG 24606,动物双歧杆菌CCUG 33907,动物双歧杆菌CGMCC 1.2268,动物双歧杆菌JCM 1190 7 株动物双歧杆菌为引物探针普适性检验的对照,选用本实验所设计的特异性引物探针,分别对上述菌株的基因组DNA 及本文所研究的动物双歧杆菌HP-B1124 的基因组DNA 进行PCR 反应。所涉及PCR 反应体系为四因素三水平实验所得优化后的ERIC-PCR 反应体系。对所得PCR 产物进行0.8%琼脂糖凝胶电泳验证。
2.10 运用两对特异性引物检验市售公示配方中含有动物双歧杆菌的产品
选取5 种市售公示配方中含有动物双歧杆菌的产品,提取产品基因组DNA 为模板,选用本实验所设计的特异性引物探针,进行PCR 反应。所涉及PCR 反应体系为四因素三水平实验所得优化后的ERIC-PCR 反应体系。对所得PCR 产物进行0.8%琼脂糖凝胶电泳验证。
3 结 果
3.1 动物双歧杆菌HP-B1124 ERIC-PCR 反应条件的优化结果
经改良的SDS-碱裂解法进行提取与纯化后,所得动物双歧杆菌HP-B1124 基因组DNA 经测量后浓度为1 300 ng/mL。浓度适宜,可用于后续实验研究。
根据四因素三水平实验所得ERIC-PCR 产物进行0.8%琼脂糖凝胶电泳验证结果见图1。结果显示在退火温度42 ℃、模板质量浓度为210 μg/L、引物浓度为21 μmol/L、Mg2+浓度为1.50 mmol/L 条件下动物双歧杆菌HP-B1124 ERIC-PCR 反应为9 组实验中效果最佳。本研究采用的ERIC-PCR。反应体系为预变性(92 ~ 99 ℃,8 ~ 15 min);变性(93 ~ 100 ℃,1 ~ 4 min);退火(42 ℃,1 min);延伸(68 ~ 78 ℃,3 ~ 5 min);循环(30 ~ 35 个);终延伸(68 ~ 78 ℃,10 min);保存(12 ~ 17 ℃)。模板浓度为210 μg/L、引物浓度为21 μmol/L、Mg2+浓度为1.50 mmol/L。
3.2 回收获得ERIC基因片段
选用图1 第2 泳道所示条带的反应体系对动物双歧杆菌HP-B1124 的基因组DNA 进行ERICPCR。对所得产物中长度750 bp 及1 000 bp 左右的条带进行胶回收。胶回收片段进行0.8%琼脂糖凝胶电泳验证,结果见图2。结果显示,胶回收成功得到明亮的长度为750 bp 及1 000 bp 左右的两条片段。

Figure 1 ERIC-PCR amplification products from the four factors at three levels M: 2K plus Ⅱ DNA marker; Lane 1−9: Corresponding to table 1 group 1−9
3.3 ERIC基因片段连接T载体测序结果
将长度750 bp 及1 000 bp 左右的条带胶回收后的产物连接T载体后进行测序,根据测序结果可得1124-2、1124-3 两条目的片段(将长度为794 bp的目的片段命名为1124-2,将长度为412 bp 的目的片段命名为1124-3)。两条目的片段序列已上传GenBank数据库,接收序列号分别为OP081084、OP081085。
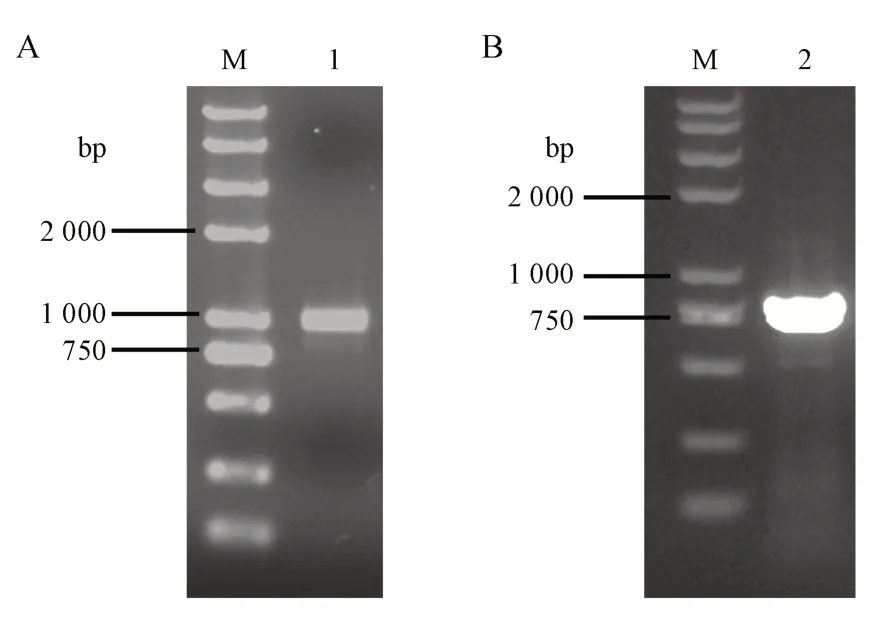
Figure 2 Two ERIC gene fragments of HP-B1124 M: 2K plus Ⅱ DNA marker; Lane 1: Bifidobacterium animalis HPB1124 gel extraction DNA (about 1 000 bp); Lane 2: Bifidobacterium animalis HP-B1124 gel extraction DNA (about 750 bp)
3.4 针对测序结果设计特异性引物探针
将运用DNAMAN进行序列拼接后所得结果导入Primer Premier 5 和Oligo 7,根据引物设计原则,设计出两对特异性引物探针,序列见表2。
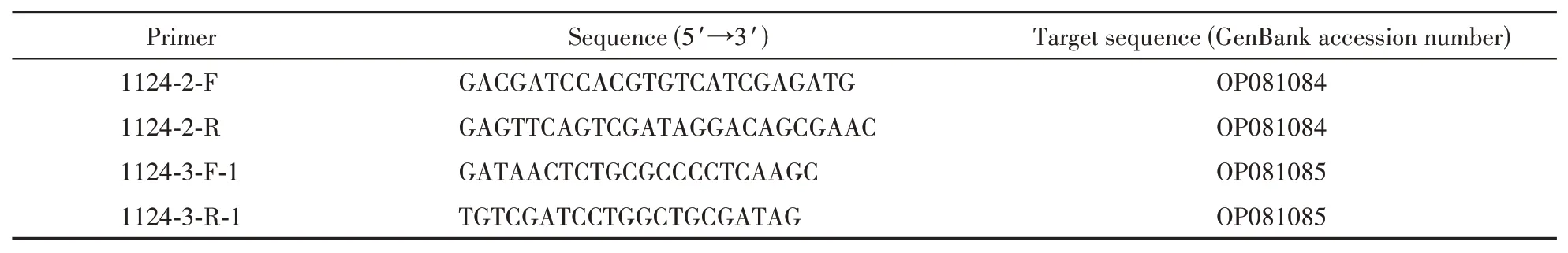
Table 2 PCR primers used in the study
由SnapGene 分析可知,所设计的两对特异性引物探针可扩增的理论产物长度分别为786 bp 和283 bp。
3.5 引物探针设计检验
为检验所设计的两对特异性引物探针能否扩增出理论长度为786 bp,283 bp 的两条目的片段,本研究依照“2.6”项所示方法,将所得PCR 产物进行0.8%琼脂糖凝胶电泳验证,结果见图3。结果显示,所设计的两对特异性引物探针可扩增出长度为786 bp左右,283 bp左右的两条目的片段。
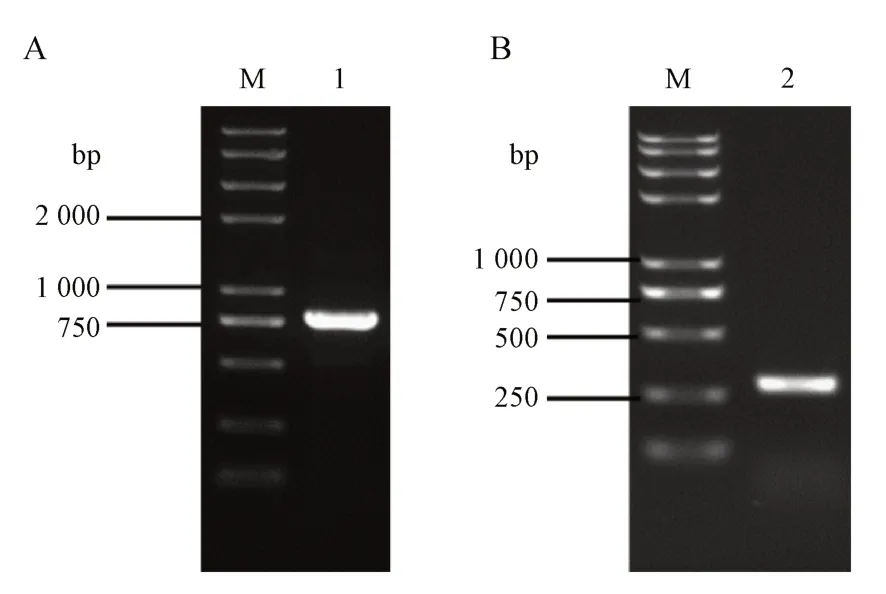
Figure 3 Accuracy test of the primer probes M: 2K plus Ⅱ DNA marker; Lane 1: 1124-2-F/1124-2-R; Lane 2: 1124-3-F-1/1124-3-R-1
3.6 引物探针特异性检验
为验证所设计的两对特异性引物探针可以特异性的鉴别出动物双歧杆菌,本研究依照“2.7”项所示方法,将所得PCR 产物进行0.8%琼脂糖凝胶电泳验证,结果见图4。结果显示,乳酸片球菌HPB1099、植物乳杆菌HP-B1098、嗜酸乳杆菌HPB1079、鼠李糖乳杆菌HP-B1083、戊糖乳杆菌HPB1122、德氏乳杆菌HP-B1105、大肠埃希菌GB05与动物双歧杆菌HP-B1124 8 株菌株中,只有动物双歧杆菌HP-B1124 可显示完整明亮的目的片段,其他7 株菌株皆不显示完整明亮的目的片段。因此可知引物探针1124-2-F/1124-2-R,1124-3-F-1/1124-3-R-1对动物双歧杆菌具有特异性。
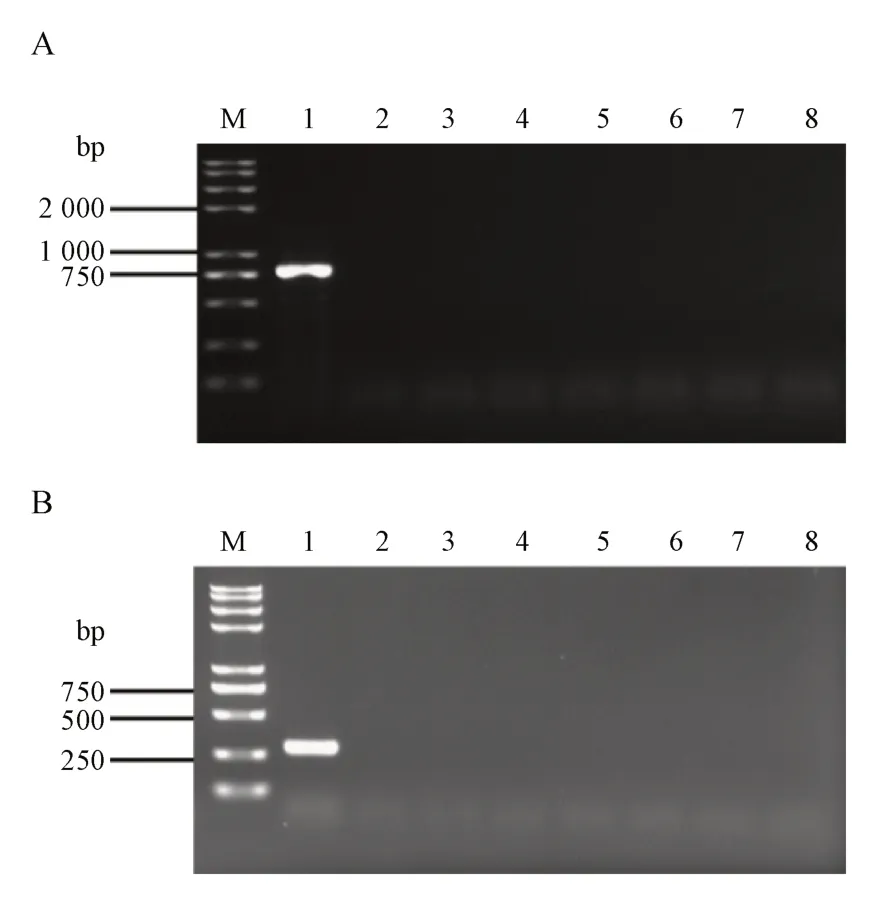
Figure 4 Specificity test of the primer 1124-2-F/1124-2-R (A) and 1124-3-F-1/1124-3-R-1 (B)M: 2K plus Ⅱ DNA marker; 1: Genomic DNA of Bifidobacterium animalis HP-B1124; 2: Pediococcus acidilactici HP-B1099; 3: Lactiplantibacillus argentoratensis HP-B1098; 4: Lactobacillus acidophilus HPB1079; 5: L. rhamnosus HP-B1083; 6: L. pentosus HP-B1122; 7: L. delbrueckii HP-B1105; 8: Escherichia coli GB05
3.7 引物探针可检测基因组DNA的含量限度检验
为确定本研究所设计的两对特异性引物探针可检测的基因组DNA 含量限度,本研究依照“2.8”项所示方法,以此混合DNA 溶液为模板进行PCR反应。将所得PCR 产物进行0.8%琼脂糖凝胶电泳验证,结果见图5。结果显示,在动物双歧杆菌HP-B1124 基因组DNA 含量为8%(绝对含量104 ng/mL)时,引物探针1124-2-F/1124-2-R,1124-3-F-1/1124-3-R-1仍可以扩增出目的片段。
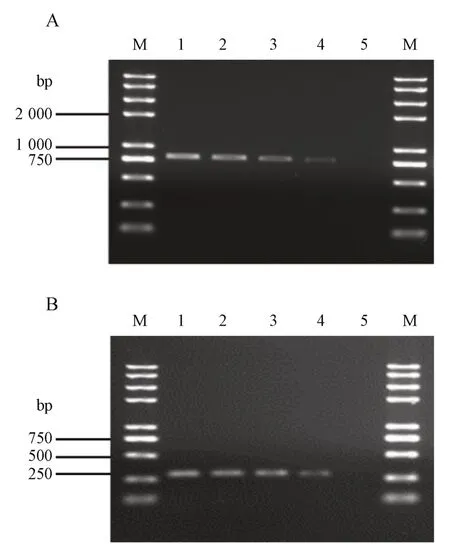
Figure 5 Content limit test of detectable genomic DNA for primer 1124-2-F/1124-2-R (A) and 1124-3-F-1/1124-3-R-1(B)M: 2K plus Ⅱ DNA marker; 1: B. animalis HP-B1124 genomic DNA were 100% (absolute 1 300 ng/mL); 2: 75% (absolute 975 ng/mL);3: 35% (absolute 455 ng/mL); 4: 8% (absolute 104 ng/mL); 5: 0%(absolute 0 ng/mL)
3.8 引物探针普适性检验
为验证所设计的两对特异性引物探针对动物双歧杆菌具有普适性,可鉴别出动物双歧杆菌,本研究依照“2.9”项所示方法,将所得PCR 产物进行0.8%琼脂糖凝胶电泳验证,结果见图6。结果显示,引物探针1124-2-F/1124-2-R,1124-3-F-1/1124-3-R-1 对动物双歧杆菌HP-B1124,动物双歧杆菌ATCC 25527,动物双歧杆菌BCRC 14668,动物双歧杆菌CCRC 14668,动物双歧杆菌CCUG 24606,动物双歧杆菌CCUG 33907,动物双歧杆菌CGMCC 1.2268,动物双歧杆菌JCM 1190 8 株动物双歧杆菌皆可扩增出目的片段。因此,引物探针1124-2-F/1124-2-R,1124-3-F-1/1124-3-R-1 对动物双歧杆菌具有普适性。
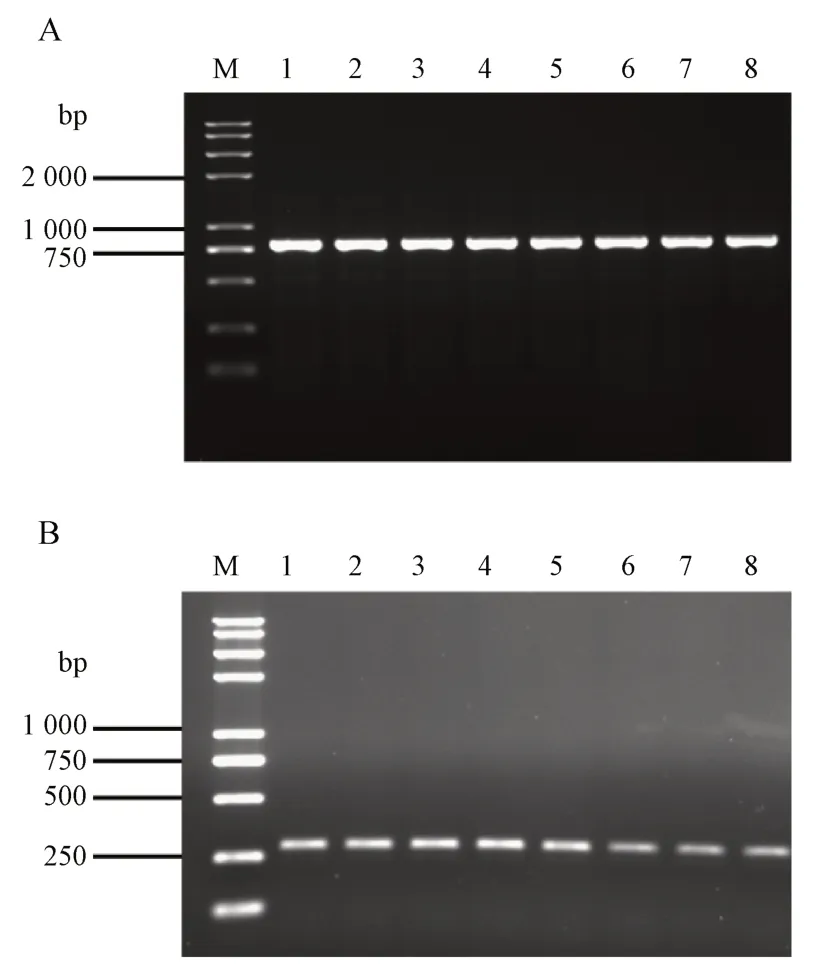
Figure 6 Universal test of the primer 1124-2-F/1124-2-R(A)and 1124-3-F-1/1124-3-R-1(B)M: 2K plus Ⅱ DNA marker; 1: Genomic DNA of B. animalis HPB1124; 2: B. animalis ATCC 25527; 3: B. animalis BCRC 14668;4: B.animalis CCRC 14668; 5: B.animalis CCUG 24606; 6: B.animalis CCUG 33907; 7: B.animalis CGMCC 1.2268; 8: B.animalis JCM 1190
3.9 运用两对特异性引物检验市售公示配方中含有动物双歧杆菌的产品
为验证所设计的两对特异性引物探针的市场可实用性,本研究依照“2.10”项所示方法,将所得PCR 产物进行0.8%琼脂糖凝胶电泳验证,结果见图7。结果显示,针对动物双歧杆菌HP-B1124 及5 种市售公示配方中含有动物双歧杆菌的产品,引物探针1124-2-F/1124-2-R,1124-3-F-1/1124-3-R-1皆可扩增出相应目的片段。
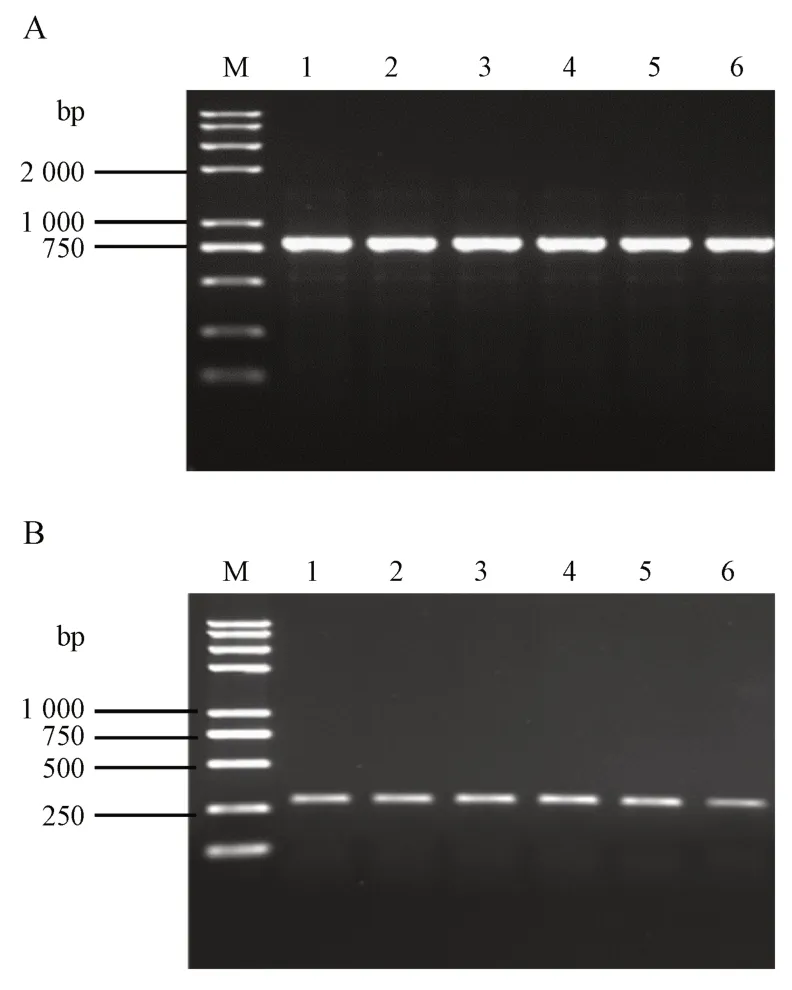
Figure 7 Specific primer probes were used to test commercially available published formula products containing B.animalis M: 2K plus Ⅱ DNA marker; Lane 1−6 in Figure 7-A: 1124-2-F/1124-2-R as primers, genomic DNA of B. animalis HP-B1124 and genomic DNA of products containing B. animalis in commercially published formulations 1−5 as templates; Lane 1−6 in Figure 7-B: 1124-3-F-1/1124-3-R-1 as primers, genomic DNA of B. animalis HP-B1124 and genomic DNA of products containing B. animalis in commercially published formulations 1−5 as templates
4 讨 论
ERIC-PCR 技术凭借可对细菌DNA 进行指纹图谱分析等优点被应用于细菌分类和鉴定方面。本研究便以ERIC-PCR 技术为基础,通过四因素三水平实验不断优化ERIC-PCR 反应条件来寻找动物双歧杆菌HP-B1124的DNA 指纹图谱,并提取动物双歧杆菌HP-B1124 长度为1 000 bp,750 bp 左右的目的片段用于设计特异性引物探针。将所提取片段连接T 载体测序后设计出1124-2-F/1124-2-R,1124-3-F-1/1124-3-R-1两对特异性引物探针(两条片段的序列已上传GenBank 数据库,接收序列号分别为OP081084、OP081085)以用于动物双歧杆菌的鉴定。本研究通过检验两对特异性引物探针的特异性、普适性、可检测基因组DNA 时的含量限度以及是否可鉴定出市售产品中含有动物双歧杆菌进一步增强了引物探针1124-2-F/1124-2-R,1124-3-F-1/1124-3-R-1 的可靠性及可实用性。通过本研究检验可知,本研究所设计的两对特异性引物探针可对动物双歧杆菌特异性的扩增出两条长度为786 bp和283 bp的目的片段。
本研究中两对特异性引物探针可用于多种动物双歧杆菌的鉴定,具有普适性;但无法通过两对引物探针确定其具体株名信息,在具有普适性的同时也有相对的局限性。寻找到一种可简单、快速识别菌种的方法对于未来菌种研究等方面具有十分重要的意义。
综上所述,本研究所设计的两对特异性引物探针优化了目前相对传统的动物双歧杆菌纯培养及平板计数鉴定方法,改善了传统的鉴别动物双歧杆菌的方法操作相对复杂且操作过程中容易被污染的缺点,相比较于目前应用的SNP 基因分型法及实时荧光定量PCR 法等具有成本低、特异性强的特点,可简单、快速、靶向的用于混合菌株中动物双歧杆菌的鉴定,对于科研活动及日常生活具有较强实用性。

