落叶型天疱疮发病的关键基因和通路:基于生物信息学方法
朱雅倩, 李欣辉, 贾子悦, 陈永锋
1.安徽医科大学广东皮肤病临床学院,2.南方医科大学皮肤病医院,广东 广州 510091
天疱疮是一种慢性复发性炎症性大疱性疾病,主要临床表现为皮肤和黏膜的红斑、水疱、糜烂[1]。落叶型天疱疮(pemphigus foliaceus,PF)是天疱疮的一种经典类型,其水疱仅累及皮肤,黏膜较少受累[2-3]。PF患者血清中存在抗桥粒芯蛋白(desmoglein,DSG)1抗体,其与DSG结合后导致角质形成细胞之间的黏附丧失,诱导水疱的形成。抗DSG1抗体的产生被认为与遗传、免疫耐受、免疫失衡、病毒感染、药物等因素相关[4],但对于各因素在天疱疮发生过程中的具体作用,目前仍缺少清晰的认识。天疱疮的发病受到多种基因调控。HLA-DRB1和HLA-DQB1已被证实与天疱疮的发病相关,TLR2、TLR3、ST18等基因也可能在天疱疮发病过程中起着一定作用[5],但具体分子机制还有待进一步探究。目前天疱疮的治疗除了传统的糖皮质激素及免疫抑制剂以外,主要研究集中于靶向B细胞及IgG抗体,如CD20单抗、新生儿Fc受体(FcRn)拮抗剂、B细胞激活因子拮抗剂、BTK抑制剂等[6]。PDE4抑制剂及JAK抑制剂在天疱疮中的应用证明了其他通路的小分子药物在治疗天疱疮中的前景,而各种炎症信号通路在天疱疮中的作用也亟待进一步探索。由于实验技术的限制,目前天疱疮的研究主要集中于体外实验,缺少JAK-STAT、Toll-like受体等炎症通路在天疱疮中作用的相关机制研究。
T细胞亚群在PV发病机制中的关键作用已被充分证实。PV患者外周血中,T细胞亚群的比例和功能存在异常[7]。CD4+T 淋巴细胞在病灶皮肤和周围的组织中表达明显上升,释放白介素4、白介素5、白介素6的CD4+T细胞是DSG1的反应性细胞[8]。为进一步探究CD4+T细胞在PF发病过程中的作用,以及与天疱疮发病相关的基因及通路,本研究采用生物信息学方法筛选出与PF发病相关的候选基因,并使用受试者工作特征(receiver operating characteristic, ROC)曲线判断候选基因对PF的诊断效能,最终确定与PF发病相关的关键基因及通路,为PF的进一步研究提供依据。
1 资料与方法
1.1 PF患者外周血CD4+ T细胞数据集的获取
使用关键词“pemphigus foliaceus,CD4+T cell”在GEO数据库中检索PF患者外周血CD4+T 细胞的基因表达谱。筛选数据集的标准如下:①测序样本包括PF患者外周血CD4+T细胞;②包括病例和对照;③有可用的处理或原始数据供分析。经比较和筛选后,研究选取编号为GSE53873的PF患者外周血CD4+T细胞基因芯片数据集,选取其中10个未治疗的PF患者样本作为PF组,以及5个健康对照作为健康对照组(health control,HC)[9-10]。
1.2 数据的归一化与标准化处理
为将数据归一化及标准化处理,将获取的表达矩阵去除空值比例大于50%的行(基因)和空值比例大于50%的列(样本),得到的矩阵使用“impute”R软件包对缺失值采用最近邻居法(K-nearest neighbor, KNN)进行填充,最后进行log2(x+1)转换,得到表达矩阵[11]。
1.3 差异表达分析
使用R语言软件(版本 3.4.6)的“limma”包进行差异分析,获得PF组与HC组间的差异基因。差异表达基因筛选标准为倍数变化(fold change,FC)≥2[12],P<0.05。
1.4 蛋白质-蛋白质相互作用网络的构建与分析
使用差异基因构建蛋白质互作网络,将差异基因导入STRING蛋白质数据库(STRING Version 11.5;https://string-db.org/),以获得蛋白质-蛋白质相互作用网络,并使用Cytoscape软件进行可视化,使用CytoCNA插件中的度值筛选候选基因,筛选度值>9的基因作为候选基因[13]。
1.5 判断候选基因对PF的诊断效能
使用微生信在线工具(http://www.bioinformatics.com.cn/)中的ROC曲线进行分析及可视化[14]。ROC曲线下的面积值(area under ROC curve,AUC)在0.5和1之间。AUC越接近于1,说明诊断效果越好。AUC在 0.5~0.7时有较低准确性,AUC在0.7~0.85时有一定准确性,AUC在0.85以上提示有较高准确性。筛选AUC>0.85的候选基因,将其确定为关键基因。
1.6 PF组和HC组关键基因表达量比较
使用SPSS软件(版本9.5.0.0)对PF患者以及HC的候选基因表达谱进行两个独立样本的Wilcoxon 秩和检验统计学分析,最后使用Graphpad Prism 8.0.2进行可视化[15],比较PF组和HC组患者外周血CD4+T细胞中关键基因的表达量差异。
1.7 基因功能和通路富集分析
使用R软件包“clusterProfiler”及“pathview”进行GO功能富集分析和KEGG通路分析,探索差异基因的生物学功能。筛选条件为P<0.05[16-19]。
2 结果
2.1 差异基因分析
将10例PF患者与5例HC患者外周血CD4+T细胞中的基因表达量进行差异分析,在P<0.05,差异倍数≥2的情况下,共鉴定了121个上调基因和48个下调基因,使用火山图与热图进行可视化(图1A、1B)。
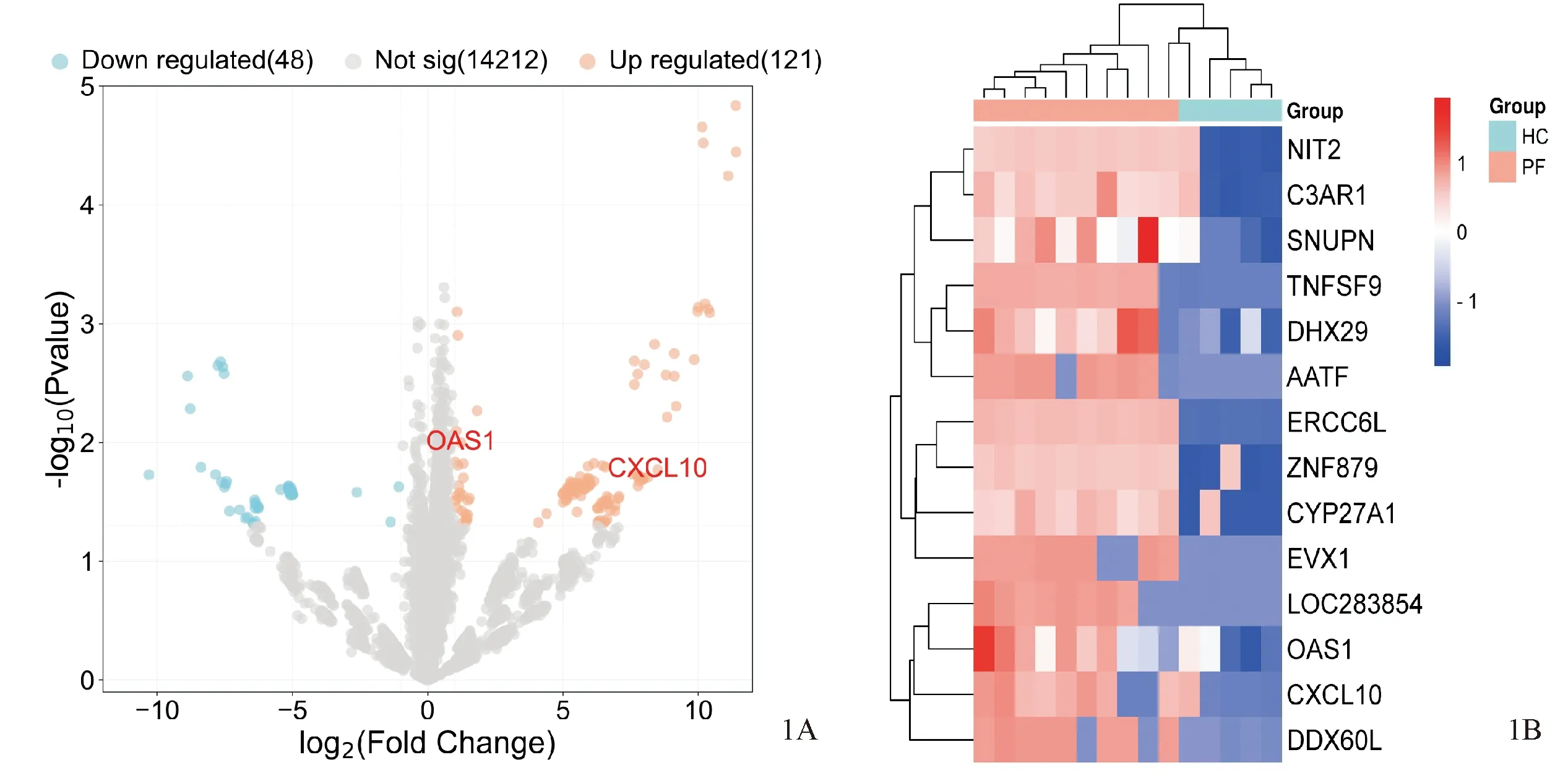
图1 两组患者差异基因分析 1A:火山图;1B:热图Figure 1 Analysis of differentially expressed genes between the two groups. 1A: Volcanic map; 1B:Heat map.
2.2 构建差异基因的蛋白质-蛋白质相互作用的网络
将PF组与HC组的基因差异分析得到的169个差异基因输入STRING数据库,构建蛋白质-蛋白质相互作用的网络,该网络共包含82个节点,142条边。使用Cytoscape中的CytoNCA插件计算PPI网络中节点的拓扑特征参数,筛选网络中度值大于9的基因,最终得到9个候选基因:CD14、CSF1R、LILRB2、CXCL10、TLR7、CCR5、IFNB1、OAS1、OASL,如图2所示,颜色越深说明该基因在该网络中直接连接度越高。

图2 蛋白质-蛋白质相互作用网络图Figure 2 The protein-protein interaction network.
2.3 CXCL10及OAS1为PF发病相关的关键基因
为判断候选基因的诊断效能,绘制ROC曲线并计算9个候选基因的AUC。9个候选基因的AUC分别为:CXCL10(AUC=0.86)、OAS1(AUC=0.86)、OASL(AUC=0.82)、CD14(AUC=0.82)、LILRB2(AUC=0.80)、TLR7(AUC=0.76)、CCR5(AUC=0.76)、CSF1R(AUC=0.74)、IFNB1(AUC=0.66)。结果提示CXCL10(AUC=0.86)及OAS1(AUC=0.86)对PF具有较高的诊断价值。因此,确定CXCL10及OAS1为诊断PF发病相关的关键基因(图3)。Wilcoxon秩和检验结果显示:PF患者CXCL10及OAS1的表达量明显高于HC组,两组间差异具有统计学意义(P<0.05,图4)。
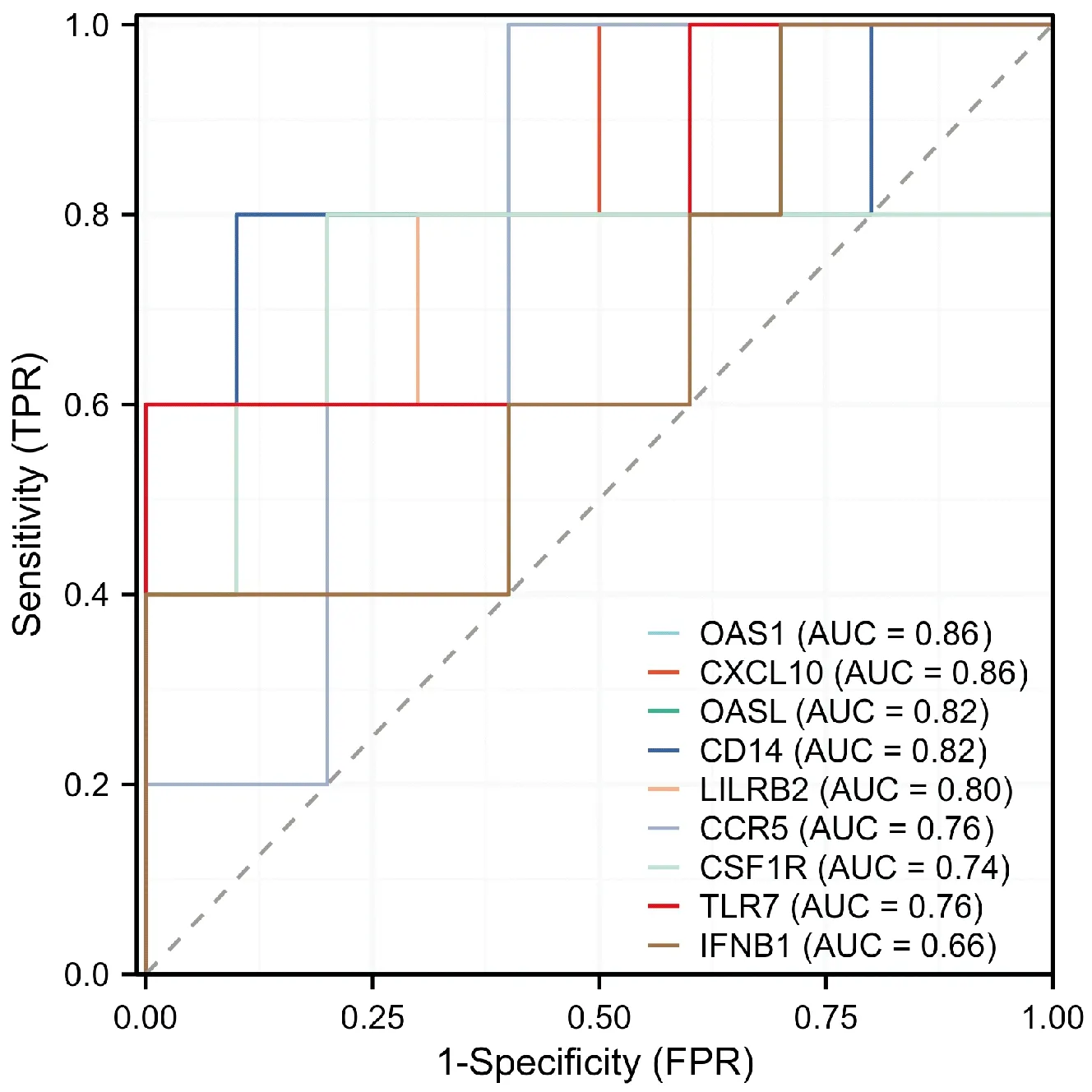
图3 两组外周血CD4+ T细胞中CXCL10及OAS1的ROC曲线Figure 3 ROC curves for CXCL10 and OAS1 in peripheral blood CD4+ T cells from PF and HC groups.
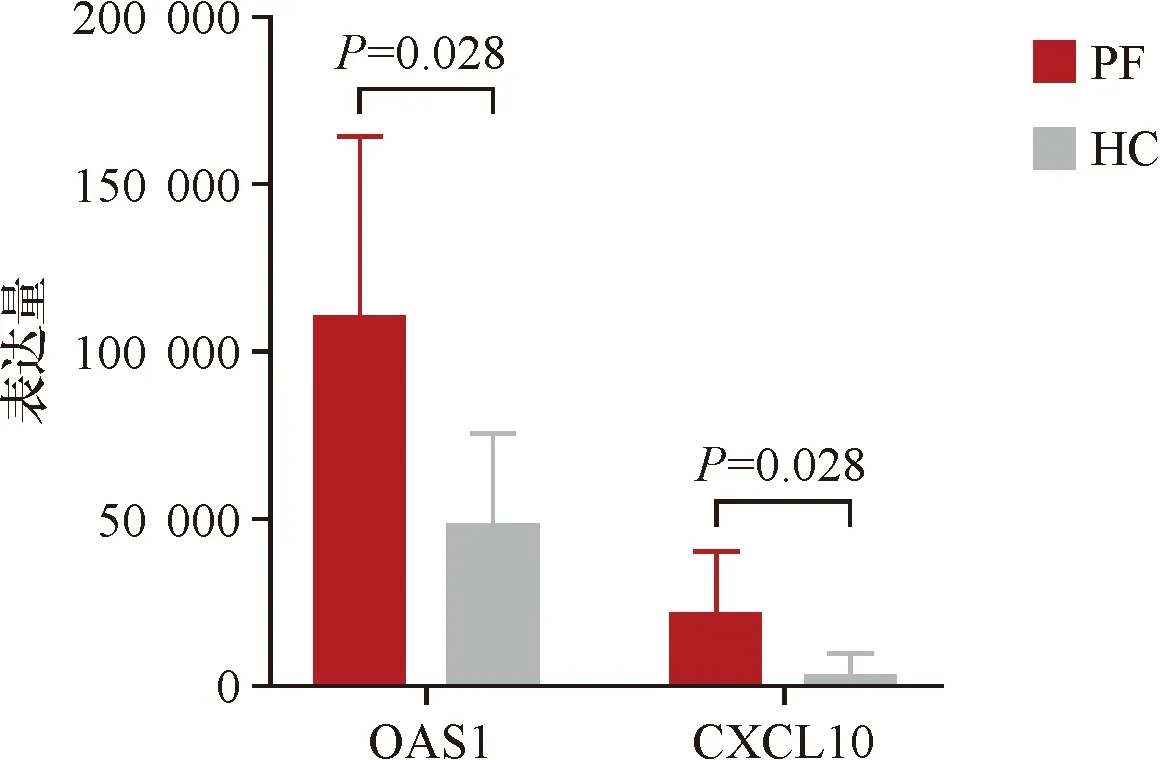
图4 两组外周血CD4+ T细胞中CXCL10及OAS1的表达量Figure 4 Expression of CXCL10 and OAS1 in peripheral blood CD4+ T cells in PF and HC groups.
2.4 差异基因的功能富集分析
将PF组与HC组之间的差异表达基因进行通路富集分析,GO富集分析显示,与HC组相比,PF组的差异基因主要富集在T细胞分化、T细胞活化、白细胞分化与代谢等多个通路(图5A)。KEGG富集分析结果表明,差异基因主要富集在造血细胞谱系、TOLL样受体信号通路、急性髓系白血病、破骨细胞分化、吞噬体、嘧啶代谢、脂质与动脉粥样硬化、细胞因子受体相互作用等方面(图5B)。通路富集分析提示CXCL10主要与TOLL样受体信号通路、COVID-19感染、细胞因子相互作用相关,而OSA1主要与病毒感染、Ⅰ型干扰素信号通路等相关。
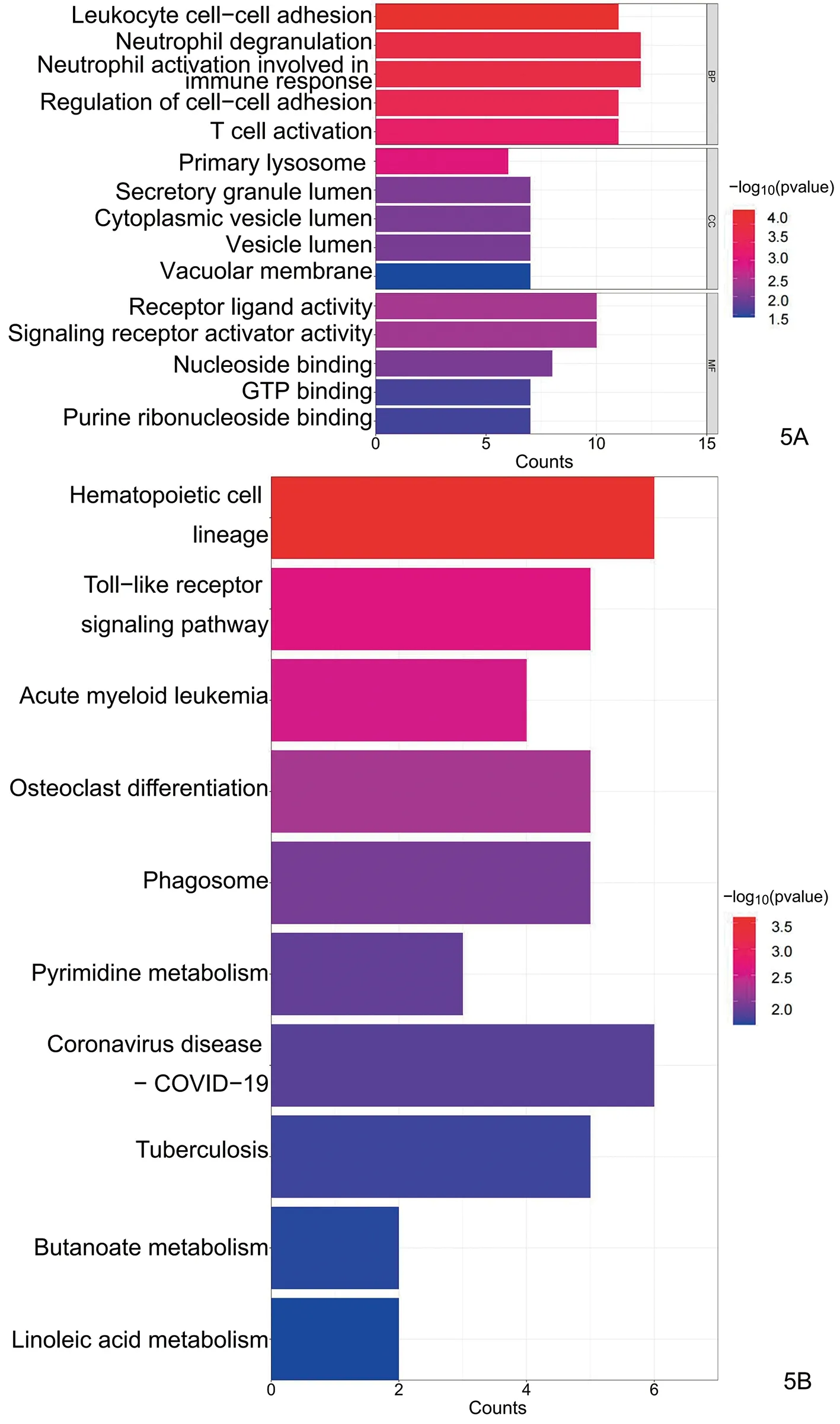
图5 PF组与HC组之间差异表达基因的富集分析 5A:GO富集分析;5B: KEGG分析Figure 5 Enrichment analysis of differentially expressed genes in the PF and HC groups. 5A:GO enrichment analysis; 5B:KEGG analysis.
3 讨论
目前已有较多研究证明CD4+T细胞在天疱疮及其他自身免疫性疾病中的重要作用[20-22]。PV患者外周血中单个核细胞(periphreal blood mononuclear cell, PBMC)中CD4+T细胞对DSG3抗原产生反应,而CD8+T细胞对DSG3抗原无反应,提示CD4+T细胞是参与这些患者自身免疫应答的主要T细胞群[23]。当PBMC中的CD4+T细胞耗竭时,抗DSG3抗体的产生受到了抑制[24]。以上研究证明了CD4+T细胞在抗DSG3抗体产生过程中的重要作用。Lin等[8]研究表明PF患者体内存在对DSG1特异性反应的CD4+T细胞,这些CD4+T细胞可以分泌白介素4、白介素6等,并且可能会刺激自身免疫B细胞产生抗DSG1自身抗体,表明CD4+T细胞在DSG1抗体产生的过程中也不可或缺。CD4+T细胞作为天疱疮抗体产生过程中的一个重要部分,是天疱疮研究中的一个重要领域,但关于天疱疮患者外周血CD4+T细胞的转录组研究仍然较少。
本研究从GEO数据库中筛选PF患者外周血CD4+T细胞的基因表达谱,通过Limma差异分析、基因功能和通路富集分析、蛋白质-蛋白质相互作用网络分析等多种生物信息学分析,最终将CXCL10及OAS1确定为与PF发病相关的关键基因。CXCL10由免疫细胞、上皮细胞等分泌,是单核细胞和T细胞的趋化因子,可促进 T 细胞与内皮细胞的粘附[25-27]。CXCL10已被证实与多种免疫性疾病相关,包括类风湿关节炎、系统性红斑狼疮、干燥综合征、系统性硬化症和特发性炎症性肌病等[28-30]。2021年的一项动物研究表明,与健康对照组相比,犬类天疱疮病变组织中的T细胞和B细胞增多,并且CXCL10表达显著上调[31]。鉴于犬天疱疮与人类天疱疮具有相似的临床特征和变异,CXCL10在人类天疱疮的发病过程中也可能起着重要作用[32]。目前暂缺少CXCL10在PF患者外周血CD4+T细胞中的相关研究。本研究结果提示,与正常人相比,PF患者外周血CD4+T细胞中CXCL10基因表达显著上调,提示CXCL10可能与PF的发病相关,是PF发病的关键基因。
OAS1是一种干扰素诱导蛋白,在先天细胞抗病毒反应中起着关键作用,并与细胞生长和细胞凋亡有关[33]。既往关于OAS1的研究主要涉及系统性红斑狼疮、类风湿关节炎、干燥综合征等多种自身免疫性疾病[34-35]。本研究显示,PF患者的外周血CD4+T细胞中,OAS1的表达显著上调,与 HC组相比,存在统计学差异,且ROC曲线提示OAS1具有较高的诊断效能(AUC=0.86),提示OAS1可能与PF的发病相关,是PF发病的关键基因。
综上所述,本研究利用多种生物信息学技术对PF患者外周血CD4+T细胞基因芯片数据集进行分析,最终确定CXCL10及0AS1为与PF发病相关的关键基因。CXCL10主要与TOLL样受体信号通路、COVID-19感染、细胞因子相互作用相关,而OSA1主要与病毒感染、Ⅰ型干扰素信号通路等相关。

