INHBA在皮肤鳞状细胞癌中高表达
曹雪, 杨冰燕, 张弘扬, 董灵娣, 刘昱昕, 喻楠
1.巴彦淖尔市医院,内蒙古 临河 015000;2.宁夏医科大学总医院,宁夏 银川 750000
皮肤鳞状细胞癌(cutaneous squamous cell carcinoma,cSCC)是一种以异形鳞状细胞恶性增殖为主要病理学特征,多种理化因素共同参与的皮肤肿瘤,其发病率呈逐年上升趋势[1-2]。光线性角化病(actinic keratoses,AK)与cSCC关系密切,二者系同一病谱,被认为是cSCC发生浸润的癌前阶段[3]。AK、cSCC的发生与发展是多基因、多通路的复杂作用结果,其具体发病机制尚不完全明确。
抑制素β-A(INHBA)是转化生长因子β超家族的一个成员,具有高度保守性,广泛参与发育、生殖等各个环节。近年来,研究发现INHBA的高表达与恶性肿瘤紧密相关。现已证实,INHBA基因为原癌基因,在包括卵巢癌、直肠癌、头颈鳞癌等多种恶性实体肿瘤中过表达。INHBA能促进肿瘤细胞增殖与分化,同时也是评估肿瘤不良预后的重要指标之一[4-6],目前已成为恶性肿瘤治疗的新研究靶点。然而,有关INHBA与cSCC的相关性尚未完全阐明。因此,本研究通过免疫组化、RT-qPCR及Western blot的方法检测INHBA在cSCC组织中的表达水平,并与在AK、正常皮肤组织中的表达进行比较,以探讨其在cSCC发生、发展中的作用及可能机制。
1 资料与方法
1.1 一般资料
选取2020年1月—2022年5月就诊于宁夏医科大学总医院皮肤科的AK及cSCC的患者为研究对象。纳入标准:①组织病理证实为光线性角化病或皮肤鳞状细胞癌[7];②取材前未行系统或局部治疗。排除标准:①伴有基底细胞癌、恶性黑色素瘤等其他皮肤恶性肿瘤病史者;②临床资料留存不完整者。最终纳入AK、cSCC患者皮损组织各30例。另外纳入同时段就诊于我院的17例行美容手术的正常人表皮组织作为正常对照组(NS组)。3组间性别、年龄差异无统计学意义(表1)。本研究已通过本院医学伦理委员会审批,所有患者均知情同意。

表1 三组一般资料比较Table 1 Demographic characteristics
1.2 主要试剂和仪器
INHBA兔抗人多克隆抗体(美国Abcam公司),反转录试剂盒(大连宝生物公司),兔二步法试剂盒(北京中杉金桥公司),SDS凝胶配置试剂盒(江苏凯基生物公司)。电泳仪(美国Bio-Rad公司),分光光度仪(日本Hitachi公司),荧光PCR仪(瑞士Roche公司),显微镜(日本Olympus公司)。
1.3 实验方法
1.3.1 免疫组化法检测INHBA在3组中的表达水平 将新鲜皮损组织石蜡包埋后制片,脱蜡处理后过梯度乙醇水化,抗原热修复后,加入适量过氧化氢,PBS冲洗3次后滴加稀释后的一抗(稀释比1 ∶400),37 ℃温箱孵育3 h。滴加反应增强液,冲洗后滴加二抗,置于37 ℃温箱孵育40 min;滴加DAB显色剂,使用苏木精将切片复染,用盐酸酒精分化置于PBS缸中冲洗返蓝;将切片过梯度乙醇脱水,用中性树胶做封片处理。阳性细胞判定:INHBA阳性细胞表现为细胞质/核内出现黄染颗粒。使用光学显微镜随机观察5个视野,依据染色深浅程度及阳性细胞所占百分比判读结果。判定标准:无表达(-):无或<5%阳性细胞;低表达(+):淡黄,阳性细胞占5%~29%;中表达(++):黄色,阳性细胞占30%~59%;高表达(+++):棕黄色,阳性细胞≥60%。其中,高表达(+++)判定为强阳性表达。
1.3.2 RT-qPCR 检测INHBA mRNA在3组中的表达水平 将各组织充分研磨、裂解,加入氯仿、异丙醇,提取RNA沉淀,并测量各样本的OD值。建立10 μL的反应体系(5×预混液 2 μL,总RNA 2 μL,RNase Free dH2O 6 μL),利用得到的RNA反转录合成cDNA。建立20 μL反应体系(PCR上游引物、下游引物各0.8 μL,ROX 0.4 μL,cDNA 2 μL, ddH2O 6 μL,SYBR 10 μL),置于PCR仪中进行扩增反应(预变性95 ℃ 30 s,1个循环,95 ℃ 5 s,60 ℃ 34 s,共40个循环)。INHBA基因引物序列为F:5′-AAGAAGGGCGGAGGTGAAGG-3′;R:5′-GGCGATGAGGGTGGTCTTCA-3′(上海生工设计)。采用2-ΔΔCt法分别计算各组mRNA相对表达量。
1.3.3 Western blot法检测INHBA蛋白在3组中的表达水平 提取组织总蛋白,依次测定各组蛋白含量,将带胶的玻璃板固定于电泳槽,依次加入蛋白Marker、NS组、AK组、SCC组蛋白样品(Marker 5 μL,余蛋白样品10 μL)。行SDS-PAGE凝胶电泳(80 V,30 min后转120 V,60 min)。采用湿转法转膜(转膜条件:240 V,300 mA,90 min)。加入一抗及内参(一抗稀释比例为1 ∶1 000),4 ℃过夜。第二天,复温后孵育二抗(二抗稀释比例1 ∶5 000)1 h,使用凝胶成像仪曝光,用Image J 1.53e软件分析各目的蛋白条带灰度值。计算各组蛋白相对表达量。
1.4 统计学处理
应用SPSS 25.0统计软件包分析数据。NS、AK、cSCC三组间mRNA及蛋白相对表达量的比较采用单因素方差分析,组间两两比较采用Tukey检验。INHBA阳性表达率分布的比较采用2检验,不满足条件时使用双侧Fisher确切概率法。P<0.05为差异有统计学意义。
2 结果
2.1 免疫组化法检测INHBA的表达
免疫组化结果显示,INHBA阳性细胞在AK中定位于不典型增生角质细胞的胞质/核,表现为黄色颗粒沉积;在cSCC中定位于肿瘤细胞的胞质/核,表现为棕黄色颗粒沉积。INHBA阳性表达率在NS、AK及cSCC中分别为23.53%、66.67%及86.67%,差异具有统计学意义(2=27.10,P=0.001)。进一步进行两两组间比较发现,与NS组相比,AK组2=7.82,P=0.038)及cSCC组2=21.91,P<0.001)的表达量增高,差异具有统计学意义,且cSCC组高于AK组(2=10.69,P=0.013,图1,表2)。

图1 免疫组化检测INHBA在3组组织中的表达(400×)Figure 1 Immunohistochemistry of INHBA in NS,AK and cSCC tissues(400×).

表2 INHBA在NS、AK及cSCC组织中的表达情况 (例)Table 2 Expression of INHBA in the Normal,AK and cSCC tissues (Case)
2.2 RT-qPCR检测INHBA mRNA表达
RT-qPCR结果显示,NS、AK及cSCC中的INHBA mRNA相对表达量依次为1.097±0.083、1.328±0.041、1.731±0.064,3组比较差异具有统计学意义(F=48.53,P<0.001);AK组、cSCC组INHBA mRNA相对表达量均较NS组升高(P=0.028,P<0.001);cSCC组表达水平较AK组升高(P=0.002,图2)。

图2 RT-qPCR检测3组中INHBA mRNA相对表达Figure 2 Relative expression levels of INHBA mRNA.
2.3 Western blot检测INHBA蛋白表达
Western blot结果显示,在NS组、AK组及cSCC组中,INHBA蛋白相对表达量依次为0.850±0.011、0.925±0.020、1.050±0.013,3组比较差异具有统计学意义(F=86.62,P<0.001);AK、cSCC组INHBA蛋白相对表达量均高于NS组(P=0.006,P<0.001);cSCC组表达量高于AK组(P<0.001,图3)。
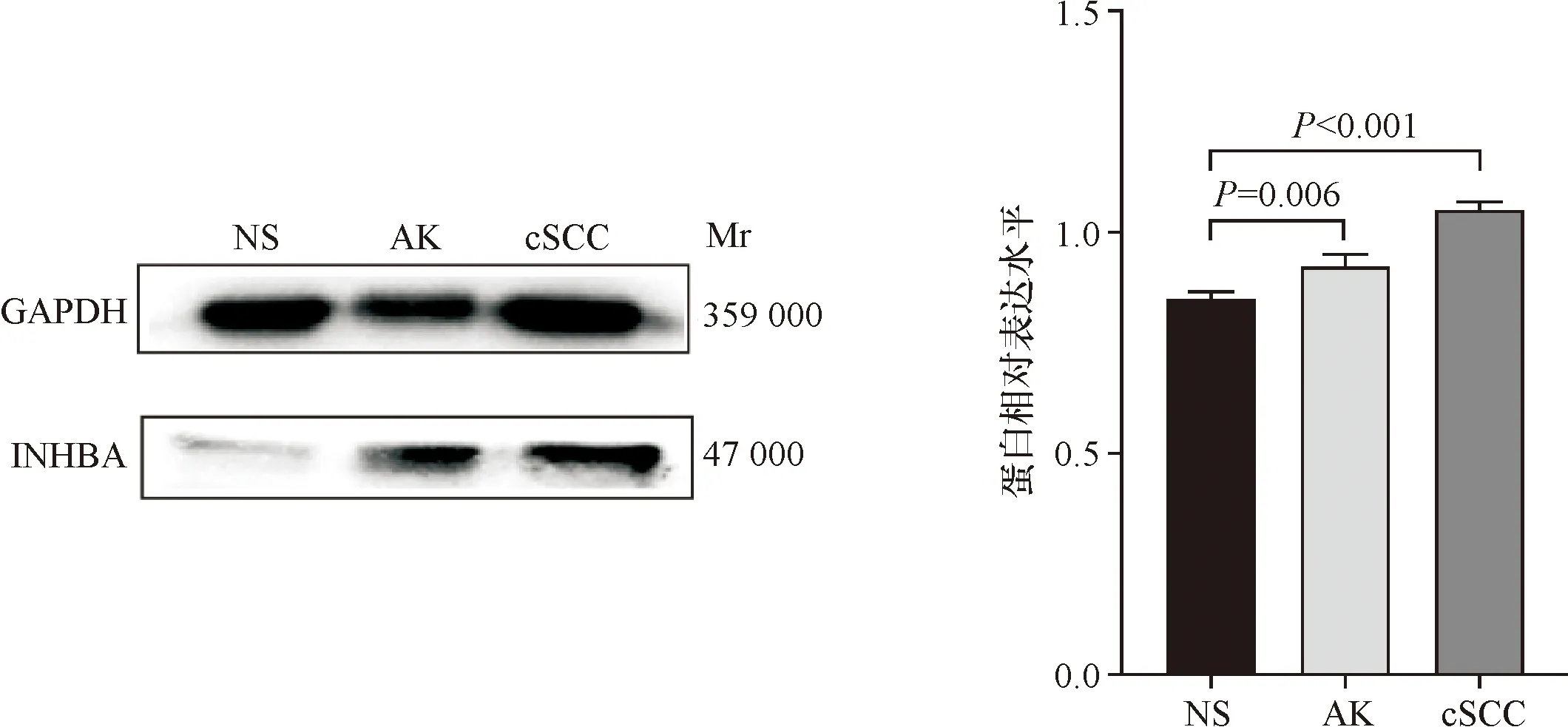
图3 Western blot 检测3组中INHBA蛋白的表达Figure 3 Relative expression levels of INHBA protein.
3 讨论
目前cSCC发病率逐年上升,据Brougham等预测[8],到2030年在欧洲国家该病发病率将会是当前水平的两倍[8]。另一项在亚洲人群中的流行病学调查发现,与印度及马来西亚人相比,中国人罹患皮肤肿瘤的概率及风险更高[9]。炎症、免疫抑制、角质细胞周期失调及氧化应激均为参与其发病的主要环节[10-12],但具体发病机制尚不明确。
抑制素(inhibin, INH)是性腺分泌的一种糖蛋白激素,是由不同亚基组成的二聚体,其中INHBA的主要生理功能为激活和抑制促卵泡激素分泌,故最初发现其在卵巢癌中的致癌作用。后来越来越多的研究证实,INHBA除参与生殖系统肿瘤外,在胃肠道肿瘤(如食管癌、胃癌、结直肠癌)及肺癌、头颈鳞癌等实体肿瘤中亦发挥致癌作用[13-15]。INHBA可通过调控肿瘤细胞增殖迁移、促进上皮-间充质转化、修饰表观遗传、介导免疫逃逸等多种途径参与肿瘤的增殖与侵袭。近年来,成为恶性肿瘤研究的新靶点[16-17],但目前INHBA在AK及cSCC中的相关研究报道尚少。
本研究从组织层面证实了INHBA与AK及cSCC的相关性。免疫组化实验结果表明INHBA阳性细胞在AK中定位于不典型增生角质细胞的胞质/核,表现为黄色颗粒沉积;在cSCC中定位于肿瘤细胞的胞质/核,表现为棕黄色颗粒沉积;INHBA阳性表达率在NS、AK及cSCC组织中依次增高,三组间存在差异性。研究表明INHBA上调与肿瘤淋巴结转移(TNM)分期、组织学分级和人乳头瘤病毒(HPV)状态及总体生存率显著相关,并证实INHBA过表达是判读肿瘤不良预后因素的独立指标,认为INHBA可作为肿瘤病理和分子诊断的生物标志物[18]。本研究还显示,从正常皮肤到癌前期病变到皮肤鳞癌形成的过程中,INHBA的相对表达量依次增加,INHBA在cSCC中呈高表达状态。故此推测INHBA可能与cSCC形成相关,并有望成为肿瘤治疗的靶点及判断预后的指标。
INHBA调控肿瘤发生侵袭主要是通过TGF-β/Smad信号通路完成[19]。例如,在胃癌中,过表达的INHBA可招募并活化Smad4蛋白从而转移TGF-β/Smad信号进入细胞核而发挥作用[20]。靶向沉默INHBA基因可阻断TGF-β的信号传导,进而下调PI3K/Akt通路的活性,导致cyclinD1减少和细胞周期停滞从而抑制大肠癌的增殖[21]。本研究在小样本的组织水平上验证了INHBA与cSCC的相关性,但INHBA如何影响cSCC的发生发展还有待研究。
综上所述,本研究发现INHBA在cSCC中高表达,与cSCC的发生发展有关,但介于肿瘤调控、演变的复杂性,其具体机制仍有待深入研究。本研究为将来cSCC的靶向治疗奠定了实验基础。

