PKG 抑制剂KT-5823 对宫颈癌HeLa 细胞活力、凋亡、自噬的影响
杨澜,周春雷,王艺霖,董贺楠,杨磊,穆红
(1.天津医科大学一中心临床学院,天津 300192;2.天津市第一中心医院检验科,天津 300192)
宫颈癌是女性生殖系统最常见的恶性肿瘤之一,每年全球约有50 万新发病例,26 万死亡病例[1]。宫颈癌新发病例主要集中于发展中国家,我国发病率较高,每年发病率为16.6/100 000[2],且有向年轻化发展的趋势[3]。目前宫颈癌的治疗策略包括手术切除、常规化疗、放疗,但疗效有限,多数患者仍会出现复发和转移,随后死亡[4],亟需寻找新的治疗方案。
环鸟苷酸依赖性蛋白激酶(cGMP-dependent protein kinase,PKG)是在哺乳动物中普遍存在的一种丝氨酸/苏氨酸蛋白激酶,可被cGMP 激活,进而影响细胞的生物学功能[5]。有研究证实,PKG 的活化在减少肿瘤细胞自发凋亡[6]、增强肿瘤细胞干性和转移[7]、增加肿瘤恶性程度[8]等方面发挥重要作用。同时PKG 可作为多种肿瘤潜在的治疗靶点,如卵巢癌[9]、胰腺癌[10]、前列腺癌[11]等,但抑制PKG 对宫颈癌的作用还未有报道。KT-5823 是PKG 的特异性抑制剂,本研究拟探讨KT-5823 对宫颈癌HeLa 细胞活力、凋亡和自噬的影响,并研究其可能的作用机制。
1 材料与方法
1.1 材料 人宫颈癌细胞株HeLa 购自于中国科学院典型培养物保藏委员会细胞库。PKG 抑制剂KT-5823,纯度≥85%,购自Sigma,货号:K1388。
1.2 仪器与试剂
1.2.1 仪器 EnSpire Mutilabel Reader 酶标仪(美国PerkinElmer 公 司);Alpha Innotech FluroChem FC2 凝胶成像分析系统(美国Alpha Innotech 公司);LightCycle96 荧光定量PCR 仪(瑞士Roche 公司);BD Accuri C6 P1us 流式细胞仪(美国BD Sciences公司);倒置显微镜(日本Olympus IX71 公司);离心机(德国Eppendorf 公司);正置荧光显微镜(日本Nikon 公司);CO2细胞培养箱(美国Thermo 公司);电泳仪(美国Bio-Rad 公司)。
1.2.2 试剂 MEM-Alpha 培养基(以色列Biological Industries 公司);胎牛血清(北京钮因泰克生物技术有限公司);PBS、青霉素/链霉素复合液(北京索莱宝生物技术有限公司);胰蛋白酶-EDTA 消化液(0.25%)酚红(美国Invitrogen 公司);GFP-LC3B质粒(湖南科爱医疗器械有限公司);SBI-0206965(美国默克公司);细胞凋亡检测试剂盒(天津三箭生物技术股份有限公司);膜再生液(北京索莱宝生物技术有限公司);LipofectamineTM3000 (美国Thermo Fisher 公司);RNA 逆转录试剂盒、SYBR Green、荧光定量PCR 试剂盒(日本Takara 生物技术有限公司);细胞增殖及细胞毒性检测试剂盒、曝光液(Boster 生物工程有限公司);甘氨酸、Tris、SDS 粉末、氯化钠、脱脂牛奶、抗体稀释液(北京索莱宝生物技术有限公司)、兔抗人PKG1、哺乳动物雷帕霉素靶蛋白(mTOR)、磷酸化哺乳动物雷帕霉素靶蛋白(p-mTOR)、蛋白激酶B(Akt)、磷酸化蛋白激酶B(p-Akt)、微管相关蛋白1 轻链3(LC3)Ⅱ/Ⅰ抗体(美国CST 公司);Beclin1、B 细胞淋巴瘤2 家族蛋白(Bcl-2)、Bcl-2 相关X 蛋白(Bax)、天冬氨酸特异性半胱氨酸蛋白酶3(Caspase 3)、GAPDH、HRP 标记羊抗兔抗体(美国Proteintech 公司)。
1.3 方法 1.3.1 细胞培养 HeLa 细胞使用MEM-Alpha 培养基(含有10%胎牛血清、1%青链霉素双抗)培养,置于37℃、5%CO2的培养箱中培养,当细胞密度达到80%~90%进行传代种板。
1.3.2 试剂溶解与实验分组 KT-5823 用DMSO溶解成储存液,将储存液分装到若干EP 管中,-20℃保存,避免反复冻融。将HeLa 细胞分为DMSO 组(对照组)、KT-5823 组(实验组),干预24 h 后收集细胞用于后续实验。
1.3.3 CCK-8 检测细胞存活率 取对数生长期的HeLa 细胞制备单细胞悬液,以每孔3 000 个细胞接种于96 孔培养板中,每组设3 个复孔,过夜培养。更换新培养基,将不同浓度的KT-5823 分别加入对应孔中,刺激24 h。每孔加入10 μL CCK8 溶液,孵育2 h。酶标仪检测450 nm 波长处吸光度值。根据下列公式计算细胞存活率:
细胞存活率=[(实验孔-空白孔)/(对照孔-空白孔)]×100%
1.3.4 流式细胞术检测细胞凋亡 将HeLa 细胞(每孔1×105个)接种到24 孔板,每组设3 个复孔,贴壁后待细胞密度达到70%~80% 加入药物处理24 h,收集细胞,采用Annexin V-FITC/PI 双染法检测细胞凋亡率。
1.3.5 GFP-LC3B 荧光斑点实验 将HeLa 细胞(每孔0.8×105个)接种到24 孔板。待细胞密度达到60%~70%,使用LipofectamineTM3000 转染GFP-LC3B质粒6 h 后,更换新鲜完全培养基培养24 h 后再加入药物刺激24 h,用4%多聚甲醛固定细胞20 min,PBS清洗3次。荧光显微镜观察GFP-LC3斑点的形成。
1.3.6 实时荧光定量PCR(RT-qPCR) 收集干预之后的细胞,使用Trizol 提取细胞总RNA,测定RNA 浓度,按照试剂盒说明书将RNA 逆转录为cDNA。用TB Green 进行RT-qPCR 检测PKG1、LC3Ⅱ、Beclin1、β-actin mRNA 的表达水平,2-ΔΔCt计算mRNA 的相对表达。荧光定量热循环条件为:预变性:95℃,2 min;3 步扩增:95℃,10 s;58℃,10 s;72℃,10 s,循环45 次。引物序列如表1 所示。

表1 引物序列Tab 1 Primer sequences
1.3.7 蛋白免疫印迹试验检测各蛋白表达水平收集KT-5823 干预之后的HeLa 细胞,加入含磷酸酶抑制剂的裂解液裂解细胞提取蛋白,用BCA 法进行蛋白定量。蛋白样品(30 μg/孔)加入不同浓度SDS- PAGE 凝胶中进行电泳,分开蛋白条带。转膜后脱脂牛奶封闭2 h(5%),孵育兔抗人PKG1、LC3Ⅱ/Ⅰ、Beclin1、Akt、p-Akt、mTOR、p-mTOR、Bcl-2、Bax、Caspase-3、GAPHD(1∶1 000)抗体过夜(4℃),洗涤后孵育二抗(1∶1 000)1 h,加入ECL 显影液后在蛋白凝胶成像仪中显影观察,Image J 分析蛋白条带灰度值,实验独立重复3 次。
1.3.8 利用自噬抑制剂SBI 观察诱导的自噬的作用 将HeLa 细胞(以1×105/孔的密度)接种到24 孔板,细胞分为3 组:DMSO 组(对照组)、KT-5823 组(实验组)、实验组+自噬抑制剂组,每组设3 个复孔。预实验自噬抑制剂选取的剂量分别为10、30、50、70 μmol/L SBI 和100 μmol/L,过夜培养。待细胞密度达到70%~80%,分别在对应孔加入自噬抑制剂SBI-0206965 刺激2 h,然后加入3 μmol/L 的KT-5823 刺激24 h,收集细胞,用流式细胞术检测细胞凋亡。
1.4 统计学处理 应用GarphPad Prism9.0、SPSS 16.0 软件进行统计分析,符合正态分布的计量资料以x±s 表示,两组间比较采用独立样本t 检验,多组间比较采用单因素方差分析,P<0.05 表示差异有统计学意义。
2 结果
2.1 KT-5823 对HeLa 细胞增殖能力的影响 CCK8结果显示,与对照组相比(图1A),3~100 μmol/L不同浓度的KT-5823 均可明显抑制HeLa 细胞的增殖(3 μmol/L:t=10.23,P=0.000 5;5 μmol/L:t=10.65,P=0.000 4;10 μmol/L:t=14.28,P=0.000 1;30 μmol/L:t=13.22,P=0.000 2;50 μmol/L:t=14.83,P=0.000 1;70 μmol/L:t=12.10,P=0.000 3;100 μmol/L:t=13.56,P=0.000 2),且3 μmol /L KT-5823 接近半数抑制浓度。显微镜图片显示(图1B),KT-5823 刺激HeLa细胞24 h 后,细胞形态从规则梭形变成圆形并出现细胞碎片,这种形态变化随浓度的增加而逐渐加剧。免疫印迹实验结果显示,与对照组相比(图1C),随KT-5823 的浓度增加,PKG1 蛋白表达水平逐渐降低(1 μmol/L:t=10.01,P=0.000 6;3 μmol/L:t=13.83,P=0.000 2;5 μmol/L:t=11.86,P=0.000 3;10 μmol/L:t=14.17,P=0.000 1)。综合考虑,最终选取了浓度梯度中的有效剂量3 μmol/L 用于后续研究。
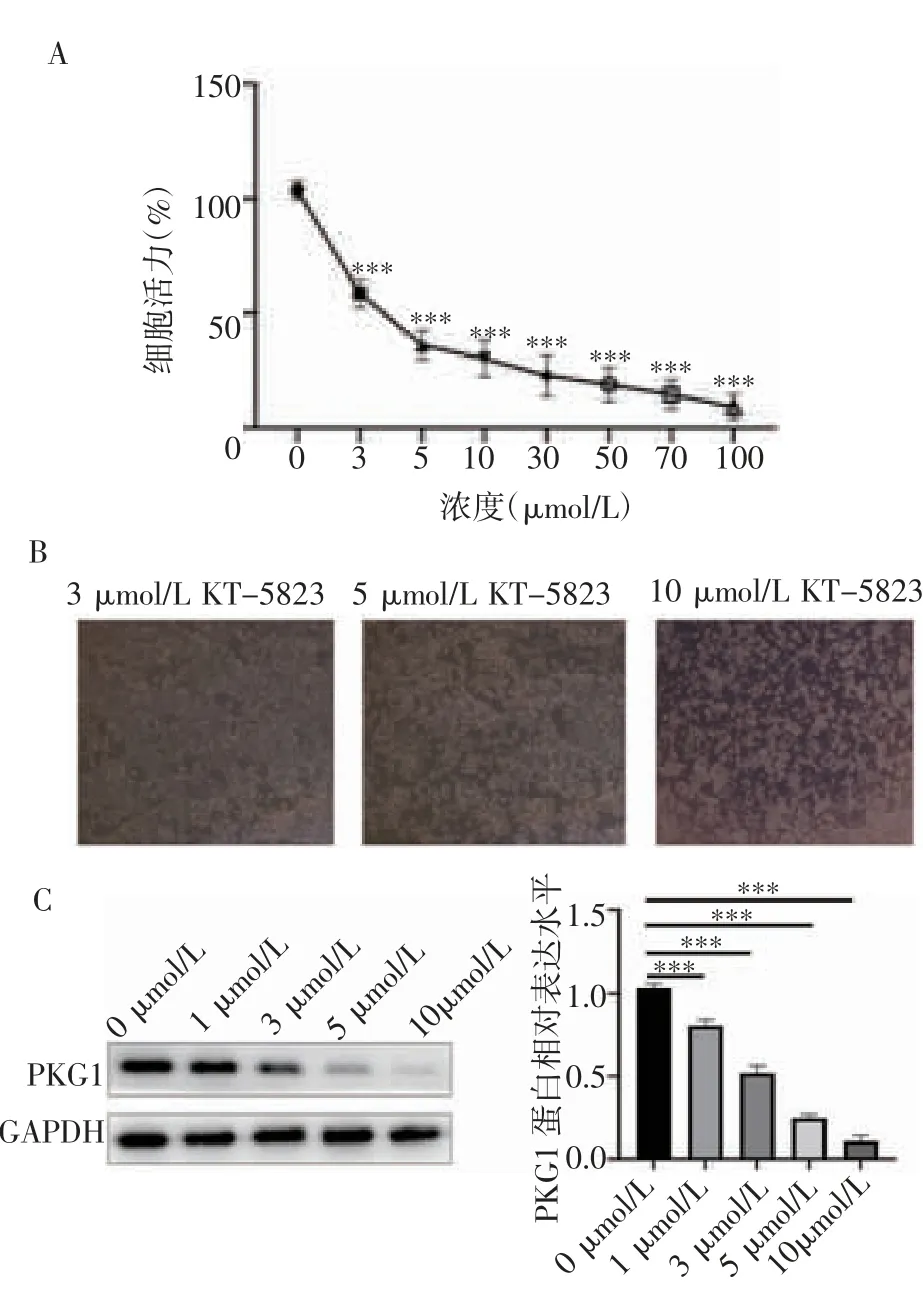
图1 KT-5823 可有效抑制HeLa 细胞的增殖能力Fig 1 KT-5823 can effectively inhibit the proliferation of HeLa cells
2.2 KT-5823 对PKG1 的抑制作用 RT-qPCR 结果显示,与对照组相比(图2A),实验组PKG1 mRNA 表达水平显著降低(t=13.56,P=0.000 2);免疫印迹实验与RT-qPCR 结果一致,与对照组相比(图2B),实验组PKG1 蛋白表达水平显著降低(t=5.461,P=0.005 5),KT-5823 可明显抑制PKG1 的表达。
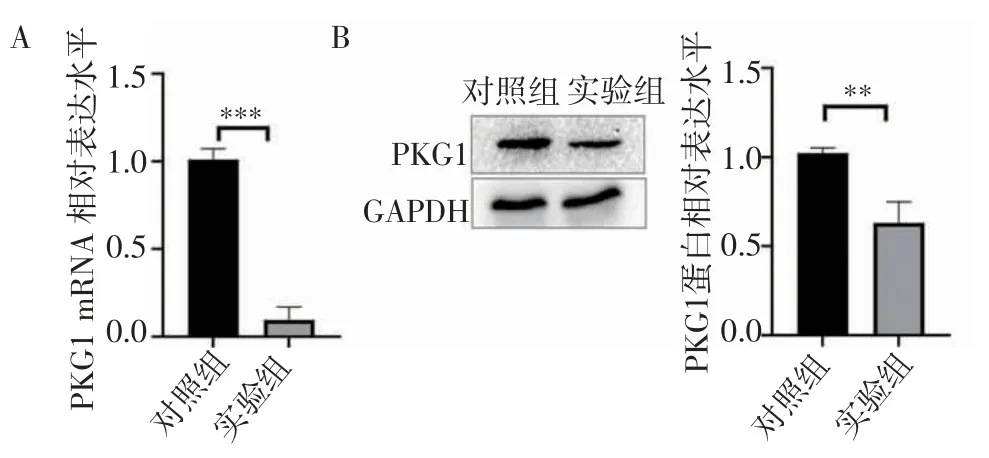
图2 KT-5823 对PKG1 表达的影响Fig 2 Effect of KT-5823 on the expression of PKG1
2.3 KT-5823 对HeLa 细胞凋亡的影响 流式细胞术结果显示,与对照组相比(图3A),KT-5823 可促进HeLa 细胞凋亡(t=10.78,P=0.004)。免疫印迹试验结果显示,与对照组相比(图3B),KT-5823 可上调HeLa 细胞凋亡相关蛋白Caspase 3 的表达(t=9.341,P=0.000 7),降低Bcl2/Bax 的比值(t=13.79,P=0.000 2)。
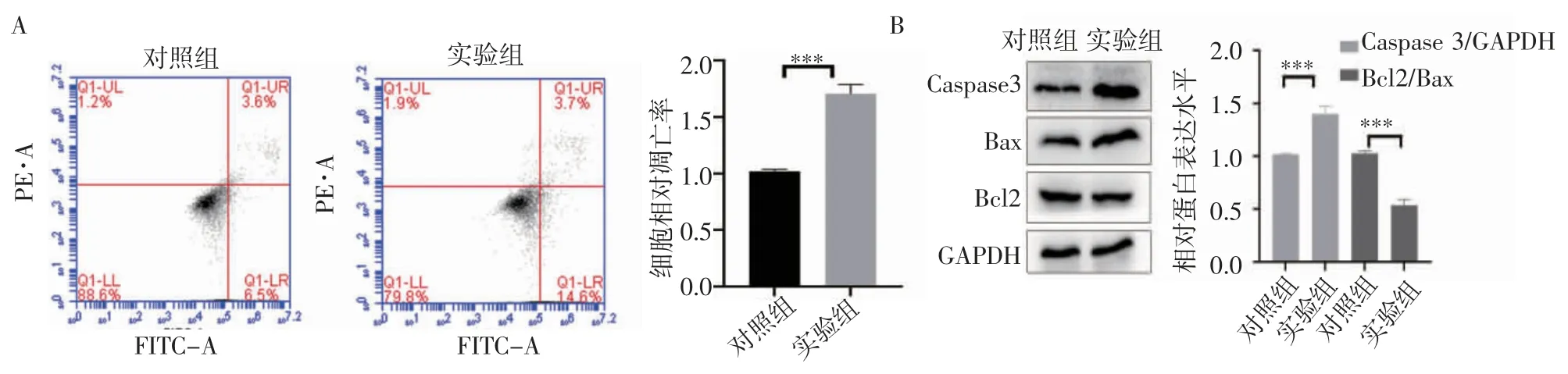
图3 KT-5823 对HeLa 细胞凋亡的影响Fig 3 Effects of KT-5823 on apoptosis in HeLa cells
2.4 KT-5823 对HeLa 细胞自噬的影响 转染GFP-LC3 质粒后,与对照组相比(图4A),KT-5823可促进GFP-LC3B 斑点的形成(t=10.12,P=0.000 5),表明KT-5823 可促进Hela 细胞自噬体的形成。免疫印迹实验结果显示,与对照组相比(图4B),KT-5823 可上调LC3Ⅱ/Ⅰ、Beclin1 蛋白的表达(t=6.924,P=0.002 3;t=11.84,P=0.000 3),降低自噬相关通路蛋白p-Akt/Akt、p-mTOR/mTOR 的比值(t=5.194,P=0.006 5;t=12.78,P=0.000 2)。与蛋白结果一致,RT-qPCR 结果显示,与对照组相比(图4C),KT-5823可上调HeLa 细胞自噬相关基因LC3Ⅱ、Beclin1 mRNA 的表达(t=8.359,P=0.001 1;t=5.782,P=0.004 4)。
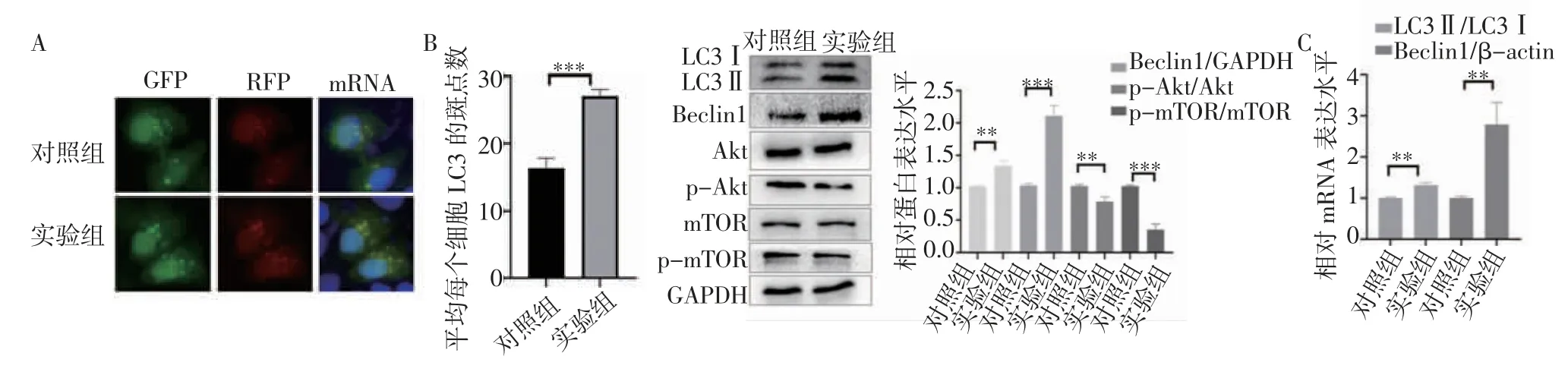
图4 KT-5823 对HeLa 细胞自噬的影响Fig 4 Effects of KT-5823 on autophagy in HeLa cells
2.5 自噬抑制剂SBI对KT-5823诱导细胞凋亡的影响 流式细胞术实验结果显示(图5),与实验组相比,当自噬抑制剂剂量超过10 μmol/L 后,随自噬抑制剂剂量的增加,细胞凋亡也逐步增加(实验组+30 μmol/L SBI:t=7.616,P=0.001 6;实验组+50 μmol/L SBI:t=15.43,P=0.000 1;实验组+70 μmol/L SBI:t=11.01,P=0.000 4;实验组+100 μmol/L SBI:t=15.39,P=0.000 1)。
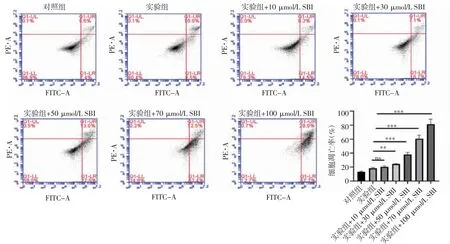
图5 流式细胞术检测KT-5823 联合SBI-0206965 对细胞凋亡的影响Fig 5 Effects of KT-5823 combined with SBI-0206965 on apoptosis detected by flow cytometry assay
3 讨论
KT-5823 是一种可穿透细胞膜的PKG 特异性抑制剂,可用于细胞研究。因PKG 存在组织器官差异,研究多集中于心脏[12]、血管[13]、成纤维细胞[14]等方面。近年来,PKG 与肿瘤的研究逐渐丰富,研究表明PKG 对肿瘤有促进作用[6-8],因此笔者对抑制PKG是否可用于宫颈癌治疗进行了探索。本研究首先应用CCK-8 检测了不同浓度的KT-5823 对HeLa 细胞增殖能力的影响,结果发现,KT-5823 在3 μmol/L以上浓度均可显著抑制HeLa 细胞的增殖能力,且随KT-5823 刺激浓度的增加,细胞活力逐渐降低。与CCK-8 实验结果相吻合,分别用3、5、10 μmol/L KT-5823 刺激细胞后,细胞形态出现明显加剧的毒性变化,表现为变圆变亮的细胞比例逐渐增加。这与不同剂量KT-5823 对PKG1 活性的抑制程度有关。以上实验结果证明了KT-5823 具有抑制HeLa细胞生长的作用。
细胞凋亡是一种多基因参与调控的细胞程序性死亡形式[15]。Caspase 3 在细胞凋亡过程中位于级联反应下游,执行凋亡过程。Bax 和Bcl-2 同属于Bcl-2 家族蛋白,Bcl-2 是一种抑制凋亡的基因,主要通过阻止线粒体释放凋亡因子来发挥抗凋亡作用,而Bax 是一种促凋亡基因。正常情况下,Bax 和Bcl-2 以适当的比例存在,但受到外界凋亡信号刺激后,二者的含量或比例会发生变化。当Bcl-2 表达增多时,会促使Bax/Bax 复合体解离,进而与Bcl-2结合形成更加牢固的Bcl-2/Bax 异源二聚体,抑制凋亡的发生;当Bax 表达增多时,Bax/Bax 同二聚体会明显增多,进而激活Caspase 家族蛋白[16]。前期的流式细胞术实验结果显示,KT-5823 能够促进宫颈癌细胞凋亡。为进一步研究KT-5823 对宫颈癌细胞凋亡的影响,并对凋亡相关蛋白Caspase 3、Bcl-2、Bax 蛋白进行了检测,结果显示,KT-5823 可提高促凋亡相关基因Caspase 3、Bax 的表达,下调抗凋亡基因Bcl-2 的表达,降低Bcl-2/Bax 比值。以上实验结果表明KT-5823 可通过调节Caspase 3、Bcl-2 和Bax 蛋白的表达进而诱导HeLa 细胞发生凋亡,这与前人关于抑制cGMP/PKG 通路可抑制宫颈癌细胞生长的实验结果相吻合[17]。
自噬是一种降解和消除错误折叠蛋白质和受损细胞器的分解代谢过程[18]。自噬在肿瘤细胞中具有双重作用,一方面肿瘤细胞可利用自噬对受损细胞器和陈旧蛋白质进行机械化降解,维持细胞稳态,且在面对应激反应时肿瘤细胞可通过激活自噬免除细胞死亡[19];另一方面当自噬超过阈值时,可能会引发自噬性细胞死亡或激活其他细胞死亡方式,最终导致细胞死亡[20]。笔者首先通过转染GFP-LC3质粒探究了抑制PKG1 对宫颈癌细胞自噬的影响,发现与对照组相比,KT-5823 能够增加宫颈癌细胞自噬泡的形成。然后通过RT-qPCR 和免疫印迹试验检测自噬基因LC3Ⅱ、Beclin1 的表达水平发现,与对照组相比,实验组LC3Ⅱ/Ⅰ、Beclin1 表达水平增加。PI3K/Akt/mTOR 信号通路是经典的自噬通路,mTOR 是调节自噬的明星因子[21]。此信号通路也是细胞内关键的信号转导通路,可促进细胞生长并抑制细胞凋亡[22]。基于此,笔者研究了KT-5823 刺激后Akt-mTOR 信号通路的变化,发现p-Akt/Akt、pmTOR/mTOR 比值降低。以上研究结果表明宫颈癌细胞在KT-5823 刺激后,可通过抑制Akt-mTOR 信号通路诱导细胞自噬水平增加。为了探究自噬在宫颈癌细胞PKG1 抑制中的作用,笔者应用了自噬特异性抑制剂SBI-0206965,发现自噬抑制剂与PKG1抑制剂KT-5823 共处理宫颈癌细胞后,与单独使用KT-5823 处理组相比,细胞凋亡率增加,且随自噬抑制剂剂量的增加细胞凋亡程度加剧。结果表明,KT-5823 干预后细胞上调的自噬水平并未达到自噬过度激活的阈值,而是发挥降低KT-5823 刺激造成不利影响的保护作用。这也表明KT-5823 通过联合靶向抑制自噬可提高抗宫颈癌治疗的效果。
综上所述,本文证实PKG 特异性抑制剂KT-5823可抑制宫颈癌细胞的增殖能力,通过调控Caspase 3/Bax/Bcl2 促进细胞凋亡的发生。同时,KT-5823 抑制PKG 后,宫颈癌细胞可通过调控Akt/mTOR 信号通路发生保护性细胞自噬,而抑制这种自噬可进一步加剧宫颈癌细胞死亡。在未来笔者准备进一步研究PKG 基因敲除对宫颈癌细胞的作用,同时可加入动物实验进一步支持验证。总之,本研究为靶向PKG治疗宫颈癌提供了实验和理论依据,为临床治疗提供了新的靶点。

