镁电池的研究进展
耿健媛 郭军华 张廷安
(东北大学 冶金学院, 辽宁 沈阳 110819)
0 前言
镁是一种对环境友好的金属,用镁作电池的电极,可以有效降低电池对环境的污染,因此是一种非常具有前景的电池负极材料[1]。目前,已经报道过的镁电池主要有镁锰干电池、镁二次电池、镁海水电池、镁空气电池等。本文在综述镁锰干电池、镁二次电池、镁海水电池、镁空气电池的工作原理、特点以及应用现状的基础上,讨论了镁电池的发展方向。
1 镁电池与锂电池、锌锰电池的比较
Mg与Li在元素周期表中相近,两者化学性质非常相似。与锂电池相比,镁电池有相对较高的容量和较低的成本等优点;此外,锂的熔点约为180 ℃,而镁的熔点高达651 ℃,因此镁电池相对更为安全。镁也是世界上储藏数量最多的轻金属元素,密度显著低于铝、钛和铁的密度,且镁是地壳中八大最为充裕的元素之一,因此有充足的矿产资源保障下游行业的广泛应用[2]。
众所周知,锌锰干电池在世界上的应用最为广泛,但具有很多缺点,如锌锰干电池的自身容量比较小,放电时间相对较短,而且废弃的锌锰干电池会造成严重的环境污染[3];锌锰干电池的开路电压为1.55~1.70 V,不能提供稳定的电压;镁的化学性质非常活泼,其电负性为1.31,标准电极电位为-2.36 V,低于锌锰干电池的电极电位(-1.18 V)[4];镁电池容量大,相对放电时间长;在性价比方面,镁的价格较锌低许多;镁电池污染小,不含对环境具有潜在危险性的有害元素Pd和Cd。此外,镁具有良好的铸造性能,允许经过高生产率方法(如高压压铸)制造复杂样式;对于复杂几何形状的制品,镁材质的压铸速度与铝相比快50%[5]。值得注意的是,几何形状也会提高镁零件的安全性与性价比。
目前,锂电池已被广泛应用于各类便携式数码产品以及电动交通工具中,然而锂电池容量小,续航距离不够远,在针对智能电网大规模应用方面,需要进一步寻找安全和低成本的电池;锌锰干电池比能量小,放电功率低且不能提供稳定的电压,只能应用于剃须刀、游戏机、遥测器、报警器、计算器、手电筒等小型仪器设备中。而镁电池具有高丰度、高理论容量(图1)、高性价比、高度可逆的无枝晶沉积等特点,可用于备用电源、海洋水下仪器电源以及电动汽车动力系统[6]。随着社会的发展与时代的进步,国内资源短缺与经济发展矛盾日益突出,使得镁电池作为一种新能源而备受关注,镁电池在推动电动汽车应用以及储能技术发展方面将起到决定性作用。
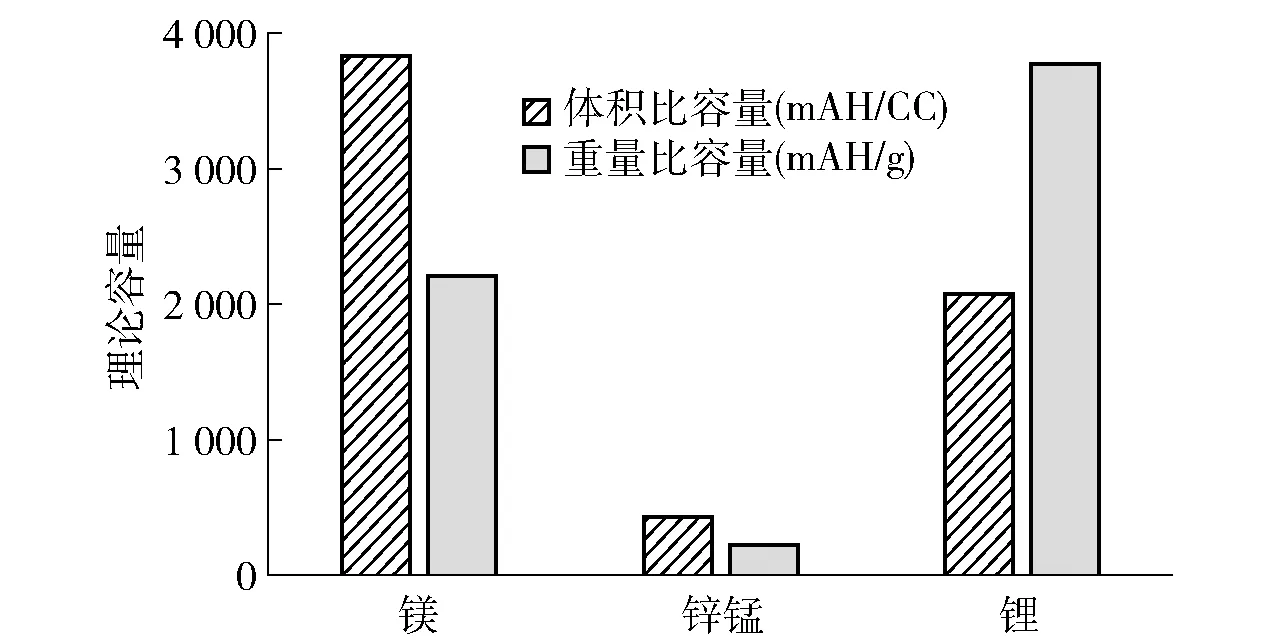
图1 镁、锌锰和锂金属阳极的理论容量
2 镁电池的研究现状
2.1 镁锰干电池
镁锰干电池的研究最初是在高电压镁合金基础上设计组装的[7]。镁锰干电池的正极材料是MnO2,负极材料为Mg或镁合金,电解液为Mg(ClO4)2,其结构示意图如图2所示。镁锰干电池的电化学反应式为:

(1)
负极的电极反应为:

(2)
正极的电极反应为:

(3)

图2 镁锰干电池示意图
镁锰干电池曾广泛应用于军事无线电收发报机,1975年占美国军用电池订货量的22.5%,但镁锰干电池未能进入民用市场。镁易被大气中的氧气氧化,形成氧化镁薄膜覆盖电极,导致电极的化学反应不完整,电压滞后。镁合金负极材料的表面形成MgO和Mg(OH)2等保护膜,使得镁干电池初始性能十分强;但当负极反应时,会释放出热量以及H2,促使保护膜脱落,导致负极持续腐蚀[8-9]。正因为如此,镁电池的储存能力会在不断的充电放电过程中逐渐减弱[10],故镁锰干电池不推荐在电池间断放电的环境下应用。目前镁锰干电池应用范围很小,已不再商品化。
2.2 镁二次电池
镁二次电池是在镁锰干电池的基础上,借鉴锂离子电池构造原理提出的新电池。与镁锰干电池类似,镁二次电池也是由镁负极、电解液和正极材料(过渡金属硫化物、过渡金属氧化物)组成,发生的电化学反应类似锂电池。镁二次电池的负极是Mg,要求Mg/Mg2+可以可逆地进行电化学沉积/溶解[11]。因为Mg比较活泼,所以反应只能在有机非质子极性溶剂中进行,以确保镁二次电池能够顺利且正常地使用。
镁二次电池的组装方式如下:Mg/0.25 mol/L+Mg[B(Bu2RPh2)]2THF/DMF/Co3O4。研究人员发现Mg2+可以在Co3O4中移动[12],实现可逆电化学聚集,形成充电和放电。然而,镁二次电池的开路电位以及极化强度会根据正极材料的选择而发生改变,这表明选择合适的正极材料是镁二次电池的关键一步,由此衍生另一种镁二次电池组装形式:以Mg为负极,以Mo3S4为正极,采用浓度0.20 mol/L的Mg(AlCl2BuEt)2的THF溶液为电解液。由于THF溶液中含有Mg有机硼酸盐,在不存在具有高度还原作用的格式试剂条件下,可促进镁的沉积或溶解。目前研究的结果是,有机配体的配合物越丰富,沉积的交换电流密度越大,电沉积过电位越小,循环效率越好。除此之外,在0.2~1 mA/cm2的放电电流密度下,该电池经2 000次重复放电后电池容量损失小于15%。
镁二次电池在性能方面与其他电池的对比见表1。

表1 镁二次电池与其他电池性能对比
镁二次电池凭借高体积能量密度、高安全性、高丰度[13]以及低成本等诸多优势,成为极具发展潜力的电池体系之一。目前以中国科学院为领头研发的镁硫电池系统[14],顺利通过高压环境测试且已实现示范应用。但镁二次电池的发展依然受两个方面的影响:一方面,镁容易生成一层阻碍反应的保护膜,由于这层膜阻挡了镁离子的通过,因此镁就难以溶解成镁离子;另一方面,镁离子的电荷密度大,很难在电解液基质中游离。
目前对于镁二次电池正极材料的研究还不够充分,未来需要寻找一种可逆性好的嵌入/脱出正极材料,同时需要在提高镁二次电池的安全性、降低成本以及减少污染等方面作出进一步研究。此外,镁二次电池有望在多种应用场景中取代部分锂电池和铅酸电池。
2.3 镁海水电池
利用水(尤其是海水)电催化制备氢气是缓解能源和环境污染危机的一条十分有效的途径。镁海水电池以海水作为电解液,以镁合金为负极材料,以AgCl、PbCl2、CuCl等为正极,同时将水中的溶解氧用作极化剂[15]。镁海水电池是将镁合金的化学能转化为电能的电化学装置,具有高密度、高安全性以及环保等优点,在海洋装备领域(如深海着陆器、深海原位实验站、海洋环境检测、海洋资源开发利用等方面)具有很好的应用前景。
当镁海水电池处在储备状态时,会发生HER(析氢反应),使反应中间体以及溶剂之间产生隔离,而当中间体与溶剂之间因隔离而处于惰性状态时,需另外添加反应材料。因此镁海水电池需要采用特殊的储存方法,一般都采用干式储存,以防止电极的腐蚀。值得注意的是,在干式储存中,由于镁合金阳极十分活泼,表面易产生氧化膜,因此需经过特殊处理后密封储存[16],以防止大气条件下的腐蚀,影响电池的使用。镁海水电池的结构和工作原理如图3所示。

图3 镁海水电池的结构和工作原理
在镁海水电池反应过程中,电极腐蚀会析出氢气,引发一种泵式效应,将不易溶解的Mg(OH)2排放到电池的外部,使得腐蚀产物留在电池内部[13],大大阻碍离子在电解质中的移动,从而导致电池的放电效果变差。反应过程产生的热量可以提高镁海水电池的能量转换,使电池能够在低温状态下工作。随着溶解氧的消耗,电池电压降低,电池的寿命以及使用情况受到严重的影响。
镁海水电池可以存储动力,作为水下推进器的电源,但目前为止,关于镁海水电池作为水下动力的研究并不多,未来这是镁海水电池研究的一个重要方向。
2.4 镁空气电池
镁空气电池一般以镁或镁合金作为负极[17],以空气为正极,常见的MnO2体系镁空气电极借助MnO2来收集氧气作为电池的正极材料。镁在中性电解液或弱碱性电解液中有电活性,故可以采用中性盐或弱碱性盐作为电解液[18],提高镁空气电池的化学活性,制造出高性能的镁空气电池。通常采用浓度3.5%的NaCl水溶液作为电解液[19]。一般来说,镁空气电池发生的反应如下:
负极的电极反应为:

(4)
正极的电极反应为:

(5)
总反应:

(6)
镁空气电池的充电放电示意图如图4所示。在放电过程中,镁在负极发生氧化反应,变成Mg2+并释放电子;在正极,氧气与电解液和电子发生还原反应,生成了OH-。电池充电过程中,镁沉积在镁电极中,而氧气释放到空气电极中。镁空气电池电压一般为3.1 V,理论比能量密度为6.8 kW·h/kg[20-21]。由此可以看出,与锂离子电池等常见电池系统相比,镁空气电池具有较高的理论比能量密度。

图4 镁空气电池的充电与放电反应过程
由于镁是一种较为活泼的金属,接触酸性液体时,会生成氢气,导致电极腐蚀严重;此外,镁在碱性介质中会生成镁合金,镁空气电池表面易产生钝化膜[22-23],虽然防止了电极的腐蚀,但影响放电反应的进行,使镁空气电池的使用受到影响。镁元素的化学性质较为活泼,在电解液中不仅会发生氧化还原反应,还会发生自腐蚀反应,造成了电池无法正常使用[24-25]。但镁空气电池的正极为空气中的氧气,只要电解液和负极没有被消耗完全,该电池装备就可以向外界提供源源不断的动力,故镁空气电池在电力运输行业以及能源储备方面具有强大的应用潜力。目前,镁空气电池的研究热点主要集中体现在电极合金化、加工工艺及热处理等方面,目的是使镁合金的钝化以及镁沉积得到改善,提高镁空气电池的放电能力。
3 结束语
镁电池满足人们开发高性能、低成本、安全环保的大型充电电池的需求。随着新能源汽车的大力推广和使用、高铁的建设、航天事业的加速突破以及5G网络的快速发展,未来几年镁电池的研发和应用将迎来更大的机遇和市场前景。未来尖端超高性能镁电池的研发和高性能、低成本镁电池复杂件精密的加工将是重要的发展方向,从而助推装备轻量化发展。

