细胞学P16、HR-HPV、液基细胞学预测高级别宫颈癌前病变的分层研究
赵芳,马德勇,王婷婷,张岩,董颖,赵健*
宫颈癌是全球女性第四高发的恶性肿瘤,尽管宫颈癌病因明确,宫颈癌疫苗逐渐普及,但疫苗效益滞后,现阶段高质量的宫颈癌筛查仍然是降低我国宫颈癌病死率的最有效手段之一[1]。常用的宫颈细胞学检查(LBP)和高危HPV检测都有各自的弊端,且疫苗时代一定程度上带来了HPV疫苗覆盖的基因分型感染率的下降,宫颈癌筛查策略也需作出相应调整。因此急需反映宫颈癌真实进展情况的生物标志物,以优化筛查策略,提高识别高级别癌前病变的效能。
P161INK4a(P16)是一种细胞周期蛋白依赖性激酶抑制剂,其过度表达可以作为HPV感染整合到宿主染色体的标记,并反映HPV感染所致的细胞异常增殖状态[2]。目前有两种P16检测方法,一种是组织病理学P16,其作为辅助诊断方法广泛应用于更精准地判断高级别病变[3]。但组织学P16标本获取需在有创的阴道镜活检下取宫颈活组织标本进行,我国阴道镜从业人员不足和技术不平衡在一定程度上限制了P16在高级别宫颈病变识别的优势。另一种是细胞学P16,使用宫颈癌筛查的LBP检测后剩余的标本进行,无创,近几年逐渐受到宫颈病变医生的认可。美国阴道镜和子宫颈病理协会提出基于风险分层的阴道镜检查[4],并对有潜在高级别病变风险的女性进行管理。本研究对大样本的宫颈癌筛查细胞学、高危HPV以及细胞学P16结果进行风险分层分析,评估其对高级别病变的预测意义,以期为我国疫苗后时代宫颈癌筛查提供依据。
1 材料与方法
1.1 研究对象
募集2018年1月至2019年7月在北京大学第一医院宫颈病变门诊年龄21~69岁有性生活的非妊娠期、非哺乳期女性900例,采用液基细胞学联合HR-HPV检测进行宫颈癌初筛,并在液基细胞残余标本中进行细胞学P16检测。所有参加初筛的受试者宫颈完整,无宫颈病变手术史,无宫颈癌放化疗史。所有入组对象签署知情同意书,本研究遵守《赫尔辛基宣言》并经医院伦理委员会批准。
1.2 试剂来源
LBP检测试剂来自美国The SurePath liquid‐based cytology system(BD Diagnostics),Tripath,Burlington,NC。P16免疫细胞化学染色的细胞保存液和试剂盒来自广州江元医疗科技有限公司全自动免疫细胞染色机(JY-6000)配套试剂。HR-HPV试剂为中国潮州凯普生物技术有限公司HHM-2型医用核酸分子快速杂交仪配套的HPV分型检测试剂盒。
1.3 宫颈脱落细胞标本收集及检测
由专门医师进行病例采集后暴露宫颈,按照规范操作分别采集2份宫颈脱落细胞标本,一份进行LBP和P16检测,另一份进行HR-HPV检测。
1.3.1 LBP检测结果判读 按照宫颈细胞学Bethesda分类系统(TBS)标准[5],鳞状细胞分为未见上皮病变或恶性病变(NILM)、未明确诊断意义的不典型鳞状上皮(ASCUS)、不除外高度病变的不典型鳞状上皮(ASC-H)、低级别鳞状上皮内病变(LSIL)、高级别鳞状上皮内病变(HSIL)。ASCUS及其以上称为细胞学异常。
1.3.2 P16检测 将LBP剩余的标本按试验要求制成薄层细胞片并染色,由同一名经验丰富的细胞学诊断医师盲法判读结果。显微镜下,在1个及以上细胞核或细胞浆呈棕色或棕黄色为P16阳性,未见染色判读为阴性。
1.3.3 HR-HPV检测 用HybriMax技术检测15种常见的高危型(16、18、31、33、35、39、45、51、52、53、56、58、59、66、68)和6种低危型(6、11、42、43、44、cp8304)等共21种HPV亚型。15种高危型均为阴性判读为HR-HPV阴性,反之则为HR-HPV检测阳性。
1.4 阴道镜检查和活检病理组织学
LBP结果≥LSIL、HPV16或18阳性、其他高危阳性且LBP为ASCUS即转诊阴道镜检查。由具有丰富经验的细胞病理医生采用3%~5%醋酸试验程序,在阴道镜检查异常部位取活检,或者在血液循环丰富区域取活检,必要时颈管内膜诊刮(ECC)[6]。
活检组织学标本常规HE染色,同时行P16和Ki67两项免疫组化染色(Roche抗P16鼠单克隆抗体、Dako抗Ki67鼠单克隆抗体),由2名高年资病理医生判读结果。按2014年第四版WHO女性生殖器肿瘤分类标准[7]分为正常、LSIL(宫颈上皮内廇变CIN1)、HSIL(CIN2和CIN3)、宫颈浸润癌。
1.5 统计学方法
分层:组织病理学,CIN2及以上为研究终点,包括CIN2、CIN3和宫颈浸润癌,即CIN2+。将筛查结果分层,① 细胞学LBP分为3层:ASCUS及以上为异常结果,高级别(ASC-H、HSIL、AGC-NOS/FN)、低级别(ASCUS、LISL)、正常。② HPV分3层:16/18型、其他型别阳性、阴性。③ P16分两层:阳性、阴性。计算不同组合的亚组进展为CIN2+的风险,即CIN2+的患者数量与该亚组所有患者总数的比值。采用SAS 9.6软件统计分析,计数资料采用频率描述,应用Clopper-Perrson计算率的(95%CI)值,以P<0.05为差异有统计学意义。
2 结果
共收集到有效病例900例,年龄为21~69岁,平均(40.57±10.77)岁。其中细胞学判读为ASCUS及以上为218例;HPV阳性356例,HPV阴性544例;细胞学P16阳性212例,阴性688例;病理组织学CIN2级53例,CIN3级71例,宫颈癌5例。
2.1 LBP、HR-HPV以及细胞学P16不同组合亚组中发生CIN2+的风险
共有18个亚组,见表1,按照发生风险排序,在亚组A1~A3组发生CIN2+的风险较高且大于60.0%,分别是93.1%(95%CI:0.772-0.992)、85.5%(95%CI:0.742-0.931)和68.4%(95%CI:0.434-0.874)。亚组A4~A8发生CIN2+风险较高,在28.5%~50.0%之间,分别为42.9%(95%CI:0.177-0.711)、42.9%(95%CI:0.218-0.660)、40.1%(95%CI:0.191-0.639)、33.4%(95%CI:0.008-0.906)和28.6%(95%CI:0.084-0.581)。A9~A12发生CIN2+风险较低(低于15%),A13~A18组别中未发现CIN2+。同时可看出,排序后发生CIN2+风险与P16排序一致,P16阴性病例无CIN2+发生。反而A4组(LBP高级别、HPV阴性、P16阳性患者14例)出现6例CIN2+,说明HPV阴性预测值低于P16。P16仅在A7组(LBP高级别、HPV阴性、P16阴性患者)漏诊1例CIN2+,HPV也同时在这1例患者发生漏诊。
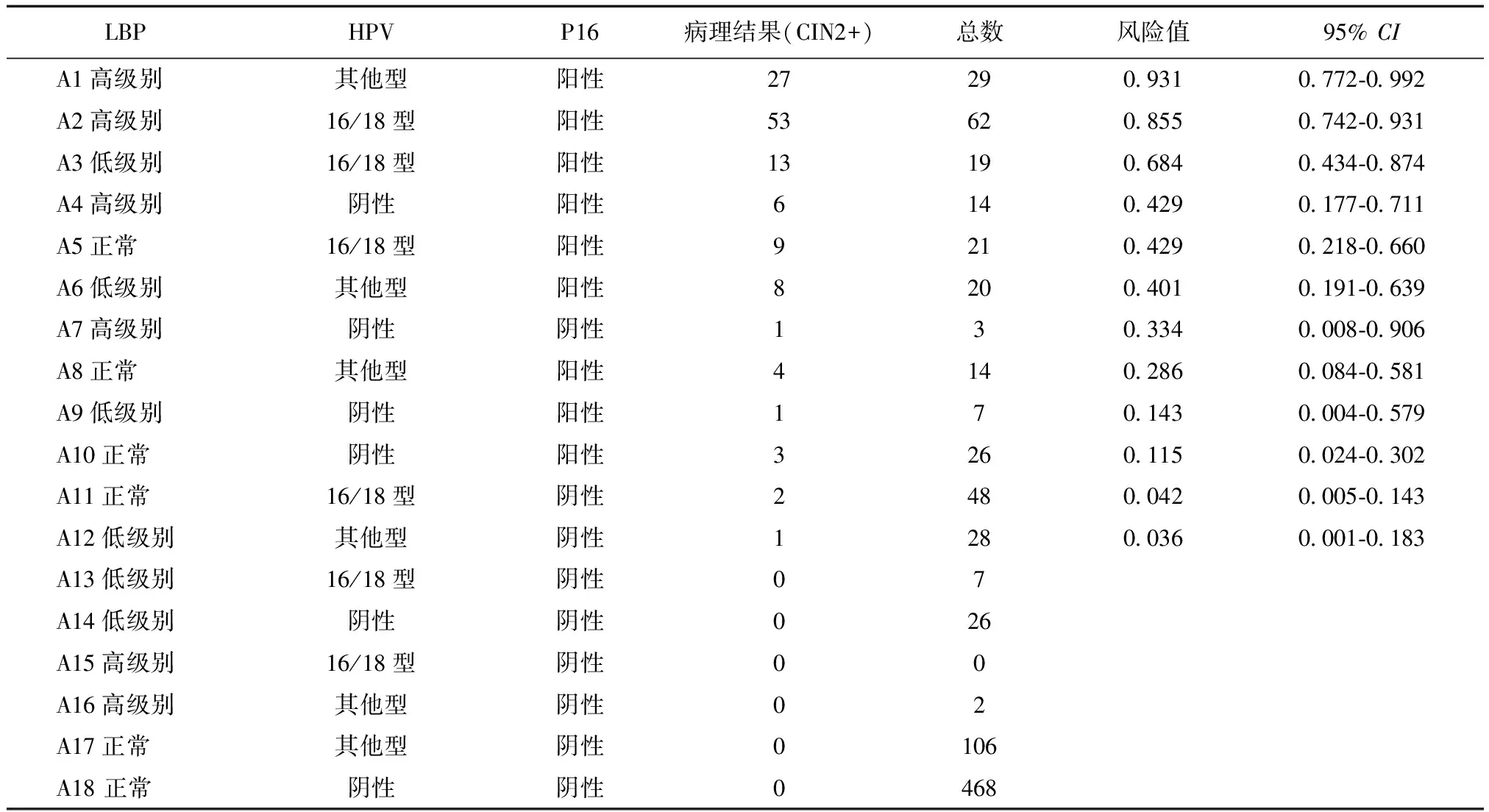
表1 LBP、HR-HPV以及细胞学P16不同组合亚组中发生CIN2的风险
2.2 LBP、HR-HPV不同组合亚组中发生CIN2+的风险
共有9个亚组,见下页表2,按照发生风险排序,在亚组B1~B4组发生CIN2+的风险较高且大于40.0%,分别是87.1%(95%CI:0.702-0.964)、85.5%(95%CI:0.742-0.931)、50.0%(95%CI:0.299-0.701)和41.2%(95%CI:0.184-0.671)。亚组B5~B6发生CIN2+风险较低,分别为18.8%(95%CI:0.089-0.326)和15.9%(95%CI:0.082-0.267)。B7~B9发生CIN2+风险更低(低于5%),B9组(LBP正常、HPV阴性)发生CIN2+风险仅为0.006%(95%CI:0.001-0.018)。但在B4组(LBP高级别、HPV阴性17例)病例中,HPV漏诊7例,提示LBP高级别特异度良好。
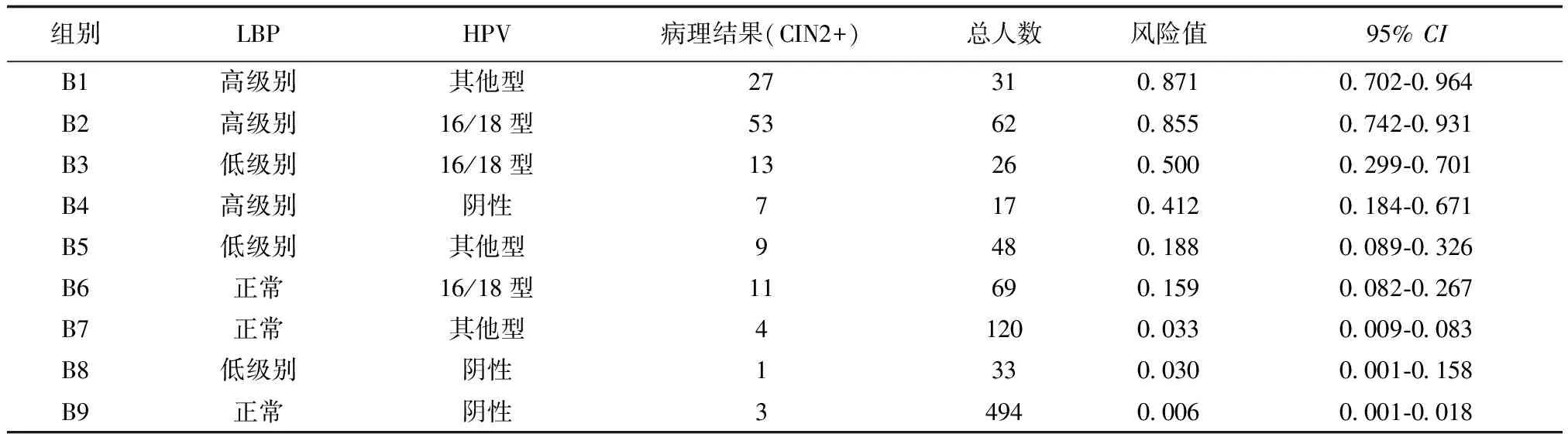
表2 LBP、HR-HPV不同组合亚组中发生CIN2的风险
2.3 HR-HPV、P16不同组合亚组中发生CIN2+的风险
共有6个亚组,见下页表3,按照发生风险排序,在亚组C1组和C2组发生CIN2+的风险较高且大于60.0%,分别是73.5%(95%CI:0.639-0.818)、61.9%(95%CI:0.488-0.739)。亚组C3发生CIN2+风险较低,为21.3%(95%CI:0.107-0.357),此组患者为HPV漏诊CIN2+病例。C4~C6组发生CIN2+风险更低(低于5%),C6组(P16阴性、HPV阴性)发生CIN2+风险仅为0.002%(95%CI:0.000-0.011)。提示HPV、P16均具有优秀的阴性预测值,相比较P16的阳性预测价值更高。
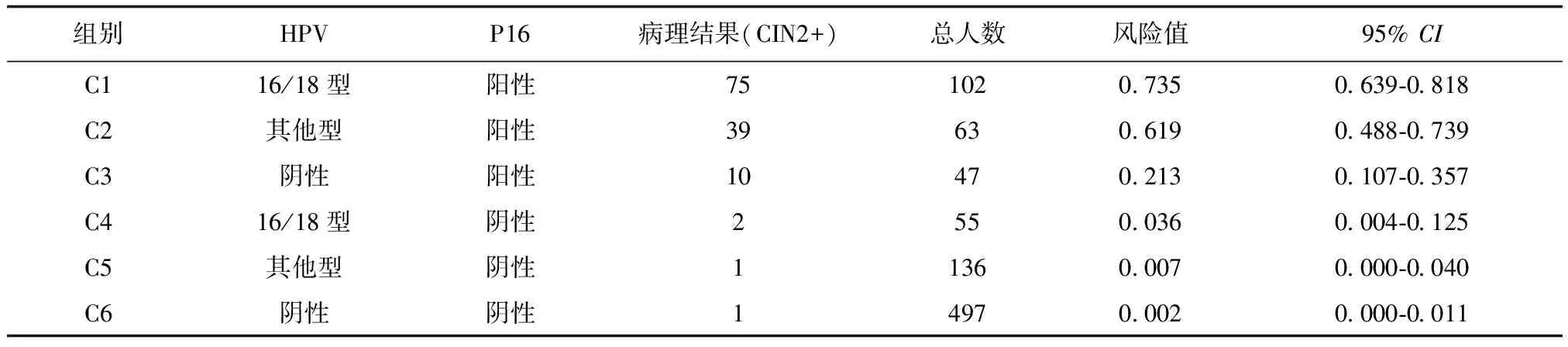
表3 HR-HPV、P16不同组合亚组中发生CIN2的风险
2.4 LBP、P16不同组合亚组中发生CIN2+的风险
共有6个亚组,见下页表4,按照发生风险排序,在亚组D1组和D2组发生CIN2+的风险较高且大于40.0%,分别是81.9%(95%CI:0.732-0.887)、47.8%(95%CI:0.329-0.631)。亚组D3和D4发生CIN2+风险较D1、D2低,为26.2%(95%CI:0.158-0.391)和20.0%(95%CI:0.005-0.716),在D4组患者中P16漏诊CIN2+ 1例。D5~D6组发生CIN2+风险更低(低于2%),D4~D6组(P16阴性共688例)者中仅4例发生CIN2+。提示P16的阴性预测值优异。
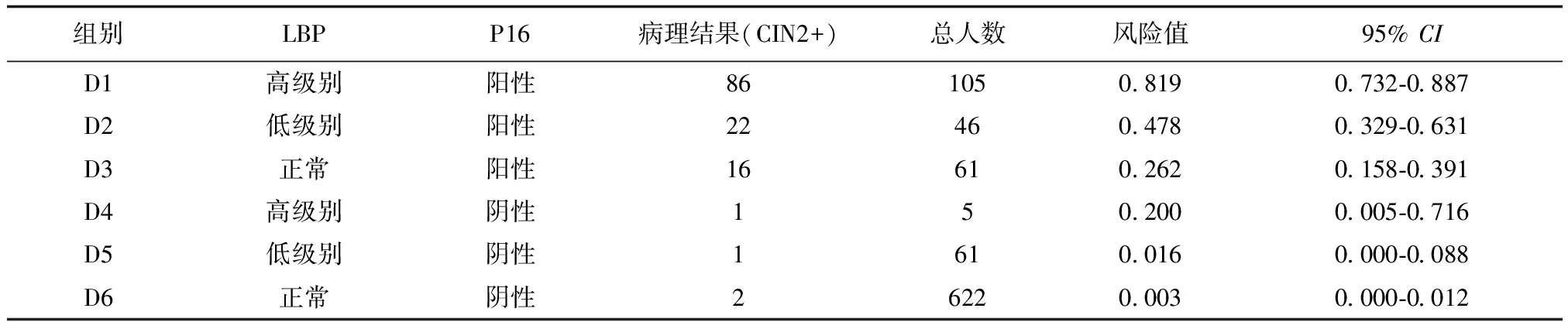
表4 LBP、P16不同组合亚组中发生CIN2的风险
3 讨论
LBP和高危HPV检测是目前常用的宫颈癌筛查方法,LBP特异度高,但受制于细胞学病理医生技术水平及染色等差异,一致性差,敏感性低,HPV相较LBP更客观、灵敏度高,故在筛查中的有效性得到广泛认可,并逐渐处于宫颈癌筛查的主导地位,但特异度不足,不能识别持续感染,导致过度转诊阴道镜,引起不必要的恐慌,浪费社会医疗资源。
理想的筛查策略是投入最少,但尽可能多地筛出癌前病变,减少漏诊,减少阴道镜检查的次数。研究已经明确持续的HR-HPV感染是宫颈癌发生的必要因素,HPV具有很好的阴性预测价值,可以保证很低的宫颈癌发生率,因此世界范围内宫颈癌筛查策略逐渐由以形态学为基础的细胞学筛查转至分子生物学检测的HR-HPV检测或包含HR-HPV检测的策略[8]。
HR-HPV16/18以外型别阳性、LBP阴性在6~12个月后复查,HPV16/18阳性、其他型别阳性和LBP异常(ASCUS及异常)时转诊阴道镜。LBP为LSIL及以上无论是否HPV阳性、ASCUS且HR-HPV阳性直接转诊阴道镜[9]。2019年更新了指南提出“采用基于风险”的管理策略,根据患者的既往病史及当前的检查结果判断发生CIN3的风险是否达到4.0%或更高,作为掌握转诊阴道镜的指征[10]。
阴道镜检查活检是宫颈癌三阶梯治疗中至关重要的一环,根据阴道镜所见在可疑病变组织取活检,但是否活检、活检具体部位、是否连续活检等具有一定主观性,其次患者绝经与否、转化区类型等均可能影响阴道镜医生的判断,比如宫颈癌时的出血坏死干扰导致漏诊,而阴道微生态影响、脱落细胞等导致不必要部位活检过度诊疗。阴道镜的本质目的是寻找可疑高级别病变的部位取活检,可检出大部分宫颈表面异常的病灶,但对于颈管的病灶、或宫颈表面因炎症或化生干扰的病灶,识别起来可能出现决策困难,但以形态学为基础的细胞学可以提高高级别病变的检出率。此外,从肿瘤生成的机制来讲,由于HR-HPV的噬上皮特性,感染宫颈上皮表层细胞,未整合到宿主染色体时,HR-HPV会随宿主上皮细胞脱落被清除,成为一过性感染,如果足量的病毒通过免疫逃逸,进入宫颈黏膜裂口感染宫颈黏膜基底层细胞,造成整合,并经多因素促癌刺激导致宫颈基底层细胞呈现单克隆增生[11],当增殖超过上皮厚度300 μm的无血管的阈值、细胞聚集成2~3 mm细胞团,新生血管形成,最终导致肿瘤。因此除了发现细胞异形性之外,异常血管也是高级别病变的表现形式,在阴道镜检查中如果无阳性的阴道镜所见,则需要在血液循环丰富区域连续活检,必要时颈管搔刮[12]。事实上,细胞学和HR-HPV检测结果对宫颈癌前病变和宫颈癌有预测意义,并对后续的活检有一定指导作用[13],但阴道镜医师不能局限于此,也需提高专业技能,重视阴道镜所见,识别出高级别病变和宫颈癌。但由于细胞学依赖病理医生的技术水平,不同中心的质控存在差异导致判读缺乏一致性,漏诊率高[14]。而HR-HPV尽管有较高的灵敏度,但特异度低,细胞学和HR-HPV对阴道镜活检部的指导价值并未达到预期。
基于风险分层角度预测CIN2+的发生,本研究发现, P16参与的筛查方案A、C、D组分层可见,按照发生CIN2+发生风险由高到低排序,基本与P16符合,P16阳性者发生风险高,提示了P16具有优秀的阴性预测值。在A组(LBP、HR-HPV、P16组合)中,仅在A7组(LBP高级别、HR-HPV阴性、P16阴性患者)漏诊1例CIN2+, A1~A10 P16阳性发生CIN2+风险由93.1%~11.5%,而P16阴性发生率不足5.0%。在亚组A1~A3组(即LBP、P16、HR-HPV三项均阳性)发生CIN2+的风险较高且大于60.0%,分别是93.1%、85.5%和68.4%,提示此类病例阴道镜检查时需格外重视,避免活检不足导致漏诊。在B组(LBP和HR-HPV组合中),B1和B2组,LBP高级别、HR-HPV其他型别阳性组发生CIN2+风险略高于LBP阳性16/18阳性组,分别为87.1%和85.5%,因此两者均阳性阴道镜时需要格外加强注意,但与其他研究HPV 16/18阳性发生CIN2+风险高的结果略有差异[15],但也有流行病学研究表明其他12种发生CIN2+的风险高于HPV 16/18[16],与本实验数据相似。B4和B3组比较,LBP高级别、HR-HPV阴性组发生CIN2+风险低于LBP低级别、HPV 16/18阳性组,说明16/18预示发生CIN2+风险高,与既往研究相似[17]。在亚组D1组(LBP高级别和P16阳性)和D2(LBP低级别和P16阳性)组发生CIN2+的风险较高且大于40.0%,分别是81.9%、47.8%。D4(P16阴性和LBP高级别)发生风险也仅为20.0%,D4~D6组(P16阴性共688例)患者中仅4例发生CIN2+。
细胞学P16通过抑制视网膜母细胞蛋白RB蛋白磷酸化发挥调控细胞周期的作用。RB基因产物可降调P16的表达,在正常细胞中为低表达,在HPV转染的上皮细胞内,HPV功能蛋白E7导致RB功能失活,抑制释放导致P16过度表达,因此作为新一代生物学标志物,代表HPV感染转化,早于细胞形态学发生异常被检测出进而实现宫颈癌早诊。对组织病理学高级别病变判读有争议时,以P16阳性判读为HSIL,反之为LSIL[18]。P16与宫颈癌的发生、发展及预后关系密切,一定程度上反映疾病的严重程度,并且其高表达代表了病毒活动期,转染力、增殖力强,预示恶性肿瘤的高度侵袭性[19],可用于监测疾病治疗效果和预测预后。在临床实际操作中,细胞学P16的采样流程与LBP同步,对形态学依赖小,具有很好的可重复性,在一定程度上有可能取代LBP。
本研究前期数据[20]显示CIN2+患者P16阳性表达率显著高于LSIL和宫颈正常者,并随着宫颈病变的严重程度呈正相关,一定程度上可以预测疾病的严重程度,随着宫颈病变程度的加重,P16的阳性率成增高趋势。P16阳性可用来警示疾病进展高风险,指导高级别病变的预后。即使P16单筛作为宫颈癌筛查初筛方案,也表现出优秀的特异度和灵敏度[21]。因此在阴道镜检查时,尤其要关注P16阳性病例,合并其他两项异常时,更需要关注阴道镜所见,在宫颈异常表现部位充分活检,以提高高级别病变的检出率,减少漏诊。相反,P16阴性病例,由于P16的阴性预测值很高,阴道镜无阳性发现则减少盲目活检,避免不必要的宫颈损伤。
目前许多宫颈癌筛查中心尚未普及细胞学P16,综合评估细胞学P16参与的筛查策略的文献较少,现有的不同筛查中心筛查策略存在差异,研究结果也不同,本研究入组对象均进行了三项筛查,阳性者转诊阴道镜,因此仅进行了一项筛查即转诊阴道镜的患者没有纳入研究,可能存在一定的选择偏倚,有待进一步研究纠正。
总之,基于LBP、细胞学P16、HR-HPV不同组合在阴道镜检查中评估女性发生CIN2+的风险预测可用于临床风险分层管理,有助于阴道镜医生在检查中除了阴道镜所见以外,参考已知的检查结果进行精准阴道镜活检和判读,有助于CIN2+病例的检出,减少误诊和降低漏诊率,在我国高质量的细胞学筛查资源极度匮乏的情况下,推广较HPV相比更能反映HPV感染持续状态和鳞状细胞恶性转化的P16临床应用,便于因地制宜地选择相应的筛查策略,以适应现阶段筛查需求。

