IGF1调控PI3K/AKT信号通路对卵巢癌细胞增殖和侵袭的影响
郑小妹,林叶飞,张韶琼,杨洁,陈曼玲
据统计,卵巢癌是全球第二致命的妇科恶性肿瘤,也是女性癌症死亡的第八大原因[1]。过去十年间,卵巢癌患病率持续增加[2]。由于缺乏有效的早期筛查方法,超75%的卵巢癌患者在确诊时已发展为晚期[3]。因此探索卵巢癌新的治疗靶点对其诊疗至关重要。
胰岛素样生长因子1(insulin-like growth factor-1,IGF1)是一种7 kd的单链多肽,可通过刺激细胞的有丝分裂、抗凋亡和趋化作用促进生物体生长发育[4]。越来越多的研究发现,IGF1与癌症的发生发展相关。IGF1在非小细胞肺癌[5]、结肠癌[6]、卵巢癌[7-8]中表达上调,并与肿瘤的耐药性、生长和转移相关。然而其在卵巢癌发病中的机制缺乏进一步的研究。磷脂酰肌醇-3-激酶(phosphatidylinositol-3-kinase,PI3K)/AKT信号通路在许多生理和病理状况中至关重要,例如细胞增殖、血管生成、代谢、分化等过程[9]。研究发现,在大约70%的卵巢癌中PI3K/AKT通路被激活[10],然而尚不清楚IGF1发挥作用是否与调控PI3K/AKT信号通路相关。本研究旨在分析IGF1在卵巢癌组织中的表达,探索IGF1参与卵巢癌发生发展的机制,为将来进一步研究卵巢癌免疫疗法提供参考价值。
1 材料与方法
1.1 临床样本
选取2019年3月至2021年9月于海南医学院第一附属医院进行手术切除治疗的卵巢癌患者27例,Ⅰ~Ⅱ期14例,Ⅲ期13例。收集切除的卵巢癌组织,取材后立即置于液氮冷冻,保存于-80℃冰箱。所有患者术前均未接受放化疗。本研究经我院伦理委员会批准,并取得患者知情同意。
1.2 细胞和主要试剂
人卵巢癌细胞系Skov-3、Caov-3、PA-1购自中科院上海细胞库,Recilisib(ON 01210)购自美国MedChemExpress(MCE),胎牛血清、RPMI 1640培养基购自Giboco公司,si-NC、si-IGF1及BCA 蛋白定量试剂盒购自美国Invitrogen公司,LipofectamineTM 2000、实时荧光定量PCR仪和凝胶成像系统购自赛默飞世尔科技(中国)有限公司,细胞培养箱和酶标仪购自美国Bio-Rad公司,p-PI3K、PI3K、p-AKT、AKT、GAPDH抗体购自Abcam公司,qRT-PCR试剂盒(RNA提取试剂、逆转录试剂盒和SYBR Green试剂)、CCK8试剂盒购自Vazyme公司,胰酶消化液购自sigma公司,Transwell小室购自Corning公司,GAPDH引物、IGF1引物、PI3K引物购自上海生工生物工程有限公司。
1.3 实验方法
1.3.1 细胞培养 人卵巢癌细胞系Skov-3、Caov-3、PA-1使用含10%胎牛血清RPMI 1640培养基培养,均置于37 ℃、5%CO2恒温的湿润培养箱中培养,每3 d进行换液,根据细胞生长密度更换新鲜的培养基,当细胞汇集80%左右进行传代培养,取对数生长期的细胞进行实验。
1.3.2 细胞转染 将以3.5×106个对数生长期的Skov-3细胞接种于6孔板中,待细胞生长密度至65%~75%时,分别转染si-NC、si-IGF1,设置为si-NC组(转染si-NC)与si-IGF1组(转染si-IGF1)。严格按照说明书,采用Lipofectamine 2000将si-NC、si-IGF1转染至Skov-3细胞中。转染48 h后,通过qRT-PCR检测IGF1基因表达水平。
1.3.3 qRT-PCR检测mRNA的表达 TRIzol试剂提取人卵巢癌肿瘤组织、癌旁组织以及人卵巢癌细胞系Skov-3、Caov-3、PA-1中的总RNA,收集RNA样品,测定浓度后按照qRT-PCR试剂盒实验说明,依次进行逆转录和qRT-PCR实验。具体为:第一阶段,95 ℃ 3 min,1个循环;第二阶段,95 ℃ 12 s,62 ℃ 40 s,95 ℃ 15 s,40个循环。扩增结束后,2-ΔΔCt法计算各基因的相对表达量,GAPDH作为内参基因。Primer Premier 5.0软件设计引物,交由上海生工生物工程公司合成。qRT-PCR引物序列:GAPDH-F,5-AATGGGCAGCCGTTAGGAAA-3,GAPDH-R,5-GCGCCCAATACGACCAAATC-3;IGF1-F,5-ACCTG CCTGGGTGTCCAAAT-3、IGF1-R,5-CGATAGGGACGG GGACTTCT-3;PI3K-F,5-ACCTTAAATGGTGAGCACGGA,PI3K-R,5-GGCCCGCACTGTAACCTATT-3。
1.3.4 Western blot检测蛋白的表达 采用RIPA裂解液从组织和细胞中分别提取总蛋白。使用10% SDS-PAGE分离蛋白质,然后再将分离的蛋白转移至PVDF膜上,接着采用5%脱脂奶粉封闭1 h,再加入一抗p-PI3K(1∶1 000),PI3K(1∶1 000),p-AKT(1∶1 000),AKT(1∶1 000),GAPDH(1∶4 000)于4℃冰箱中过夜孵育。次日,采用TBS将PVDF膜清洗3次后,加入羊抗兔二抗(1∶2 000)于室温条件下孵育1 h,再使用TBS清洗3次后,加入化学发光剂避光孵育3 min,然后将PVDF膜放入成像系统中采集图片信息,并使用Image J软件计算灰度值。
1.3.5 CCK8实验检测细胞增殖水平 将对数期生长的Skov-3细胞接种于96孔板,每孔细胞数为1×104。细胞继续培养24 h后,按照之前所述步骤,进行细胞的处理及转染。随后向每孔细胞内添加10 μL CCK-8溶液,37 ℃条件下孵育4 h后,酶标仪测定450 nmol/L处的光密度(optical density,OD)值作为细胞的相对增殖率。
1.3.6 Transwell细胞侵袭实验 取50 μL基质胶铺于8 μm Transwell小室内,37 ℃培养箱静置1 h。取各组细胞,胰酶消化后离心,后用无血清RPMI 1640培养基重悬细胞并计数,调整细胞数至2×104/mL,接种于Transwell小孔上室,每孔200 μL。下室加入500 μL含10%血清的DMEM培养基,培养24 h。取出Transwell小室,用4%的多聚甲醛固定15 min,0.1%结晶紫染色20 min,PBS清洗后在倒置显微镜下随机选取10个视野的细胞进行计数。
1.4 统计学方法
2 结果
2.1 卵巢癌患者IGF1、PI3K表达水平相关性比较
qRT-PCR结果显示,与癌旁组织比较,肿瘤组织IGF1(P=0.001)和PI3K(P=0.001)表达水平升高,见图1A;与Ⅰ~Ⅱ期比较,Ⅲ期肿瘤组织中IGF1(P=0.006)和PI3K(P=0.004)表达水平升高,见图1B。在肿瘤组织中,IGF1和PI3K的表达水平呈正相关(P=0.001),见图1C。
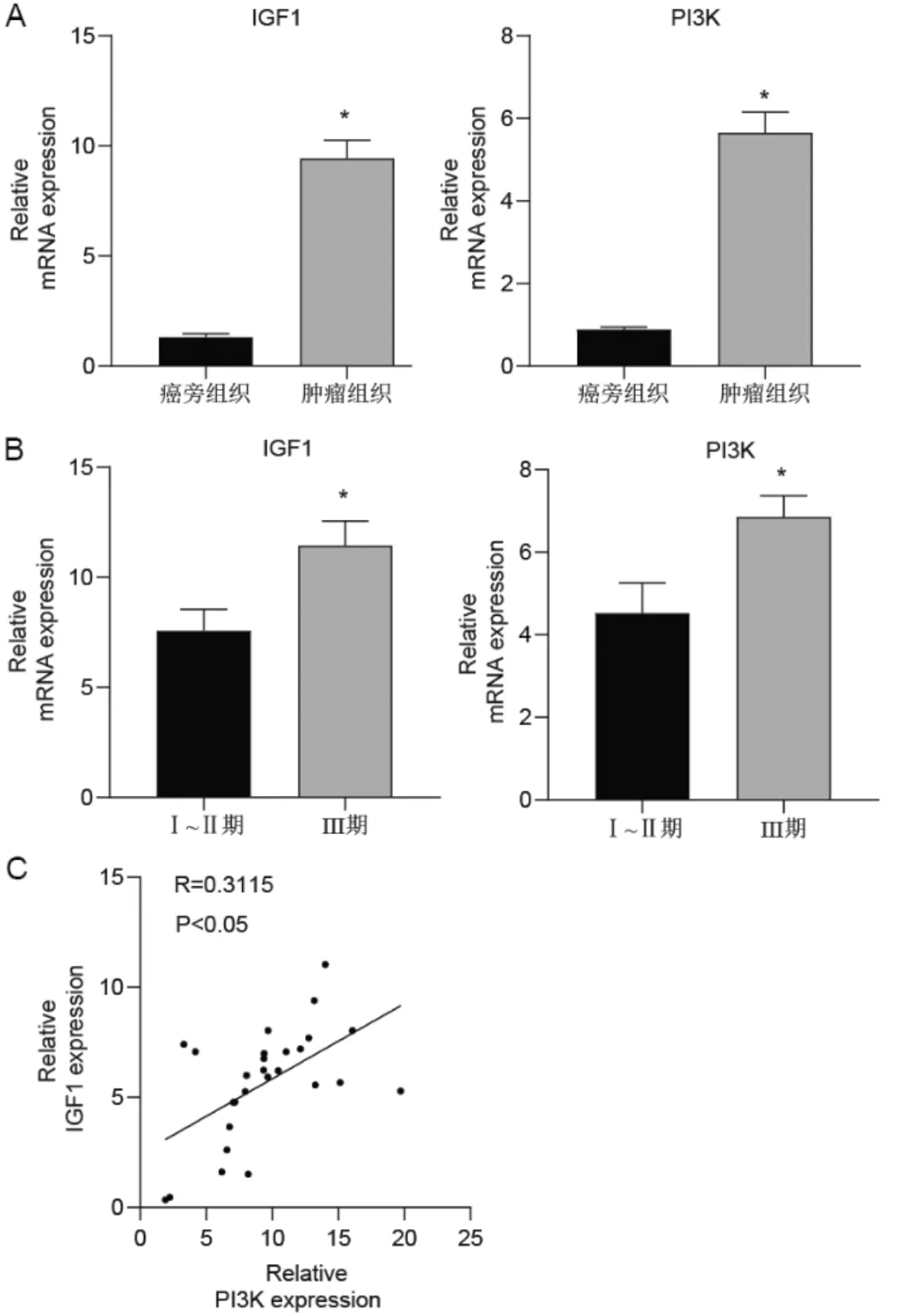
注:A为癌旁组织和肿瘤组织IGF1和PI3K表达水平;B为Ⅰ~Ⅱ期和Ⅲ期肿瘤患者肿瘤组织IGF1和PI3K表达水平;C为IGF1和PI3K表达水平相关性分析。与癌旁组织比较,*P<0.05;与Ⅰ~Ⅱ期比较,*P<0.05
2.2 细胞系选择和si-IGF1细胞系构建
qRT-PCR结果显示,与Caov-3和PA-1细胞比较,Skov-3细胞IGF1表达水平升高(P=0.003、0.005)见图2A。因为Skov-3细胞中IGF1表达水平最高,因此后续选择Skov-3作为实验细胞进行敲减IGF1。通过脂质体转染法将si-IGF1和si-NC转染至Skov-3细胞,qRT-PCR结果显示,与si-NC组比较,si-IGF1组IGF1基因表达水平降低(P=0.002),说明si-IGF1细胞系构建成功,见图2B。

注:A为Caov-3、PA-1和Skov-3细胞中IGF1表达水平;B为si-IGF1沉默IGF1效率。与Caov-3、PA-1比较,*P<0.05;与si-NC组比较,*P<0.05
2.3 沉默IGF1抑制肿瘤细胞增殖和侵袭
CCK8结果显示,与si-NC组比较,si-IGF1组细胞增殖能力降低,在72 h时表现出显著性差异(P=0.013),见下页图3A。Transwell结果显示,与si-NC组比较,si-IGF1组细胞侵袭能力降低(P=0.001),见下页图3B。
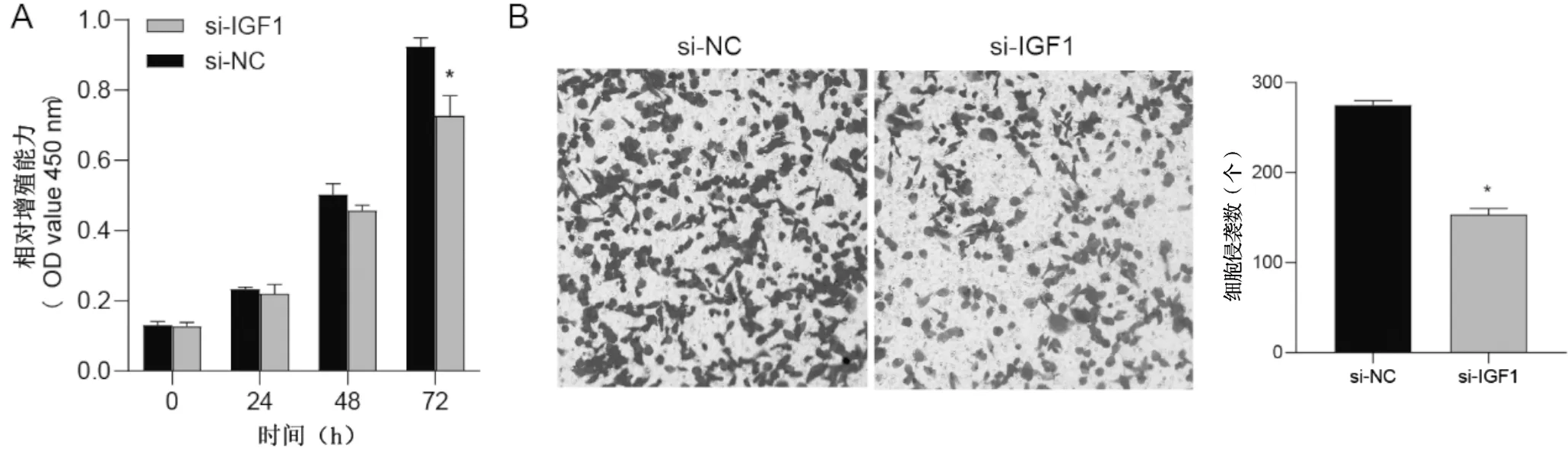
注:A为si-NC和si-IGF1组细胞增殖能力;B为si-NC和si-IGF1组细胞侵袭能力。与si-NC组比较,*P<0.05
2.4 沉默IGF1抑制PI3K/AKT信号通路
Western blot结果显示,与si-NC组比较,si-IGF1组p-PI3K(P=0.002)和p-AKT(P=0.001)蛋白表达水平降低(P<0.05),见图4。

注:与si-NC组比较,*P<0.05
2.5 激活PI3K/Akt信号通路不影响IGF1表达
Western blot结果显示,与si-NC组和si-IGF1组比较,si-NC+Recilisib和si-IGF1+Recilisib组p-PI3K(si-NC vs si-NC+Recilisib,P=0.001;si-NC vs si-IGF1+Recilisib,P=0.002;si-IGF1 vs si-IGF1+Recilisib,P=0.001)、p-AKT(si-NC vs si-NC+Recilisib,P=0.001;si-NC vs si-IGF1+Recilisib,P=0.001;si-IGF1 vs si-IGF1+Recilisib,P=0.001)蛋白表达水平升高,见图5A。qRT-PCR结果显示,与si-NC组比较,si-NC +Recilisib组IGF1基因表达水平差异无统计学意义(P=0.674);与si-IGF1组比较,si-IGF1 +Recilisib组IGF1基因表达水平差异无统计学意义(P=0.537),见图5B。说明PI3K/AKT信号通路不影响IGF1表达,IGF1位于PI3K/AKT信号通路上游。

注:A为四组细胞中p-PI3K、p-AKT蛋白表达水平;B为四组细胞中IGF1基因表达水平。与si-NC组比较,*P<0.05
2.6 激活PI3K/AKT信号通路拮抗IGF1对肿瘤细胞的调节作用
CCK8结果显示,与si-NC组和si-IGF1组比较,si-NC+Recilisib和si-IGF1+Recilisib组细胞增殖能力增强,在72 h时表现出显著性差异(si-NC vs si-NC+Recilisib,P=0.023;si-NC vs si-IGF1+Recilisib,P=0.027;si-IGF1 vs si-IGF1+Recilisib,P=0.018),见下页图6A。Transwell结果显示,与si-NC组比较,si-NC+Recilisib和si-IGF1+Recilisib组细胞侵袭能力增强(si-NC vs si-NC+Recilisib,P=0.004;si-NC vs si-IGF1+Recilisib,P=0.007;si-IGF1 vs si-IGF1+Recilisib,P=0.001),见下页图6B。
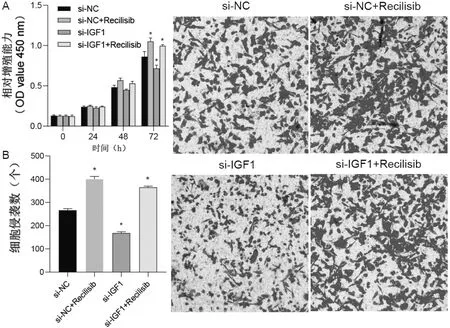
注:A为四组细胞增殖能力;B为四组细胞侵袭能力;与si-NC组比较,*P<0.05
3 讨论
卵巢癌是全球女性癌症相关死亡的主要原因之一,复发率和转移率高,死亡率呈逐年上升趋势[11]。目前卵巢癌治疗以手术治疗为主,再辅以放疗、化疗、内分泌治疗、靶向治疗等综合治疗,但卵巢癌的存活率仍因分期不同有很大差异[12]。因此,探究肿瘤的发生发展机制,寻找可靠的治疗靶点,一直是卵巢癌临床研究的热点和关键。
在垂体生长激素的刺激下,IGF1主要在肝脏中产生,具有与胰岛素相似的分子结构,并能够在胎儿发育过程中调节许多组织的生长和发育[13]。在女性生殖系统中,IGF1在卵泡发育过程中起着至关重要的作用,它们负责在排卵后修复上皮组织[14]。卵巢肿瘤细胞通过自分泌或旁分泌细胞因子来激活上皮细胞来源的IGF信号通路,这可能介导卵巢表面上皮细胞中不受控制的伤口愈合机制[15],因此,在卵巢癌患者中,IGF1及其受体在调节卵巢表面上皮细胞的正常生物学中发挥重要作用。研究表明,IGFs在卵巢癌患者中高表达,并且还可能与卵巢癌发生和耐药性相关[16]。本研究发现,与癌旁组织比较,卵巢癌患者的肿瘤组织中IGF1的mRNA表达水平增加,当沉默IGF1时会抑制肿瘤细胞增殖和侵袭,这与之前的研究报道一致,同时也有研究发现在卵巢癌细胞系中也有显著的IGF1表达上调[17]。以上结果表明,IGF1可能通过促进肿瘤细胞的增殖与迁移等参与卵巢癌的发生和发展。
PI3K属于脂质激酶家族,AKT是PI3K的直接下游效应体,PI3K/AKT是调节细胞凋亡、细胞代谢和增殖等多种生物学过程信号传导的重要途径[18]。当细胞外配体(例如胰岛素或胰岛素样生长因子)与细胞膜受体(例如酪氨酸激酶受体或G 蛋白偶联受体)结合后,PI3K被激活,催化PIP2磷酸化生成 PIP3,募集AKT和磷酸肌醇依赖性蛋白激酶 1(phosphoinositol-dependent kinase 1,PDK1)到细胞膜,激活的AKT磷酸化下游底物,从而调控细胞迁移、代谢和周期进展[19]。
越来越多的研究发现, PI3K/AKT信号通路在促进癌症发展中发挥关键作用,Du L等[20]研究发现,通过抑制PI3K/AKT信号通路可以抑制人乳腺癌细胞生长。在结直肠癌中,PI3K/AKT信号通路表达上调与结直肠癌细胞的耐药性和肝转移相关,当抑制该信号通路,肿瘤细胞耐药性与转移能力均下降[21]。另外,有研究证明,PI3K/AKT信号通路在卵巢癌肿瘤的形成、癌细胞迁移、侵袭和化疗抵抗中发挥重要作用[22]。除在卵巢癌发生中的作用外,PI3K/AKT信号通路也被证明可以防止卵母细胞成熟过程中原始卵泡的损伤[23]。本研究同样发现,PI3K表达水平上调,并与肿瘤分期相关;在肿瘤组织中,IGF1和PI3K的表达水平呈正相关,这提示IGF1和PI3K之间可能存在相互调控的作用。既往研究发现,IGF1可以激活 PI3K/AKT 信号通路促进宫颈癌和胶质母细胞瘤的发展[24-25]。本研究进一步发现,沉默IGF1抑制PI3K/AKT信号通路,而激活PI3K/AKT信号通路不影响IGF1的表达,但是可以拮抗IGF1对肿瘤细胞的调节作用。以上结果提示,在卵巢癌的发展中,PI3K可能受到IGF1的调控作用,IGF1可能是通过上调PI3K的表达促进癌细胞的增殖与迁移。
综上所述,IGF1与PI3K在卵巢癌中高表达,并且具有显著相关性。IGF1可能通过增强PI3K/AKT信号通路促进卵巢癌细胞增殖和侵袭,最终介导肿瘤恶化。以上结果初步明确了IGF1与PI3K/AKT在卵巢癌发生发展中的作用,可为进一步探讨卵巢癌增殖和转移机制提供新的思路。

