二苯乙烯苷对阿尔茨海默病神经元细胞凋亡的抑制作用
李彦炳,夏小燕,康碧倩,李悦,何晓璇,李振中,朱晓莹,廖艳花,黄忠仕
(1. 右江民族医学院基础医学院,广西 百色 533000;2. 广西中医药大学药学院,广西 南宁 530200;3. 右江民族医学院药学院,广西 百色 533000;4. 右江民族医学院临床医学院,广西 百色 533000)
阿尔茨海默病(alzheimer disease,AD)是一种以大脑皮质和海马突触功能障碍与神经元细胞丢失为特征的进行性神经退行改变疾病,在临床上,阿尔茨海默病常表现为渐进性的认知缺陷和记忆障碍[1-2]。目前,对AD的发病机制尚未完全明确,其中B淋巴细胞瘤因子相关X蛋白(Bcl-2-associated X protein,Bax)、B淋巴细胞瘤-2(B-cell lymphoma-2,Bcl-2)作为凋亡因子,介导神经元细胞的凋亡,已被广泛证实[3-4]。现如今临床针对AD研发的药物也不可阻止或逆转其疾病进展,只可以在一定程度缓解AD的临床症状,针对AD疾病的治疗,已经对多种中草药进行研究实验,且取得了可观的结果[5-7],为此本实验就二苯乙烯苷(2,3,5,4’-tetrahydroxystilbene-2-O-β-D-glycoside,TSG)对阿尔茨海默病神经元细胞凋亡的抑制情况进行探讨,为AD疾病的治疗寻找更多的可能性[8-10]。
1 材料与方法
1.1实验材料
1.1.1实验用动物 于长沙市天勤生物技术有限公购买SPF级雄性大鼠,24月龄,体质量650~850 g,动物许可证号为SCXK(湘)2019-0014,动物全程饲养于广西百色市右江民族医学院SPF级动物实验中心,所有动物实验研究经右江民族医学院动物实验伦理委员会批准,批准号为2021082001。
1.1.2药物与试剂 山羊抗兔免疫球蛋白G(IgG)二抗(美国ProteintechGroup公司,批号:20000174);β淀粉样蛋白25-35(β-amyloid protein 25-35,Aβ25-35)(美国SIGMA公司,批号:118M4893V);二苯乙烯苷(成都克洛玛生物科技有限公司,批号:CHB180810);石杉碱甲片购自辰欣药业股份有限公司(批号国药准字H20093133,50μ/g片);三代逆转录预混液(武汉莫纳生物科技有限公司,批号:150613);抗体染料法qPCR mix(武汉莫纳生物科技有限公司,批号:140606);TUNEL细胞凋亡检测试剂盒(江苏凯基生物技术股份有限公司,批号:20221129-1)。
1.1.3实验用仪器 ZH-蓝星B/S型大小鼠脑立体定位仪(安徽正华生物仪器设备有限公司);ZH-KES型微量注射泵(安徽正华生物仪器设备有限公司);PAT-8R被动逃避黑白箱(成都泰盟软件有限公司);Histo Core PEARL型自动程控脱水机,EG1150C型自动包埋机(德国徕卡);Neofuge15R型高速冷冻离心机; LightCycler96型实时荧光定量聚合酶链式反应系统(罗氏)。
1.2方法
1.2.1模型制备 适应性喂养2周后,将SD大鼠随机分为7组,每组15只,分别为正常组、假手术组、模型组、阳性药组、TSG低剂量组、TSG中剂量组、TSG高剂量组。SD大鼠称重,甲苯噻嗪(8 mg/kg)腹腔注射麻醉后,备皮,将其稳定固定于脑立体定位仪两滑道之间,保持前后囟同一水平,取75%乙醇由内向外消毒大鼠头顶部备皮区域。执笔式持手术刀垂直进刀,沿矢状缝做一长约3 cm的切口,用组织钳固定两侧皮层,充分暴露切口,剥离颅骨顶部的筋膜及组织,以大鼠前囟为原点,参考大鼠脑立体定位仪图谱选取海马区域(前囟后3.5 mm,中线外侧2.0 mm),取牙科钻分别在两侧海马区域钻出小孔,微量进样器垂直进入2.7 mm。将于37 ℃孵育1周的质量浓度为5 μg/μL的Aβ25-35溶液以0.2 μL/min的速度缓慢匀速注入两侧脑室,注入体积1 μL,注射时间约5 min,注射完成后留针5 min,有助于Aβ25-35充分弥散,缓慢出针。假手术组注射等量生理盐水,正常组不做处理。术后对头部皮层进行缝合,每日通过肌注给予青霉素G10万单位,连续7 d,用于预防切口组织感染[11-13]。
1.2.2筛选动物模型 进行被动回避实验行为学测试,以此作为筛选动物模型造模成功与否的标准。第一阶段将实验大鼠从亮室入口放入实验箱体,打开亮室与暗室之间的门,不通电,进行10 min环境适应后,将实验对象放入暗室并关闭两室之间的门,放置10 s并进行通电,使大鼠形成记忆。第二阶段进行测试,实验对象由明室进入暗室的时间记为潜伏期,在暗室遭受电击次数记为错误次数,记录每个实验对象的潜伏期与5 min内的错误次数。每天进行3次实验,连续7 d实验,以正常组大鼠潜伏期时间为标准,对各组大鼠潜伏期进行分析,排除造模失败的动物模型,各组筛选10只大鼠作为后期实验对象。
1.2.3给药 因手术造模具有无法避免的创造性,且实验用大鼠月龄较大,易死亡,所以经被动回避实验筛选出10只实验大鼠进入后期实验。对筛选出的实验动物进行灌胃给药,正常组、假手术组、模型组(生理盐水30 mL/kg),阳性药组(石杉碱甲0.150 mg/kg), TSG低剂量组(TSG 0.033 g/kg),TSG中剂量组(TSG 0.1 g/kg),TSG高剂量组(TSG 0.3 g/kg),每组每日灌胃给药1次,连续给药4周。
1.2.4取材 灌胃给药结束后,每组大鼠随机取5只,经腹腔注射甲苯噻嗪(8 mg/kg)进行麻醉,全程冰上操作迅速分离出海马组织-80 ℃保存备用,用于后期检测基因及蛋白表达。剩余5只大鼠进行心脏灌流取出完整大脑组织用于TUNEL凋亡实验病理检测和免疫组织化学实验检测。
1.2.5TUNEL凋亡实验病理形态观察 冰上操作取出完整脑组织后,用4%多聚甲醛对含海马体的脑组织块进行固定24 h,再进行酒精梯度脱水,石蜡包埋,切片厚度为4 μm,石蜡切片经常规脱蜡后,按照TUNEL细胞凋亡检测试剂盒步骤进行操作,中性树胶封片,光镜下观察脑组织海马区及皮层区的神经元细胞凋亡情况。
1.2.6实时荧光定量聚合酶链式反应法(qRT-RCR) 按照Trizol试剂盒实验步骤进行操作,提取大鼠脑组织内RNA,通过微量紫外分光光度计检测RNA浓度、纯度。OD260/OD280比值在1.8~2.1范围内的RNA样本可继续进行逆转录实验。按cDNA逆转录试剂盒实验步骤进行操作,将RNA逆转录cDNA。配制反应体系(共20 μL):上/下引物各1 μL、模板cDNA2 μL、通用型快速反应SYBR绿色荧光染料混合物10 μL、无酶水6 μL。反应条件:95 ℃预变性600 s,95 ℃变性10 s,60 ℃延伸30 s,共40个循环,通过qRT-PCR仪两步法对其进行扩增。以GAPDH为内参,2-ΔΔCt法计算各目的mRNA的相对表达量。引物序列合成由武汉金开瑞生物工程有限公司完成,引物序列见表1。
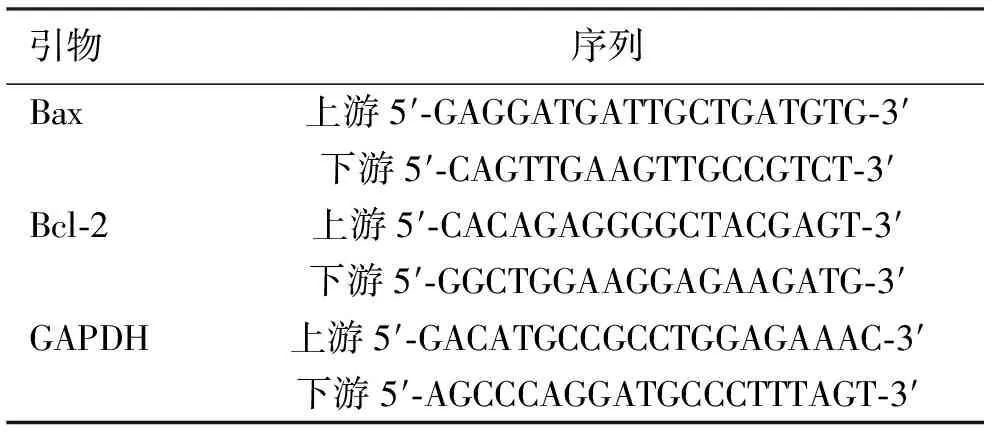
表1 PCR引物序列
1.2.7免疫组织化学染色法(IHC) 将预冻石蜡块进行切片,切片厚度4 μm,60 ℃烤片2 h。石蜡切片经常规脱蜡后,至蒸馏水中待染。切片放入煮沸的柠檬酸抗原修复液中,进行抗原修复2 min,每张切片加50 μL 3%过氧化氢,室温下孵育10 min,以阻断内源性过氧化物酶的活性;切片加50 μL的Bax、Bcl-2一抗溶液(按1∶100稀释),在4 ℃温度下孵育过夜;一抗孵育结束后每张切片加50 μL免疫组化通用试剂盒中的二抗,室温下孵育15 min;经DAB试剂显色,显微镜下观察,适时终止反应,蒸馏水洗涤,苏木素轻度复染30 s,自来水冲洗;梯度酒精脱水,二甲苯透明,中性树胶封片,显微镜观察海马区和皮层区蛋白表达变化。
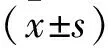
2 结果
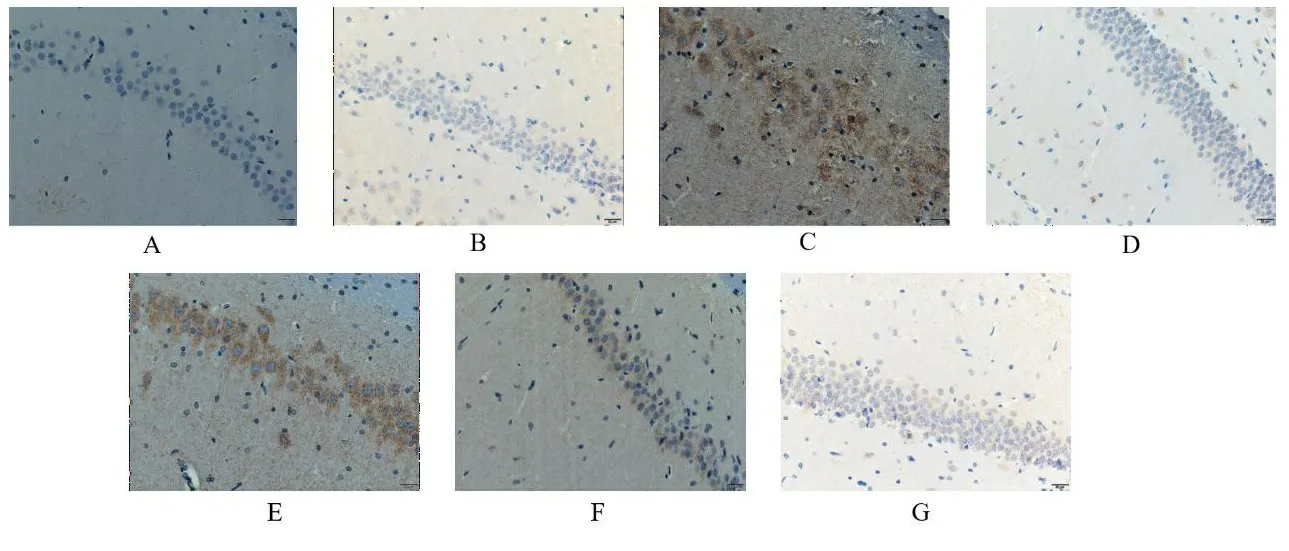
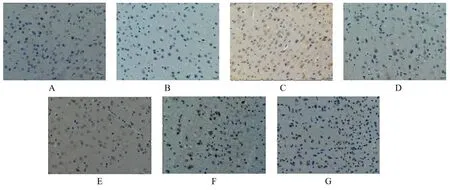
2.1TSG对各组大鼠神经元细胞凋亡的影响 正常组海马区神经元细胞排列有序,细胞完整性良好,少见棕色反应,皮层区神经元细胞数量丰富,棕色反应不显著;与正常组海马区和皮层区比较,假手术组和阳性药组未见明显变化;模型组棕色反应加深且面积扩大,可见固缩深染现象,神经元细胞数量出现减少,细胞完整性被破坏。与模型组海马区和皮层区比较,阳性药组与TSG各剂量组出现不同程度的好转现象,棕色反应不同程度减弱,神经元细胞数量逐渐增加,细胞完整性逐渐恢复。见图1、图2。
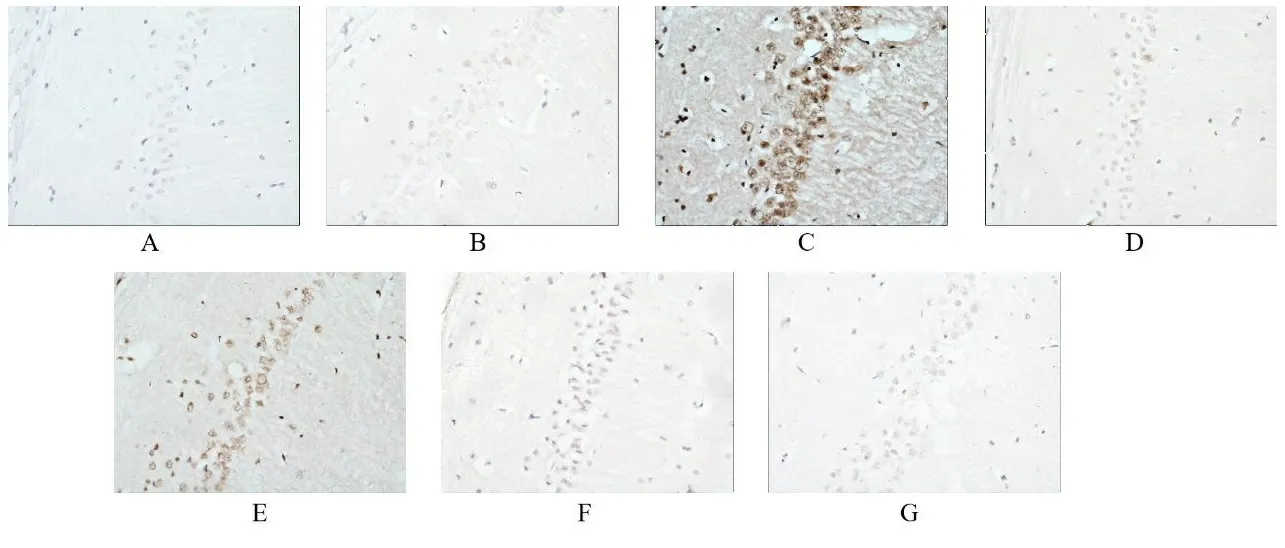
注:A.正常组;B.假手术组;C.模型组;D.阳性药组;E.TSG低剂量组;F.TSG中剂量组;G.TSG高剂量组。
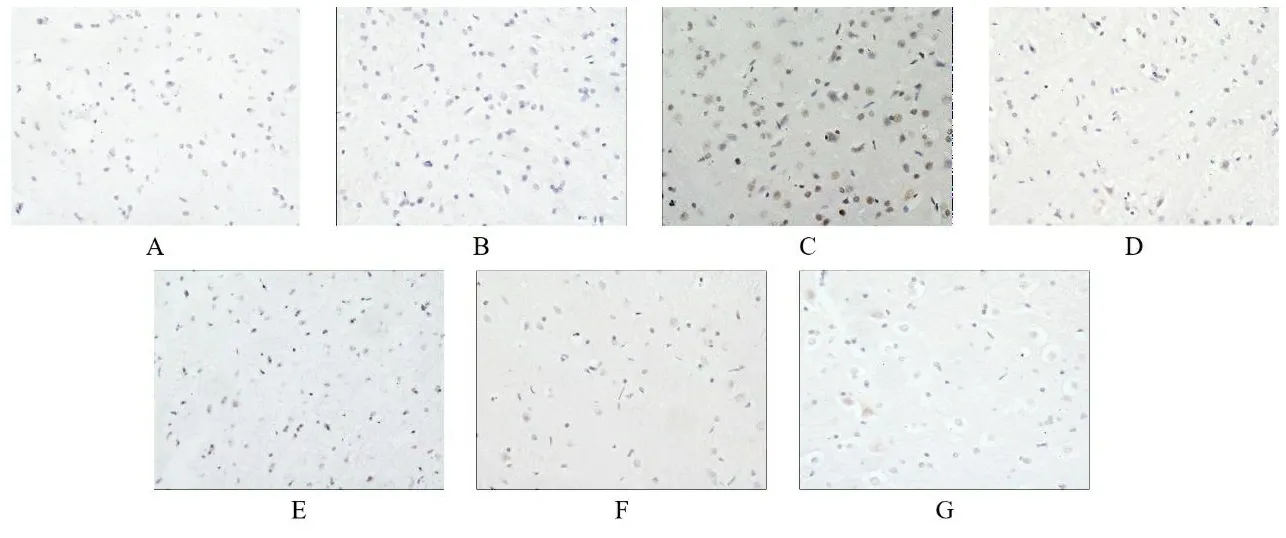
注:A.正常组;B.假手术组;C.模型组;D.阳性药组;E.TSG低剂量组;F.TSG中剂量组;G.TSG高剂量组。
2.2TSG对各组大鼠脑组织中Bax、Bcl-2 mRNA表达的影响 与正常组比较,假手术组Bax mRNA相对表达量无显著变化,阳性药组Bax mRNA相对表达量出现增加(P<0.05),模型组Bax mRNA相对表达量出现显著增加(P<0.01);与模型组比较,阳性药组和TSG各剂量组Bax mRNA相对表达量出现不同程度的减少(P<0.05);与阳性药组比较,TSG低、中剂量组Bax mRNA相对表达量出现增加(P<0.05),TSG高剂量组Bax mRNA相对表达量无明显变化。见图3。
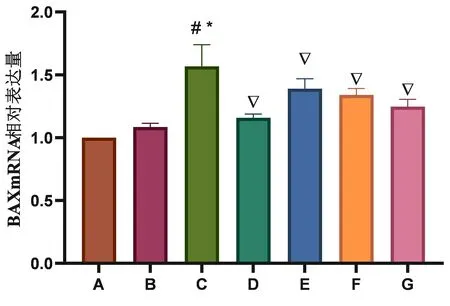
注:A.正常组;B.假手术组;C.模型组;D.阳性药组;E.TSG低剂量组;F.TSG中剂量组;G.TSG高剂量组。与正常组比较,#P<0.01;与假手术组比较,*P<0.01;与模型组比较,▽P<0.05;正常组各指标mRNA表达量均为1。(n=5)。
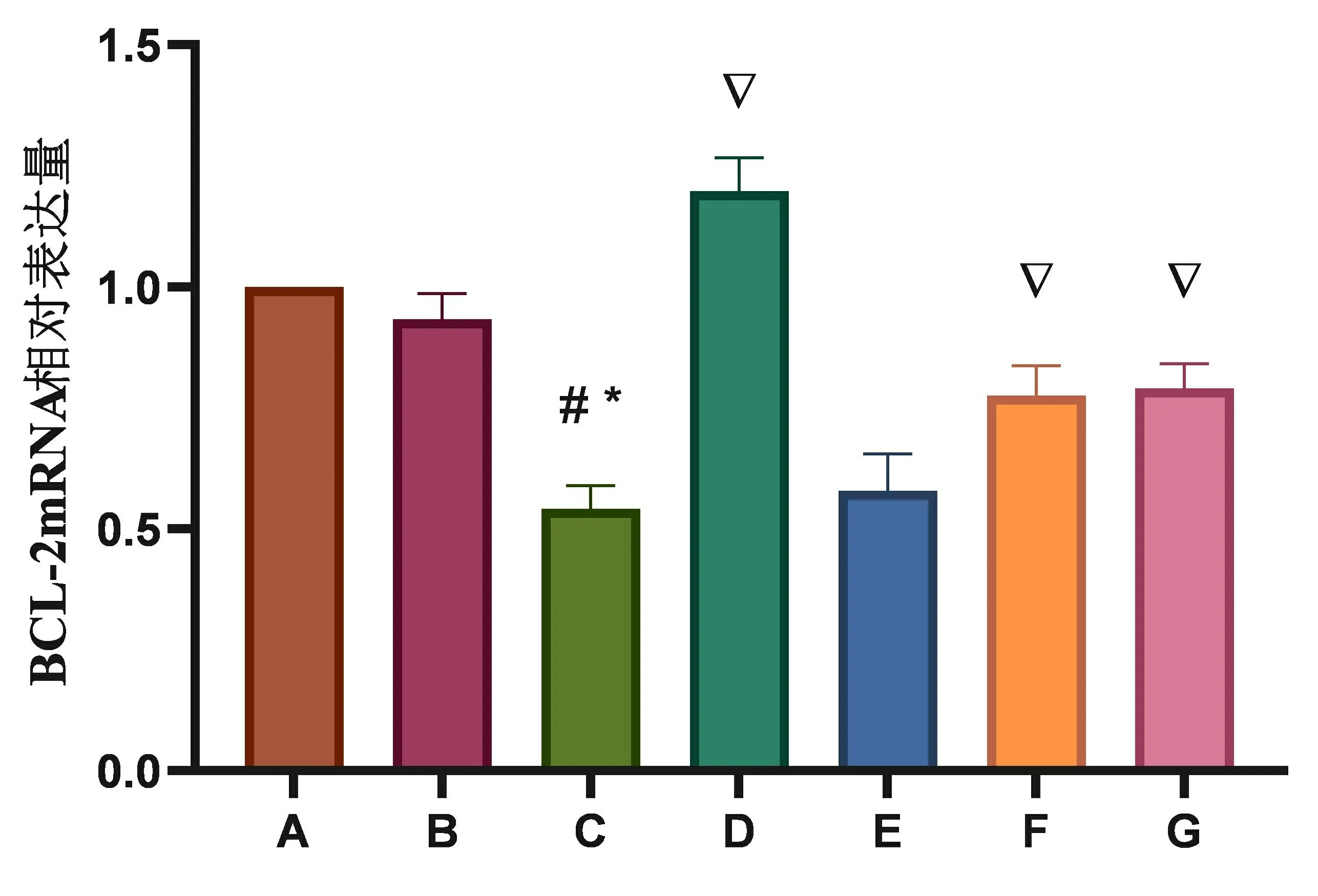
与正常组比较,假手术组Bcl-2 mRNA相对表达量无显著变化,阳性药组Bcl-2 mRNA相对表达量出现增加(P<0.01),模型组Bcl-2 mRNA相对表达量出现显著减少(P<0.01);与模型组比较,TSG低剂量组Bcl-2 mRNA相对表达量出现小幅增加,但不具统计学意义,阳性药组和TSG中、高剂量组Bcl-2 mRNA相对表达量出现不同程度的增加(P<0.01);与阳性药组比较,TSG各剂量组Bcl-2 mRNA相对表达量出现减少(P<0.01),见图4。
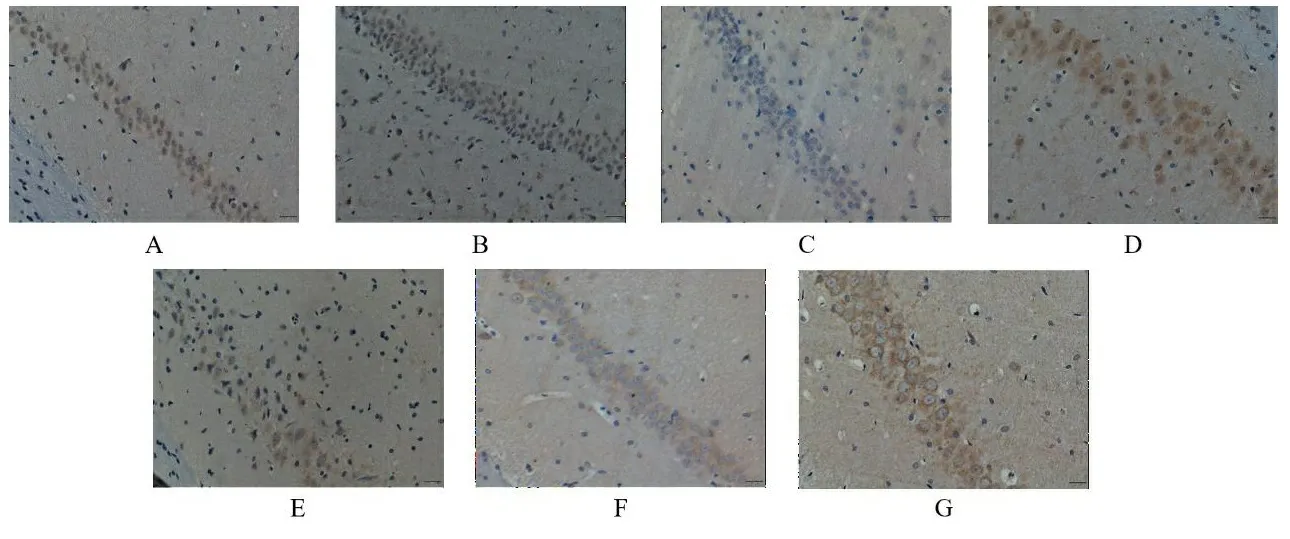
2.3TSG对各组大鼠脑组织中Bax、Bcl-2蛋白表达的影响 与正常组海马区和皮层区比较,假手术组和阳性药组Bax蛋白表达量无显著改变,模型组Bax蛋白表达量出现明显增加(P<0.01);与模型组海马区和皮层区比较,阳性药组和TSG各剂量组Bax蛋白表达量出现不同程度的减少(P<0.01);与阳性药组海马区和皮层区比较,TSG低剂量组Bax蛋白表达量出现增加,TSG中、高剂量组Bax蛋白表达量无明显改变。见表2、图5、图6。
注:A.正常组;B.假手术组;C.模型组;D.阳性药组;E.TSG低剂量组;F.TSG中剂量组;G.TSG高剂量组。与正常组比较,#P<0.01;与假手术组比较,*P<0.01;与模型组比较,▽P<0.01;正常组各指标mRNA表达量均为1。(n=5)。
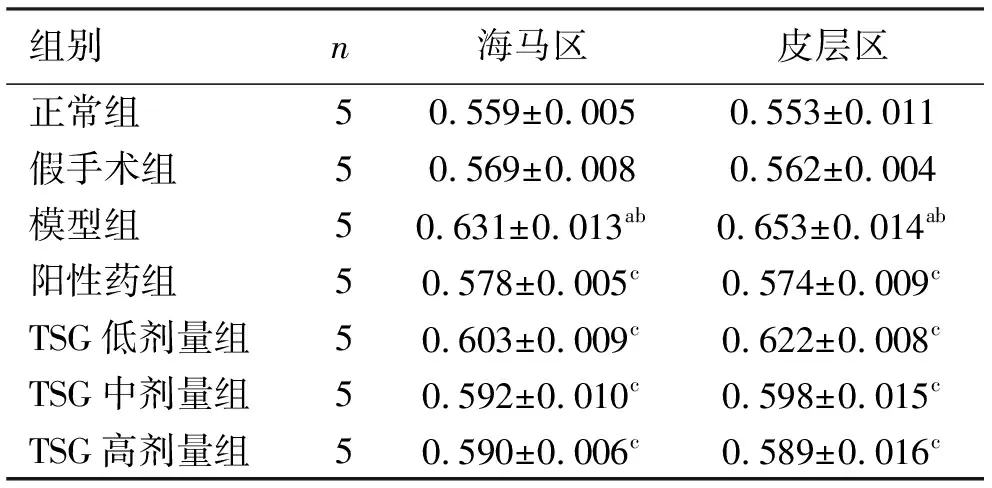
表2 TSG对各组大鼠脑组织中Bax、Bcl-2蛋白表达的影响结果
注:A.正常组;B.假手术组;C.模型组;D.阳性药组;E.TSG低剂量组;F.TSG中剂量组;G.TSG高剂量组。
注:A.正常组;B.假手术组;C.模型组;D.阳性药组;E.TSG低剂量组;F.TSG中剂量组;G.TSG高剂量组。
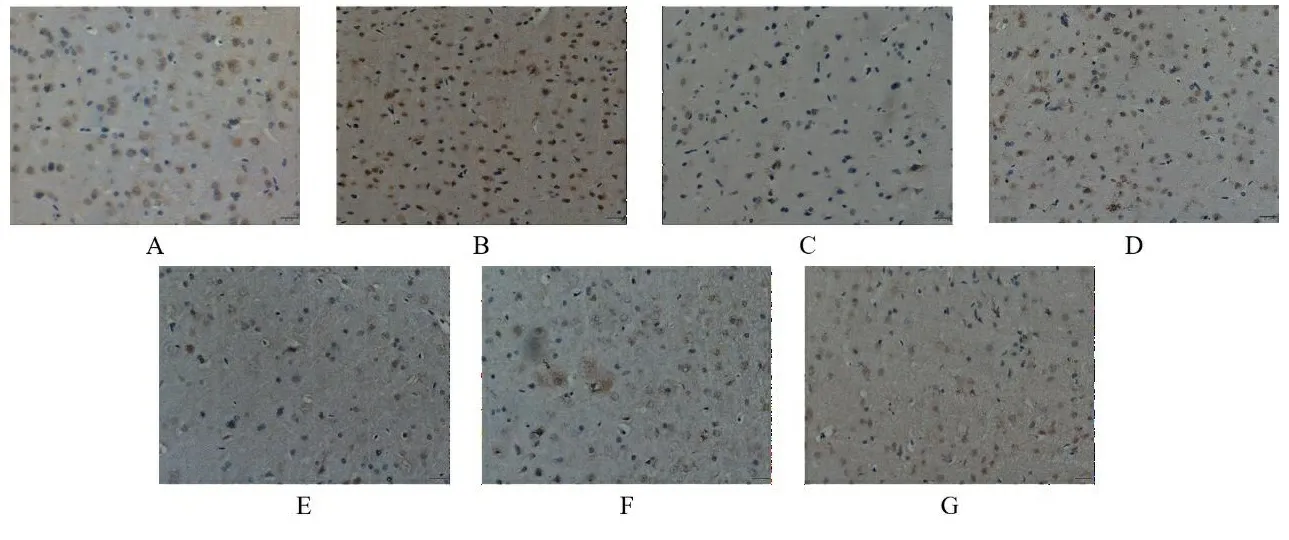
与正常组海马区和皮层区比较,假手术组和阳性药组Bcl-2蛋白表达量无显著改变,模型组Bcl-2蛋白表达量出现明显减少(P<0.01);与模型组皮层区比较,阳性药组和TSG各剂量组Bcl-2蛋白表达量出现不同程度的增加(P<0.01);与模型组海马区比较,阳性药组和TSG中、高剂量组Bcl-2蛋白表达量出现不同程度的增加(P<0.01);与阳性药组海马区和皮层区比较,TSG中、高剂量组Bax蛋白表达量无明显改变。见表3、图7、图8。
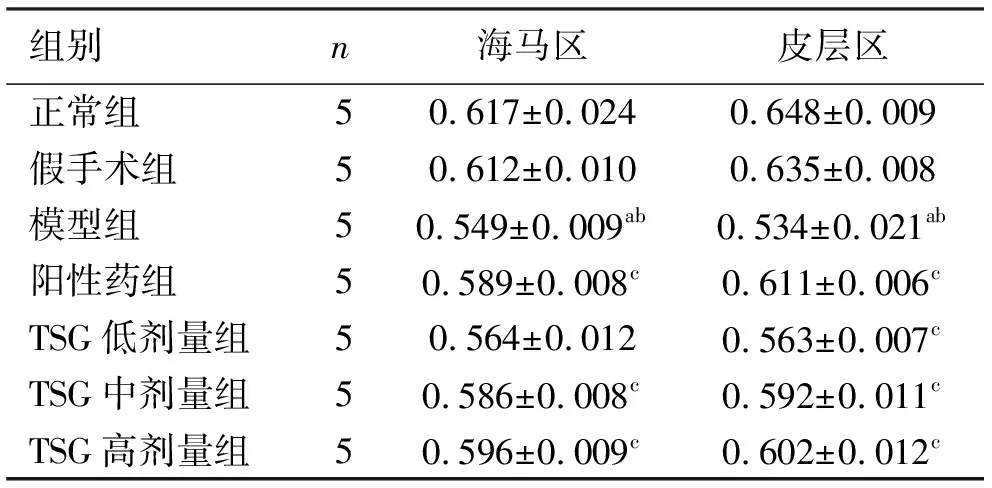
表3 各组大鼠脑组织中Bcl-2蛋白的表达结果
注:A.正常组;B.假手术组;C.模型组;D.阳性药组;E.TSG低剂量组;F.TSG中剂量组;G.TSG高剂量组。
注:A.正常组;B.假手术组;C.模型组;D.阳性药组;E.TSG低剂量组;F.TSG中剂量组;G.TSG高剂量组。
3 讨论
AD是一种多因素导致的疾病,其机制可能包含有Aβ沉积、Tau蛋白过度磷酸化、自由基损伤、胆碱缺乏和反应性突触丢失等,各种因素最终导致神经元细胞的减少或凋亡[14]。AD已成为老年人群体死亡的重要原因之一,随着我国人口老龄化的加重,预计到2050年,我国将有超过1 507万的痴呆症患者,这对个人和社会都是巨大的经济和医疗负担[15-16],寻找AD的有效治疗药物已成为全球共同关注的话题之一。Bcl-2蛋白家族是所有凋亡途径中的下游蛋白家族,包含有Bcl-2和Bax,抗凋亡因子Bcl-2和促凋亡因子Bax是一组凋亡稳态因子,Bcl-2是抑制细胞凋亡的关键因子,正常情况下它在脑组织中高度表达,保护神经元细胞,减少神经元细胞的凋亡[17-19]。Bcl-2基因在1984年首次被发现,来源于淋巴瘤中的一种癌基因,它在正常细胞的生长增殖中呈现高度表达状态,而在凋亡细胞中则几乎不表达[3-4]。Bax通过调节线粒体外膜的通透性,使细胞色素C由线粒体释放入胞质内,导致细胞内源性的凋亡。已有实验验证,中草药可以通过调节Bcl-2和Bax蛋白的表达量改善AD疾病的症状[20]。在本实验中,通过对TUNEL实验凋亡细胞的观察、实时荧光定量聚合酶链式反应法和免疫组织化学法的检测,与模型组比较,TSG各剂量组的神经元凋亡情况呈现不同程度的好转,Bax mRNA相对表达量和Bax蛋白的表达呈现不同程度降低,Bcl-2m RNA相对表达量和Bcl-2蛋白的表达呈现不同程度的升高,且表现出剂量依赖性,这些结果提示,TSG可以在一定程度上通过调节Bax和Bcl-2 mRNA的表达,改善神经元细胞凋亡的情况。
综上所述,TSG可以在一定程度上调节凋亡途径中的因子,减缓脑组织神经元细胞的凋亡,达到缓解AD症状的可能性。

