新型硝基咪唑衍生物的合成及抗菌活性研究
翟荣航 王合珍 张磊 徐应淑

收稿日期:2022-12-11
基金项目:遵义市科学技术局重点学科(创新团队)建设项目[(2020)293]。
作者简介:翟荣航,硕士研究生,主要从事药物化学研究。
*通讯作者:张磊,教授,主要从事药物化学研究。
徐应淑, 教授,主要从事药物化学研究。
摘要:通过药效团拼合原理,设计并合成了12个新型硝基咪唑—肉桂酸酯衍生物,其结构经1H-NMR、13C-NMR和HRMS-ESI确证。体外抗菌活性研究表明,大部分硝基咪唑—肉桂酸衍生物都具有较好的抗金黄色葡萄球菌活性,其中1-氯-3-(2-甲基-5-硝基-1H-咪唑-1-基)丙烷-2-基(E)-3-(3,4-二甲氧基苯基)丙烯酸酯的活性最强,对金黄色葡萄球菌的最低抑制浓度为1.22 μg/mL。
关键词:硝基咪唑;肉桂酸;衍生物;抗菌活性;合成
中图分类号:R978.1 文献标志码:A 文章编号:1001-8751(2023)06-0424-06
Synthesis and Antibacterial Activity of Novel Nitroimidazole Derivatives
Zhai Rong-hang, Wang He-zhen, Zhang Lei, Xu Ying-shu
(School of Pharmacy, Zunyi Medical University, Zunyi 563000)
Abstract: Based on the pharmacophore combination principle, twelve new nitroimidazole-cinnamic acid derivatives were developed and synthesized. 1H NMR, 13C NMR, and HRMS-ESI were used to confirm the structures of these derivatives.The in vitro antibacterial activity studies showed that most of the synthetic derivatives had good antibacterial activity against Staphylococcus aureus, and 1-chloro-3-(2-methyl-5-nitro-1H-imidazole-1-yl)propane-2-yl(E)-3-(3,4-dimethoxyphenyl)acrylate had the best activity against Staphylococcus aureus, with the minimum inhibitory concentration of 1.22 μg/mL.
Key words: nitroimidazole; cinnamic acid; derivatives; antibacterial activity; synthesis
近年来,由于抗生素的滥用和耐药菌的不断涌现,导致耐药菌在世界范围内广泛传播,使得细菌耐药性问题成为了极其重要的公共健康问题[1-4]。不幸的是,目前处于临床评价阶段可用于治疗耐药菌感染的药物屈指可数。因此,亟须研发新型抗菌药物以解决临床对抗耐药菌药物的需求。硝基咪唑类化合物作为人工合成化合物具有较好的抗菌作用,如已上市的甲硝唑、奥硝唑、替硝唑以及塞克硝唑等[5-6]。2011年,Mugunthan等[7]将硝基咪唑与半乳糖杂合,得到硝基咪唑—半乳糖杂合体,其具有较好的抗结核杆菌活性。近来有研究表明,四氢小檗碱衍生物具有较好的抗菌活性[8]。Ansari等[9]通过药效团拼合原理,将四氢小檗碱与硝基咪唑拼合,制备得到硝基咪唑—四氢小檗碱杂合体,抗菌活性表明大多数硝基咪唑—四氢小檗碱衍生物对铜绿假单胞菌具有较好的抗菌活性。因此,通过将具有抗菌活性的硝基咪唑类化合物与化合物药效团杂合制备得到新型硝基咪唑类化合物,已经成为抗菌药研究热点之一。
另一方面,肉桂酸是植物组织中苯丙氨酸脱去氨基后的代谢产物,具有毒性低、原料易得等特点,而且具有抗细菌[10]、抗真菌[11]、抗病毒[12]等多种生物活性。同时肉桂酸也是许多药物的关键中间体和药效活性分子,被广泛运用于医药,新型高效农药以及食品抗菌剂等领域。Narasimhan等[13]报道了肉桂酸酯化衍生物对金黄色葡萄球菌、枯草芽孢杆菌、大肠埃希菌和白色念珠菌进行最低抑菌浓度测试,结果表明大多数肉桂酸酯化衍生物具有较好的抗菌活性。
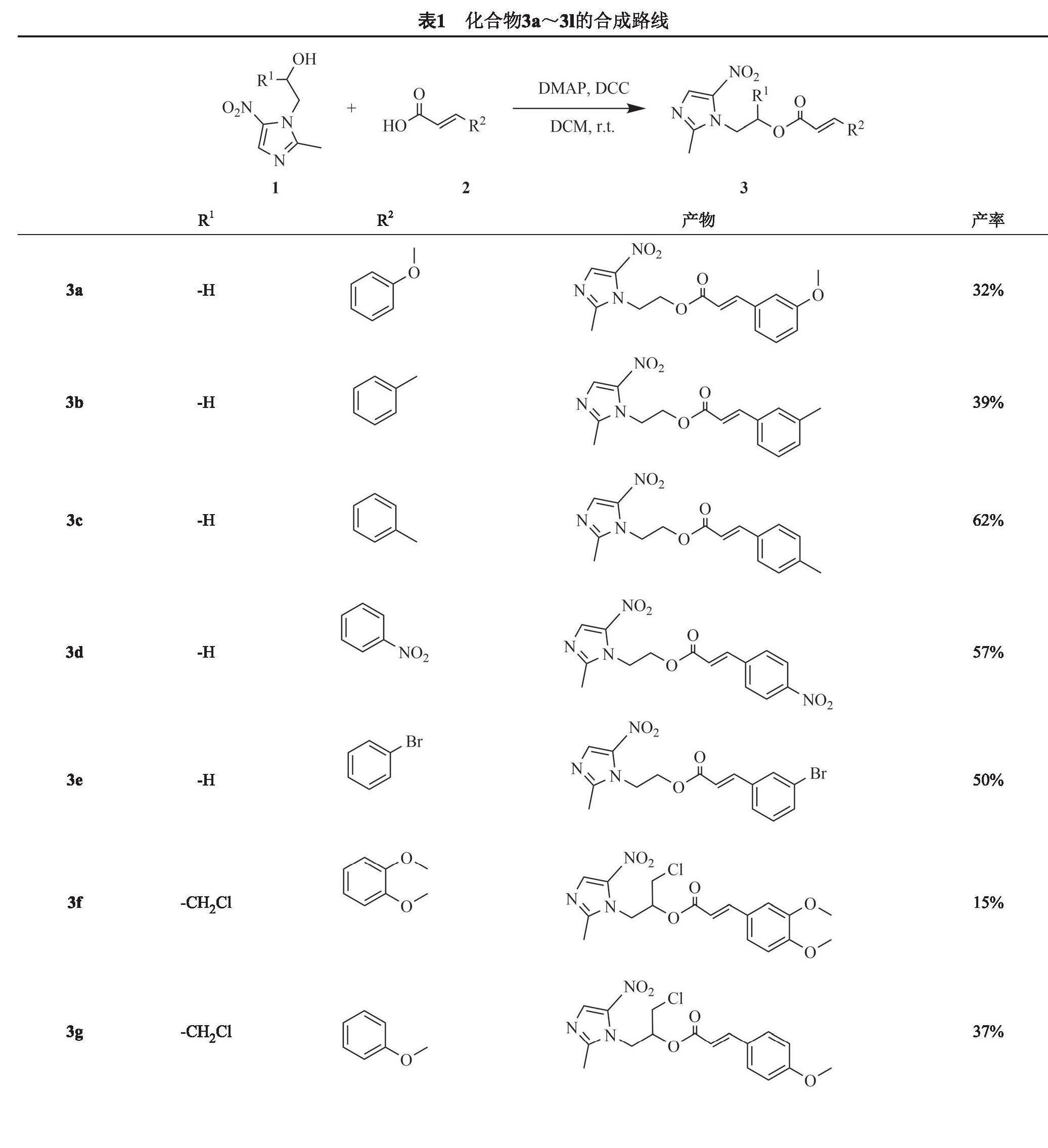
因此,本文基于药效团拼合原理,将具有抗菌活性的甲硝唑、奥硝唑、塞克硝唑等硝基咪唑类药物分子与具有抗菌活性的天然化合物肉桂酸拼合,构建新型硝基咪唑—肉桂酸衍生物。以硝基咪唑类药物分子(1)和肉桂酸(2)为原料,通过缩合剂N,N'-二环己基碳二亚胺(DCC)和4-二甲氨基吡啶(DMAP)催化的酯化反应,得到结构新颖的硝基咪唑—肉桂酸衍生物(3),其结构经1H-NMR、13C-NMR和HRMS-ESI表征确定,合成路线见表1。同时,在体外抗菌活性研究中,测试了硝基咪唑—肉桂酸衍生物对金黄色葡萄球菌和耐甲氧西林金黄色葡萄球菌的抑制活性。
1 实验部分
1.1 主要仪器与试剂
Agilent-400 M型核磁共振仪[氯仿(CDCl3) 为溶剂,四甲基硅烷(TMS)为内标,美国Agilent公司];Agilent Agilent Accurate-Mass-Q-TOF-MS652型质谱仪(HRMS-ESI,美国Agilent公司)。
金黄色葡萄球菌(Staphylococcus aureus ATCC)来源于遵义市产品质量检测院;耐甲氧西林金黄色葡萄球菌(MRSA ATCC)来源于北纳创联生物科技有限公司;3-二甲氨基丙基-3-乙基碳二亚胺盐酸盐(EDCI)、DCC[萨恩化学技术(上海)有限公司];甲硝唑、奥硝唑、塞克硝唑、3-甲氧基肉桂酸、3-甲基肉桂酸、对甲基肉桂酸、对硝基肉桂酸、3-溴肉桂酸、3,4-二甲氧基肉桂酸、4-甲氧基肉桂酸、3-硝基肉桂酸、4-溴肉桂酸、4-氟肉桂酸(韶远科技<上海>有限公司);其他试剂均为分析纯。
1.2 合成方法
1.2.1 目标化合物的合成
在25 mL茄形瓶中加入不同取代基的肉桂酸(1 mmol,1eq)、DMAP (0.1 eq)、DCC (1 eq)及10 mL二氯甲烷。室温搅拌反应15 min后,向反应瓶中加入硝基咪唑(1 eq),室温搅拌反应8 h。反应完成后,加入20 mL水终止反应,并用乙酸乙酯(10 mL×3)萃取。合并有机相,饱和食盐水洗涤(10 mL×2),真空干燥,所得粗品经硅胶柱层析制备纯品目标产物。合成的12个硝基咪—肉桂酸衍生物见表1。
(3a)2-(2-甲基-5-硝基-1H-咪唑-1-基)乙基(E)-3-(3-甲氧基苯基)丙烯酸酯:白色固体,产率32%,m.p. 75~77 ℃。1H-NMR (CDCl3, 400 MHz) δ: 7.96 (s, 1H), 7.60 (d, J = 16.0 Hz, 1H), 7.32-7.25 (m, 1H), 7.09 (d, J = 7.6 Hz, 1H), 7.00 (s, 1H), 6.94 (dd, J = 8.2, 1.9 Hz, 1H), 6.31 (d, J = 16.0 Hz, 1H), 4.64 (t, J = 5.1 Hz, 2H), 4.54 (t, J = 5.1 Hz, 2H), 3.82 (s, 3H), 2.51 (s, 3H); 13C-NMR (CDCl3, 100 MHz) δ: 166.18, 159.85, 150.88, 146.31, 138.51, 135.12, 133.18, 129.96, 120.91, 116.61, 113.12, 62.50, 55.32, 45.24, 14.37; HRMS-ESI (m/z):计算值C16H17N3O5 [M+H]+ 332.1240,测试值332.1239。
(3b)2-(2-甲基-5-硝基-1H-咪唑-1-基)乙基(E)-3-(3,4-二甲氧基苯基)丙烯酸酯:白色固体,产率39%,m.p. 100~101 ℃。1H-NMR (CDCl3, 400 MHz) δ: 7.93 (s, 1H), 7.58 (d, J = 15.9 Hz, 1H), 7.45 (d, J = 8.7 Hz, 2H), 6.90 (d, J = 8.8 Hz, 2H), 6.14 (s, 1H), 5.53 (dd, J = 9.2, 3.2 Hz, 1H), 4.79 (dd, J = 14.7, 2.8 Hz, 1H), 4.61-4.53 (m, 1H), 3.93-3.81 (m, 6H), 2.55 (s, 3H); 13C -NMR (CDCl3, 100 MHz) δ: 165.59, 161.89, 146.78, 133.22, 130.11, 126.42, 114.39, 113.05, 70.49, 55.40, 47.29, 43.71, 14.40; HRMS-ESI(m/z):计算值C16H17N3O4 [M+H]+ 362.1346,测试值362.1344。
(3c)2-(2-甲基-5-硝基-1H-咪唑-1-基)乙基(E)-3-(对甲苯基)丙烯酸酯:白色固体,产率 62%,m.p. 119~121 ℃。1H-NMR (CDCl3, 400 MHz) δ: 7.96 (s, 1H), 7.60 (d, J = 16.0 Hz, 1H), 7.38 (d, J = 7.8 Hz, 2H), 7.17 (d, J = 7.8 Hz, 2H), 6.27 (d, J = 15.9 Hz, 1H), 4.63 (t, J = 4.9 Hz, 2H), 4.52 (t, J = 5.0 Hz, 2H), 2.50 (s, 3H), 2.35 (s, 3H); 13C-NMR (CDCl3,100 MHz) δ: 166.45, 150.92, 146.43, 141.38, 133.23, 131.05, 129.69, 128.26, 115.22, 62.42, 45.29, 21.53, 14.41. HRMS-ESI(m/z):计算值C16H17N3O4 [M+H]+ 316.1291,测试值 316.1283。
(3d)2-(2-甲基-5-硝基-1H-咪唑-1-基)乙基(E)-3-(4-硝基苯基)丙烯酸酯:黄色固体,产率57%,m.p. 151~153 ℃。1H-NMR (CDCl3, 400 MHz) δ: 7.97 (s, 1H), 7.60 (d, J = 16.0 Hz, 1H), 7.49 (dd, J = 8.1, 5.6 Hz, 2H), 7.07 (t, J = 8.5 Hz, 2H), 6.25 (d, J = 16.0 Hz, 1H), 4.60 (dt, J = 44.2, 4.9 Hz, 4H), 2.51 (s, 3H); 13C-NMR (CDCl3, 100 MHz) δ 166.12, 165.38, 162.87, 145.08, 133.18, 130.12, 116.36, 115.95, 62.51, 45.20, 14.38; HRMS-ESI(m/z):计算值C15H14N4O6 [M+H]+ 320.1041,测试值320.1031。
(3e)2-(2-甲基-5-硝基-1H-咪唑-1-基)乙基(E)-3-(3-溴苯基)丙烯酸酯:白色固体,产率 50%,m.p. 91~93 ℃。1H-NMR (CDCl3, 400 MHz) δ: 7.95 (s, 1H), 7.62 (s, 1H), 7.57-7.47 (m, 2H), 7.39 (d, J = 7.7 Hz, 1H), 7.24 (s, 1H), 6.30 (d, J = 16.0 Hz, 1H), 4.63 (t, J = 5.1 Hz, 2H), 4.53 (t, J = 5.1 Hz, 2H), 2.50 (s, 3H); 13C -NMR (CDCl3, 100 MHz) δ: 165.78, 150.81, 144.66, 135.85, 133.54, 133.21, 130.81, 130.47, 126.90, 123.06, 117.86, 62.65, 45.16, 14.41. HRMS-ESI(m/z):计算值C15H14BrN3O4 [M+H]+ 380.0240,测试值380.0236。
(3f)1-氯-3-(2-甲基-5-硝基-1H-咪唑-1-基)丙烷-2-基(E)-3-(3,4-二甲氧基苯基)丙烯酸酯:白色固体,产率 15%,m.p. 150~152 ℃。1H-NMR (CDCl3, 400 MHz) δ: 7.93 (s, 1H), 7.56 (d, J = 15.9 Hz, 1H), 7.08 (dd, J = 8.3, 1.6 Hz, 1H), 6.99 (d, J = 1.6 Hz, 1H), 6.85 (d, J = 8.3 Hz, 1H), 6.15 (d, J = 15.9 Hz, 1H), 5.53 (dd, J = 9.3, 3.3 Hz, 1H), 4.78 (dd, J = 14.7, 2.7 Hz, 1H), 4.58 (dd, J = 14.6, 9.5 Hz, 1H), 3.91 (s, 6H), 3.87 (t, J = 4.5 Hz, 2H), 2.54 (s, 3H); 13C-NMR (CDCl3, 100 MHz) δ: 165.53, 151.61, 150.90, 149.15, 147.07 , 133.23, 126.61, 123.24, 113.20, 110.90, 109.57, 70.47, 55.94, 47.28 (s), 43.77, 14.44; HRMS-ESI(m/z):计算值C18H20ClN3O6 [M+H]+ 410.1113,测试值410.1112。
(3g)1-氯-3-( 2-甲基-5-硝基-1H-咪唑-1-基)-丙烷-2-基(E)-3-(4-甲氧基苯基)丙烯酸酯:白色固体,产率 37%,m.p. 112~114 ℃。1H-NMR (CDCl3, 400 MHz) δ: 7.94 (s, 1H), 7.58 (d, J = 15.9 Hz, 1H), 7.45 (d, J = 8.6 Hz, 2H), 6.90 (d, J = 8.6 Hz, 2H), 6.16 (d, J = 15.9 Hz, 1H), 5.57~5.49 (m, 1H), 4.83-4.75 (m, 1H), 4.59 (d, J = 9.5 Hz, 1H), 3.87 (dd, J = 5.9, 4.3 Hz, 2H), 3.84 (s, 3H), 2.55 (s, 3H), 1.71 (s, 1H); 13C NMR (CDCl3, 100 MHz) δ: 165.63, 161.87, 150.94, 146.81, 133.24, 130.13, 126.39, 114.37, 113.00, 70.49, 55.42, 47.31, 43.75, 14.43; HRMS-ESI(m/z):计算值C17H18ClN3O5 [M+H]+ 380.1007,测试值380.1005。
(3h)1-氯-3-(2-甲基-5-硝基-1H-咪唑-1-基)-丙烷-2-基(E)-3-(对甲苯基)丙烯酸酯:白色固体,产率 35%,m.p.124~125 ℃。1H-NMR (CDCl3, 400 MHz) δ: 7.91 (d, J = 7.8 Hz, 1H), 7.58 (d, J = 16.0 Hz, 1H), 7.37 (d, J = 8.0 Hz, 2H), 7.17 (d, J = 7.9 Hz, 2H), 6.23 (d, J = 15.9 Hz, 1H), 5.51 (dt, J = 13.1, 3.6 Hz, 1H), 4.77 (dd, J = 14.7, 2.7 Hz, 1H), 4.55 (dd, J = 14.6, 9.5 Hz, 1H), 3.91-3.79 (m, 2H), 2.53 (s, 3H), 2.34 (d, J = 9.3 Hz, 3H); 13C-NMR (CDCl3, 100 MHz) δ: 165.47, 150.93, 147.14, 141.57, 133.19, 130.94, 129.69, 128.34, 114.58, 70.59, 47.29, 43.69, 21.53, 14.39; HRMS-ESI(m/z):计算值C17H18ClN3O4 [M+H]+ 364.1058,测试值364.1055。
(3i)1-(2-甲基-5-硝基-1H-咪唑-1-基) -丙烷-2-基(E)-3-(3,4-二甲氧基苯基)丙烯酸酯:白色固体,产率82%,m.p. 116~118 ℃。1H-NMR (CDCl3, 400 MHz) δ: 7.91 (s, 1H), 7.51 (d, J = 15.9 Hz, 1H), 7.07 (dd, J = 8.3, 1.5 Hz, 1H), 6.99 (s, 1H), 6.85 (d, J = 8.3 Hz, 1H), 6.12 (d, J = 15.9 Hz, 1H), 5.37 (s, 1H), 4.63 (dd, J = 14.6, 2.8 Hz, 1H), 4.36 (d, J = 9.2 Hz, 1H), 4.12 (dt, J = 19.5, 6.2 Hz, 1H), 3.90 (s, 6H), 2.52 (s, 3H), 1.41 (d, J = 6.4 Hz, 3H); 13C-NMR (CDCl3, 100 MHz) δ: 165.88, 151.36, 150.61, 149.13, 145.93, 133.01, 126.85, 122.88, 114.28, 110.93, 109.59, 69.05, 55.91, 50.12, 33.91, 25.57, 24.92, 17.76, 14.49, 1.00; HRMS-ESI(m/z):计算值C17H19N3O6 [M+H]+ 376.1503,测试值376.1599。
(3j)1-(2-甲基-5-硝基-1H-咪唑-1-基)-丙烷-2-基(E)-3-(3-硝基苯基)丙烯酸酯:黄色固体,产率50%,m.p. 101~102 ℃。1H-NMR (CDCl3,400 MHz) δ: 7.92 (s, 1H), 7.53 (d, J = 15.9 Hz, 1H), 7.43 (d, J = 8.7 Hz, 2H), 6.89 (d, J = 8.7 Hz, 2H), 6.13 (d, J = 15.9 Hz, 1H), 5.41-5.32 (m, 1H), 4.64 (dd, J = 14.5, 2.8 Hz, 1H), 4.33 (dd, J = 14.5, 9.2 Hz, 1H), 3.82 (s, 3H), 2.52 (d, J = 4.7 Hz, 3H), 1.41 (d, J = 6.4 Hz, 3H); 13C-NMR (CDCl3, 100 MHz) δ: 165.98, 161.64, 150.65, 145.68, 133.02, 129.90, 126.62, 114.33, 114.07, 69.09, 55.38, 50.15, 17.75, 14.47; HRMS-ESI(m/z):计算值C15H14N4O6 [M+H]+ 346.1397,测试值346.1395。
(3k)1-(2-甲基-5-硝基-1H-咪唑-1-基)-丙烷-2-基(E)-3-(4-氯苯基)丙烯酸酯:白色固体,产率32%,m.p. 111~113 ℃。1H-NMR (CDCl3, 400 MHz) δ: 7.93 (s, 1H), 7.53 (d, J = 16.0 Hz, 1H), 7.42 (d, J = 8.5 Hz, 2H), 7.35 (d, J = 8.5 Hz, 2H), 6.24 (d, J = 16.0 Hz, 1H), 5.38 (s, 1H), 4.65 (dd, J = 14.6, 2.9 Hz, 1H), 4.37 (d, J = 9.3 Hz, 1H), 2.53 (s, 3H), 1.43 (d, J = 6.4 Hz, 3H). 13C-NMR (CDCl3, 100 MHz) δ: 165.42, 144.60, 136.61, 133.03, 132.35, 129.29, 117.22 (s), 69.45, 50.07, 17.74, 14.49; HRMS-ESI(m/z):计算值C15H14ClN3O4 [M+H]+ 350.0902,测试值350.0900。
(3l)1-(2-甲基-5-硝基-1H-咪唑-1-基)-丙烷-2-基(E)-3-(4-氟苯基)丙烯酸酯:白色固体,产率72%,m.p. 119~120 ℃。1H-NMR (CDCl3, 400 MHz) δ: 7.90 (s, 1H), 7.52 (d, J = 16.0 Hz, 1H), 7.49-7.41 (m, 2H), 7.05 (t, J = 8.6 Hz, 2H), 6.17 (d, J = 16.0 Hz, 1H), 5.36 (s, 1H), 4.62 (dd, J = 14.6, 2.9 Hz, 1H), 4.35 (d, J = 9.2 Hz, 1H), 2.51 (s, 3H), 1.40 (d, J =6.4 Hz, 3H); 13C-NMR (CDCl3, 100 MHz) δ: 165.41, 150.56, 144.70, 133.02, 130.10, 116.44, 116.21, 115.99, 69.33, 50.07, 33.92, 25.58, 24.92, 17.72, 14.47, 1.00; HRMS-ESI(m/z):计算值C15H14FN3O4 [M+H]+ 334.1197,测试值334.1195。
1.3 体外抗菌活性测定
抑菌活性测定实验采用微量液体稀释法,实验菌株为金黄色葡萄球菌和耐甲氧西林金黄色葡萄球菌。采用 96 孔板进行体外活性测试,培养温度为 37 ℃,24 h 后以最低抑菌浓度(MIC)值判断抑菌效果。
2 结果与讨论
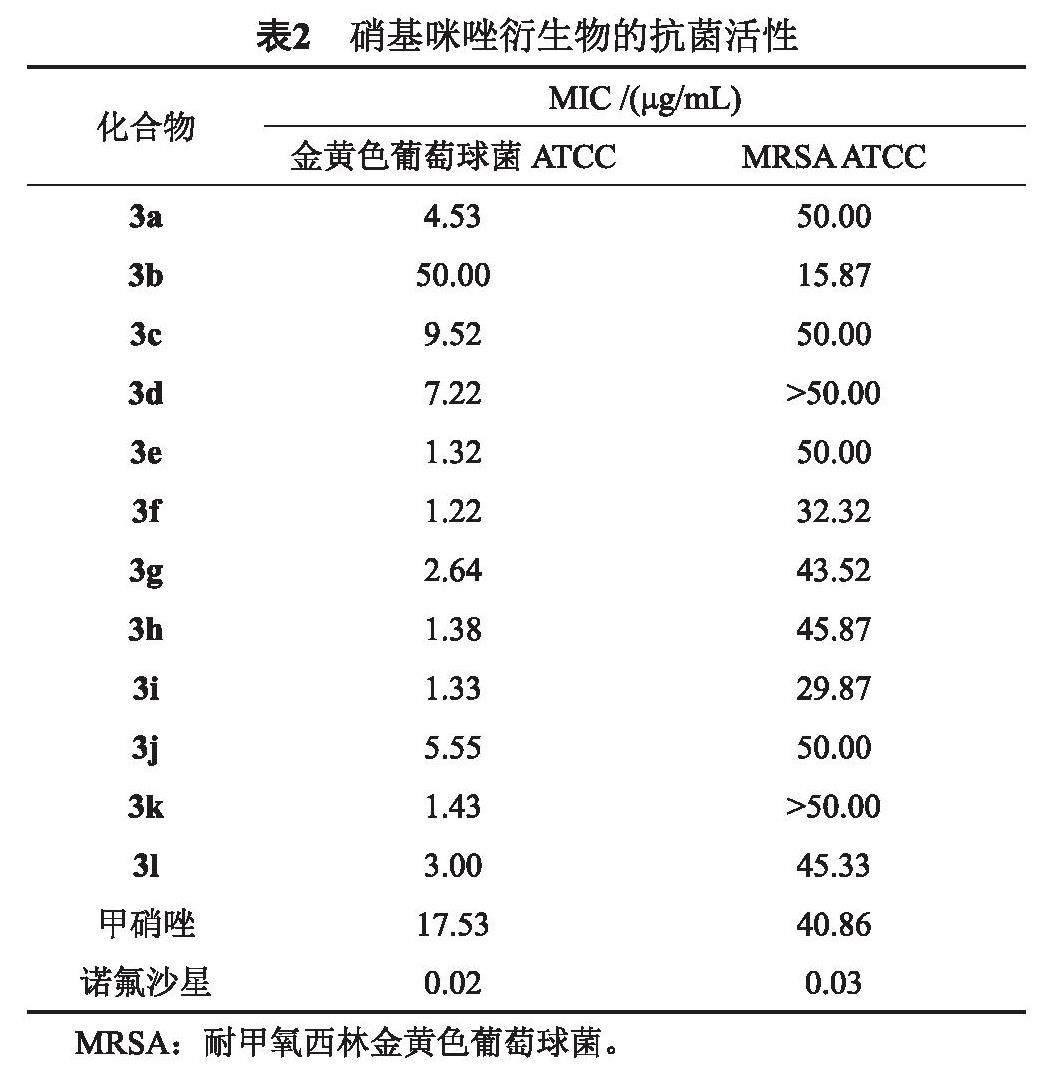
本实验研究分别测定了目标化合物3a~3l对金黄色葡萄球菌和耐甲氧西林金黄色葡萄球菌的抑菌活性,实验结果如表2所示。
由表2可知,大部分目标化合物对金黄色葡萄球菌均具有较好的抑制活性,硝基咪唑—肉桂酸衍生物中化合物3f对金黄色葡萄球菌具有较好的抑制活性,其MIC值为1.22 μg/mL,优于阳性对照药甲硝唑(17.53 μg/mL),但对耐甲氧西林金黄色葡萄球菌的抑制活性较弱。而化合物3b则对耐甲氧西林金黄色葡萄球菌有较好的抗菌活性,MIC值为15.87 μg/mL。构—效关系表明,硝基咪唑—肉桂酸衍生物的苯环上间位甲基的取代,对于提高其抗耐甲氧西林金黄色葡萄球菌具有重要的作用。
3 结论
本文通过药效团拼合原理,将药效团硝基咪唑与肉桂酸进行拼接,设计并合成了12个新型硝基咪唑衍生物。体外抗菌实验及构效关系表明,1-氯-3-(2-甲基-5-硝基-1H-咪唑-1-基)丙烷-2-基(E)-3-(3,4-二甲氧基苯基)丙烯酸酯具有较好的抗金黄色葡萄球菌活性,为今后抗菌药物的设计提供了一定的参考价值。
参 考 文 献
Nardulli P, Hall G G, Quarta A, et al. Antibiotic abuse and antimicrobial resistance in hospital environment: a retrospective observational comparative study[J]. Medicina, 2022, 58(9): 1257.
Jani K, Srivastava V, Sharma P, et al. Easy access to antibiotics; spread of antimicrobial resistance and implementation of one health approach in India[J]. J Epidemiol Glob Hea, 2021, 11(4): 444-452.
王灿灿, 王莹, 桑原锋, 等. 2017—2021年南阳市某医院胸、腹水培养的病原菌分布及耐药性分析[J]. 国外医药抗生素分册, 2023, 44(4): 252-255.
林晓晖, 陈东科, 简梦华, 等. 假肺炎链球菌的鉴定及耐药性分析[J]. 国外医药抗生素分册, 2023, 44(4): 276-280.
Sinha B, Bhattacharya M, Saha S, et al. Spectroscopic studies and antimicrobial evaluation of new mixed ligand Mn(II), Ni(II), Cu(II) complexes synthesized from an ionic liquid-supported schiff base and 1-Methyl Imidazole[J]. Polycycl Aromat Comp, 2022, 42(9): 5962-5974.
Chen J, Chen M, Cheng Y, et al. Structural optimization and antibacterial property of alkylimidazole salt/carboxymethyl cellulose/starch composite films[J]. Carbohyd Polym, 2022, 298: 120098.
Mugunthan G, Ramakrishna K, Sriram D, et al. Synthesis and screening of galactose-linked nitroimidazoles and triazoles against Mycobacterium tuberculosis[J]. Eur J Med Chem, 2011, 46(9): 4725-4732.
Zhang G B,Maddili S K, Tangadanchu V K, et al. Discovery of natural berberine-derived nitroimidazoles as potentially multi-targeting agents against drug-resistant Escherichia coli[J]. Sci China Chem, 2018, 61 (5): 557-568.
Ansari MF, Tan YM, Sun H, et al. Unique iminotetra hydroberberine-corbelled metronidazoles as potential membrane active broad-spectrum antibacterial agents[J]. Bioorg Med Chem Lett, 2022, 76: 129012.
Wang M, Yue L, Niazi S, et al. Synthesis and characterization of cinnamic acid conjugated N-(2-hydroxy)-propyl-3-trimethylammonium chitosan chloride derivatives: A hybrid flocculant with antibacterial activity[J]. Int J Biol Macromol, 2022, 206: 886-895.
Zanetti M, Scatolin M, Oltramari A R, et al. Antifungal activity and acute and repeated-dose toxicity study of geranyl cinnamate ester in mice[J]. Evid-Based Compl Alt, 2021, 2021, 3493625.
Husain I, Ahmad R, Siddiqui S, et al. Structural interactions of phytoconstituent (s) from cinnamon, bay leaf, oregano, and parsley with SARS-CoV-2 nucleocapsid protein: A comparative assessment for development of potential antiviral nutraceuticals[J]. J Food Biochem, 2022, 46(10): e14262.
Narasimhan B, Belsare D, Pharande D, et al. Esters, amides and substituted derivatives of cinnamic acid: synthesis, antimicrobial activity and QSAR investigations[J]. Eur J Med Chem, 2004, 39(10): 827-834.

