非酒精性脂肪性肝病诊断——病理的重要性
田爱平 杨永峰
摘要:对于非酒精性脂肪性肝病的明确诊断、单纯性脂肪肝(NAFL)及非酒精性脂肪性肝炎(NASH)区分及疾病严重程度的分级评分,均需依靠肝穿刺活检组织病理学评估完成,而临床上仍多依赖于血液学及影像学检测手段。尽管目前已有大量相关研究针对非酒精性脂肪性肝病的无创纤维化评估、疾病诊断模型出现,其敏感性及特异性仍有待提高。本文拟分别从NAFL及NASH的主要病理学特征、纤维化及分级分期评分方法,NASH肝硬化的病理学诊断等方面进行论述,以期提高临床医师对于该疾病组织学诊断的重视。
关键词:非酒精性脂肪性肝病; 病理学; 诊断, 鉴别
基金项目:甘肃省高等学校创新能力提升项目(2020B-016); 兰州大学第一医院院内基金(ldyyyn2018-62)
Diagnosis of nonalcoholic fatty liver disease: The importance of pathology
TIAN Aiping1, YANG Yongfeng2. (1. Department of Infectious Diseases, The First Hospital of Lanzhou University, Lanzhou 730000, China; 2. Department of Hepatology, Nanjing Hospital Affiliated to Nanjing University of Chinese Medicine &
Nanjing Second Hospital, Nanjing 210003, China)
Corresponding author:YANG Yongfeng,yyf1997@163.com (ORCID:0000-0002-3214-0038)
Abstract:
Histopathological evaluation based on liver biopsy is required to make a confirmed diagnosis of nonalcoholic fatty liver disease, differentiate nonalcoholic fatty liver (NAFL) from nonalcoholic steatohepatitis (NASH), and perform the grading and scoring of disease severity, while hematological and radiological examinations are often used in clinical practice. Although there have been a large number of studies on noninvasive models for fibrosis assessment and disease diagnosis in nonalcoholic fatty liver disease, the sensitivity and specificity of such models need to be further improved. This article reviews the main pathological features of NAFL and NASH, fibrosis and grading/staging/scoring systems, and the pathological diagnosis of NASH liver cirrhosis, in order to improve the awareness of the histological diagnosis of such disease among clinicians
Key words:
Non-alcoholic Fatty Liver Disease; Pathology; Diagnosis, Differential
Research funding:
The Project of Gansu Province Academic Innovative Promotion(2020B-016); The Inner Project of the 1st hospital of Lanzhou University(ldyyyn2018-62)
非酒精性脂肪性肝病(NAFLD)的疾病譜包括单纯性脂肪肝(NAFL)、非酒精性脂肪性肝炎(NASH)及其相关肝硬化和肝细胞癌。NAFLD是指通过影像学或组织学检查,发现患者肝脏中存在脂肪沉积,但没有出现继续性脂肪沉积的病因(如大量饮酒、药物或遗传性疾病),现已成为全球慢性肝病的主要原因[1]。NAFL在组织学上定义为存在≥5%的肝脂肪变性,但无肝细胞损伤的证据;NASH定义为存在≥5%的肝脂肪变性和伴有肝细胞损伤的炎症如气球样变、炎症反应,伴或不伴纤维化[2]。至少20%~30%的NAFLD患者发生NASH,可导致肝硬化和/或肝细胞癌[1-2]。对于NAFLD的诊断,尤其是NAFL和NASH的鉴别,目前没有可靠的临床或放射学检查,肝穿刺活检组织学检查仍然是诊断的金标准。本文就NAFLD的组织学检查作一综述,以期尽可能提高临床医师对于该疾病组织学诊断的重视。
1 NAFLD的基本病理特征
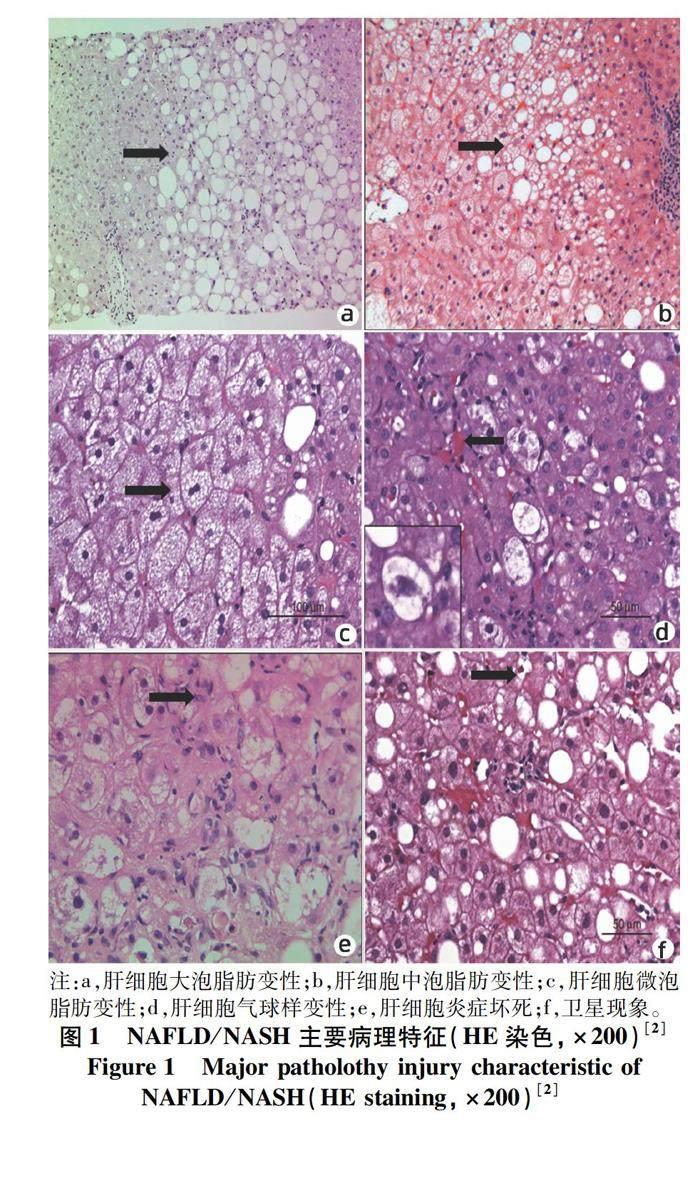
1.1 NAFL的主要病理特征 NAFL的主要病理特征为肝细胞大泡性脂肪变性[2](图1),表现为细胞浆内出现明显脂滴。脂滴的主要成分为甘油三酯[3]。在石蜡切片制片过程中会被脂溶剂二甲苯溶掉,故常规切片中仅留有圆形空泡。可用油红O染色或锇酸化的组织做HE染色或Masson三色染色来证明脂
变。正常情况下,肝脏内可有占肝脏总比<5%的脂肪变性,少量出现的肝细胞脂肪变性也可能是非特异性改变或见于衰老细胞。当脂滴占到50%以上时,大体上肝脏会表现为肝大,会有苍白或发黄、有油腻感。镜下脂变形式有大泡性脂肪变性、微泡性
脂肪变性。大泡性脂肪变性在肝细胞胞浆内出现的是单个脂滴或少数圆形脂滴或孤立的大脂滴,该脂滴将细胞核挤向细胞边缘(图1a),脂滴大者可达4~5个肝细胞大。NAFL大泡性脂肪变性轻者通常见于肝小叶腺泡3区,重者可达2区及汇管区周围区域[4](表1)。
大泡性脂肪变性的发生主要是由于肝细胞的脂质摄取、合成和输出间失衡。大泡性脂肪变性最常见于慢性酒精性及非酒精性脂肪性肝病、糖尿病、也可见于营养不良、饮食蛋白缺乏、慢性感染(如HCV)、消耗性疾病及一些遗传代谢性疾病(如Wilson病)等。若脂滴肉眼可见并较小,多被定义为小泡性脂肪变性[4]。大泡性脂肪变性与小泡性脂肪变性之间的界限不绝对,在一些情况下可能会混合出现在同一肝脏病变中。而有些情况下,大泡脂肪变性的脂滴呈现中等大小,被称之为中泡性脂肪变性(图1b)。有时可以见到小泡性脂肪变性向中泡性脂肪变性,中泡性脂肪变性向大泡性脂肪变性过渡的情况,或几种脂变并存。由于小泡、中泡及大泡性脂肪变性可能是个连续的过程,故上述脂变情况同时存在时多考虑病变在进展过程中。
微泡性脂肪变性的特点是肝细胞胞浆内挤满了微小脂泡,脂泡大小较均一,直径1~3 μm,细胞核仍位于细胞中央(圖1c),肝小叶结构基本不受影响,通常需特殊脂肪染色来证实。微泡性脂肪变性主要由于线粒体受损,脂肪酸在线粒体内β氧化受到影响,酯化形成甘油三酯增加,从而形成微小脂滴在胞浆内蓄积[5]。同时线粒体损伤严重,生化氧化障碍常导致代谢严重紊乱,引起急性肝衰竭,故广泛微泡性脂肪变性是肝病重症化的标志之一。
1.2 NASH主要病理特征 NASH主要病变除了大泡性脂肪变性,还需共存肝细胞气球样变性及一定程度的炎症[6],以点灶坏死多见。气球样变性的存在为诊断脂肪性肝炎的必备条件之一(图1d)。通常表现为肝细胞体积增大,并可能扩大至圆形,胞质明显淡染,在电镜下可见到胞浆基质疏松,线粒体肿胀,内质网扩张,断裂呈丝状,或空泡状,胞核浓染,胞膜加厚等现象。气球样变性不仅仅出现在脂肪性肝炎,也可出现在其他任何一种肝脏病变中。脂肪性肝炎中的气球样变性肝细胞细胞骨架被破坏,可应用CK8/18免疫组化染色来鉴别脂肪性肝炎与其他肝病损伤导致的气球样变性[3]。
NASH气球样变性可能是肝细胞进展为溶解性坏死的主要成因。然而在趋于肝细胞坏死的过程中可能需要很长的时间。凋亡也是NASH肝细胞死亡的原因之一。在NASH中融合坏死与桥接坏死较为少见,但在酒精性脂肪性肝炎中多见。在大多数脂肪性肝炎中,小叶炎症程度较轻,或最多至中度,肝细胞坏死通常与淋巴细胞、吞噬细胞、中性粒细胞浸润等同时出现(图1e)。酒精性脂肪性肝炎中的中性粒细胞聚集数量往往多于NASH,中性粒细胞通常出现在有或无mallory小体的气球样变性肝细胞周围,被称作“卫星现象(satellitosis)”(图1f),出现这种现象多可能是由于脂滴所引发的细胞因子趋化现象,也可能与细胞因子如IL-8的出现相关[7-8]。NASH的炎症在肝小叶及汇管区周围均可能出现,而酒精性脂肪性肝炎的炎症以汇管区周围分布多见。
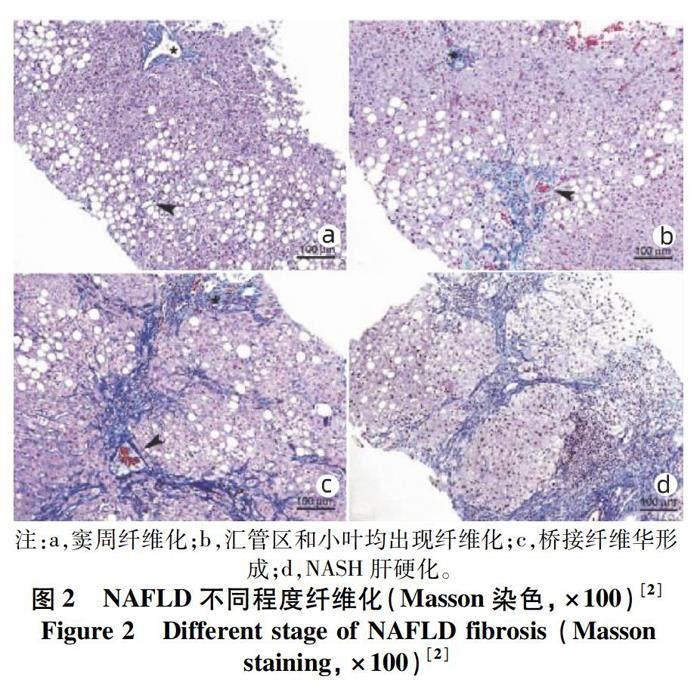
1.3 NAFLD纤维化 成年NAFLD,在肝细胞脂肪变性伴或不伴有炎症背景下,偶尔会见到轻度小叶腺泡3区窦周纤维化或汇管区纤维化[9]。出现纤维化时,考虑NAFLD可能在向NASH进一步发展。通常NAFLD不伴有纤维化[5-6]。在NASH中往往可见到不同程度纤维化。纤维化即指异常胶原沉积,目前对于NASH的诊断并非必要条件。但NASH疾病进展的早期即可见到纤维化。非硬化阶段的脂肪性肝炎(不论是酒精性或非酒精性),其纤维化分布,与先于汇管区发展起始的其他病因所致纤维化不同,其胶原沉积往往从腺泡3区窦周开始(图2)[10]。纤维化胶原沉积可应用特殊染色如Masson、van Gieson、网银、天狼星红来确认,不同染色可标志出不同种类胶原沉积。当纤维化明显时,HE染色即可辨认出嗜伊红条带的窦周纤维化,而当纤维化程度较轻时,则需要上述特殊染色来分辨。腺泡3区纤维化条索往往伴随肝细胞气球样变性、脂肪变性及一定程度炎症细胞浸润。当病情逐步进展,可于汇管区见到纤维增生,小叶间动脉可见纤维沉积增多,随着汇管区逐步扩大,小叶间质结构重塑,汇管区间纤维间隔形成进一步将肝细胞包绕并伸入小叶,桥接纤维(中央静脉-中央静脉,汇管区-汇管区,中央静脉-汇管区)继续发展,最终肝硬化形成[9]。
研究[4,11]显示纤维化程度是影响NAFLD预后的最主要因素,纤维化程度越重,则死亡风险越高。经单因素分析发现,NAFLD出现汇管区炎症和肝细胞气球样变性与肝移植术后相关不良事件有关,该结果也进一步提示这两个因素可能与NAFLD短期疾病进展的预后相关[12]。
2 NAFLD与NASH分级分期评分系统
较好的慢性肝炎分级分期评分系统、多位病理医生阅片、高质量的肝穿刺组织共同决定了NAFLD评分结果的一致性。而NAFLD病变程度的评定标准与慢性病毒性肝炎、自身免疫性肝炎及其他病因肝病不同[13]。1999年,Brunt等[5]首次提出基于51份成人NASH肝脏标本的评分系统。该方法同时囊括了NAFLD炎症及纤维化的半定量评分。炎症分级分别基于脂肪变性、肝细胞气球样变性、小叶炎症及汇管区炎症几个方面,共有1~3级。该评分系统重点强调炎症程度,对于脂肪变性比例较大而不伴有明显炎症的患者,评分分级可能较低,此外,Mallory-小体的存在也没有纳入评分判定标准内。故在病理报告中,不能仅依据评分系统给出评分结果,而应将每一个病理特征的程度客观一一描述。
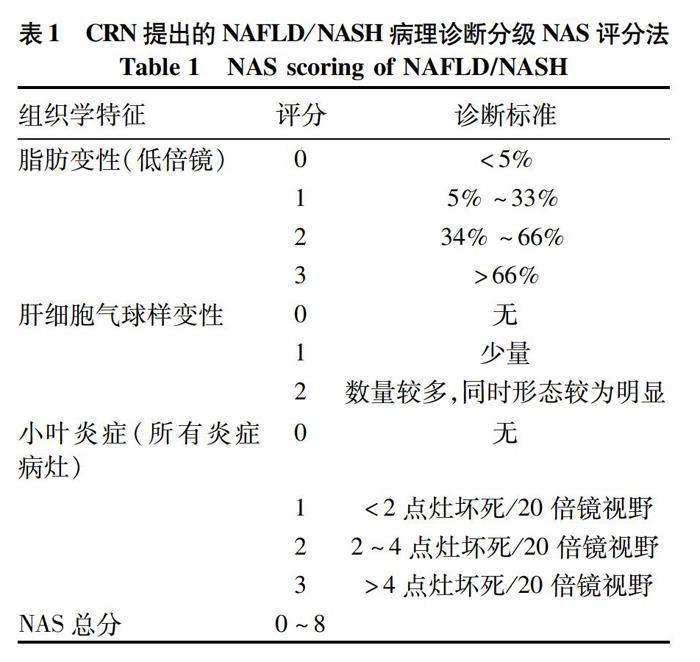
在2005年,NIDDK-NASH临床研究小组(CRN)提出了针对成人及儿童的优化NAFLD分级评分标准[14](表1、2)。因其将5%脂肪变性作为脂肪程度最低线,故该标准包含了更早期的NAFLD。纤维化分期也在Brunt标准上进行了优化,具体细化了纤维化程度,表现在HE可分辨为1b,需特殊染色分辨者为1a,仅汇管区可见者为1c。实际应用中,病理医生发现脂肪变性、小叶炎症、肝细胞气球样变性和嗜酸性小体均是NAFLD与NASH划分的独立因素。基于上述发现,NAS评分法包括:脂肪变性评分0~3分,小叶炎症0~3分,气球样变性0~2分,共0~8分。总分<3或≥5时,NAS评分能够较好地诊断“不考虑NASH”及“确定为NASH”[14]。研究发现NAS评分在≥5时的敏感度和特异度分别为57%和95%。NAS评分目前已被广泛应用于NAFLD及NASH分级当中。
2012年,欧洲脂肪肝研究小组基于脂肪变性程度(S)、炎症程度(A)及纤维化程度(F)三者半定量基础上建立了SAF评分法[15](表3)。因脂肪变性不是NAFLD进展的因素,故脂肪变性程度不算在炎症活动度中,炎症活动仅为小叶炎症和肝细胞气球样变性的总和。纤维化分为5级,于CRN提出的NAFLD纤维化评分相似。SAF评分中,当A<2和/或F<2时视为“轻度NAFLD”,当A≥2和/或F≥2则视为“严重NAFLD”。综上可见SAF评分主要取决于肝细胞气球样变性、小叶炎症及纤维化三个方面,均与NAFLD预后直接相关。
儿童NAFLD评分系统在肝细胞脂肪变性比例、气球样变性及小叶炎症程度的基础上,加入了汇管区炎症的半定量评分,该系统能够较为可观的反应儿童NAFLD及NASH严重程度,但在实际临床应用中仍需被反复验证[16]。
3 NASH肝硬化
NASH进展至肝硬化阶段,可能不再见到窦周纤维化。同样的,NAFLD及NASH的特征性改变即肝细胞脂肪变性可能消失殆尽,当可以看到脂肪变性时,可明确诊断脂肪性肝炎所致肝硬化。研究发现当应用NAS评分>4分时,考虑肝硬化由NASH引起,而当NASH特征性病理改变不再出现,或应用NAS评分<4分时,对于肝硬化是否与NASH直接相关无法直接明确。一定比例的隐源性肝硬化在临床究因溯源时,最终诊断被NASH相关肝硬化,这部分人群由于缺乏病理典型特征,给临床病因诊断带来较大难度[17]。为此,NASH肝硬化诊断相关定义工作小组共识将NASH肝硬化定性区分为“确定”“很可能”“可能”三个等级[18](表4),当病理诊断依据不足时,若患者合并代谢相关疾病如:2型糖尿病、肥胖、高脂血症等疾病时,将加强NASH病因诊断的权重。在“确定”诊断中,“a”对NASH导致肝硬化诊断的确定性最强,“b”及“c”的诊断确定性稍差。从表中也可以看出,尽可能详细追问患者在肝穿刺之前的合并疾病病史对于肝硬化病因的诊断会更加全面。然而部分肝硬化患者不仅缺乏NASH病理学特征,其临床特征也很难确定或不典型,如既往肥胖的患者可能因糖尿病或肝硬化营养不良而变瘦;既往脂代谢是否异常可能无法明确;肝脏脂肪含量减少,应用B超、CT或MRI等无创检查亦无脂肪肝表现。因此在诊断隐源性肝硬化病因诊断的过程中,需详细追问患者20年内体质量变化;若既往有糖尿病、高血压、脂代谢异常等疾病2项以上,患病>5年以上;IgA升高则更加支持NASH肝硬化。其中需始终警惕的是,进展至肝硬化阶段,未见明显脂肪变性不能够作为排除NASH肝硬化的证据。
4 NAFLD合并其他疾病及与其他肝病的鉴别
NAFLD病理诊断一方面用于评估病情程度,另一方面用于排除或鉴别其他病因如酒精性肝病、药物性肝损伤、慢性丙型肝炎、遗传代谢性疾病、营养障碍、乳糜泻及其他恶性疾病。临床中,最常见需与酒精性脂肪性肝病鉴别,后者通过病史结合病理特征提供可基本明确。而NAFLD与其他疾病合并或鉴别需要根据具体疾病的主要病理学特征来判断。
对于有CHB基礎疾病的患者,在病毒量持续低于检测下限时,仍长期转氨酶升高,或未经治疗的CHB患者,出现转氨酶升高(以ALT为例),具体主导损伤病因是否是CHB,经肝穿刺活检可基本确定。对于CHB所致转氨酶升高或肝脏炎症,通常无论炎症或纤维化,均多以汇管区分布为主,而NASH除了有特征性病理改变外,炎症及纤维化均多见于腺泡3区或窦周纤维化为主。同样,对于NASH合并其他疾病,区分思路与合并CHB时相似。
5 NAFLD无创诊断
肝活检的有创性和相对较高的费用、等待活检结果等因素是其在临床应用中受到一定限制,因此需要更敏感和特异的NASH无创诊断方法[19]。有效评估肝纤维化程度及必要时动态监测纤维化进展的手段逐年增加[20]。
MRI/MRE为基础的影像学手段在评估NAFLD/NASH中的优越性远远高于其他影像学手段[21]。质子密度脂肪分数(PDFF)对于脂肪变性程度预测较超声诊断更为精确[22],同时可用于脂肪变化的动态评估,然而PDFF对于NASH炎症程度、气球样变性程度并无线性关系[23],为解决这一矛盾,无创诊断模型MAST评分被提出[24],即PDFF加上AST形成MAST评分,结果提示对于NAS评分≥4,纤维化F≥2的NASH患者疾病进展最为严重,而MRI-PDFF和MRI肝脏弹性成像对于肝纤维化程度与组织学纤维化分期较为匹配,MAST评分相较于FIB-4,FAST评分等均能更好的评估患者炎症及纤维化程度。但仍无法明确区分NAFL和NASH,故无创诊断手段仍存在很大局限性。鉴于以上原因,FDA建议NASH新药研发2期和3期临床试验需以组织学作为研究终点[25]。
6 小结
综上所述,组织病理学对NAFLD的分级分期诊断至关重要,在准确诊断轻度脂肪变性、精确区分NAFL和NASH、鉴别脂肪变性的病因方面具有不可替代性。有学者建议以脂肪变性为主要损伤模式的肝组织,病理报告需包括下列内容:(1)病理描述部分需评估脂肪变肝损伤的模式,及有无合并其他肝损伤;(2)病理诊断部分继续列出损伤的总体模式,还需描述主要病变的严重程度;(3)如能从临床资料中得出脂肪变病因,需一并诊断;(4)如能从组织学特征或临床资料中分析出合并的其他病因肝损伤,需一并诊断;(5)半定量评分作为可选项,在病理医生和临床医生取得共识后可列出。临床医生需准确理解NAFLD各阶段的组织学特征,方能更好的诊治NAFLD。
利益冲突声明:所有作者均声明不存在利益冲突。
作者贡献声明:田爱平负责撰写文章;杨永峰负责修改和审核文章。
参考文献:
[1]
LOOMBA R, ADAMS LA. The 20% rule of NASH progression: The natural history of advanced fibrosis and cirrhosis caused by NASH[J]. Hepatology, 2019, 70(6): 1885-1888. DOI: 10.1002/hep.30946.
[2]SAXENA R. Practical hepatic pathology, a diagnostic approach[M]. 2nd edition. Philadelphia, PA : Elsevier, 2017.
[3]
BRIL F, BARB D, PORTILLO-SANCHEZ P, et al. Metabolic and histological implications of intrahepatic triglyceride content in nonalcoholic fatty liver disease[J]. Hepatology, 2017, 65(4): 1132-1144. DOI: 10.1002/hep.28985.
[4]
POUWELS S, SAKRAN N, GRAHAM Y, et al. Non-alcoholic fatty liver disease (NAFLD): a review of pathophysiology, clinical management and effects of weight loss[J]. BMC Endocr Disord, 2022, 22(1): 63. DOI: 10.1186/s12902-022-00980-1.
[5]
BRUNT EM, KLEINER DE, CARPENTER DH, et al. NAFLD: Reporting histologic findings in clinical practice[J]. Hepatology, 2021, 73(5): 2028-2038. DOI: 10.1002/hep.31599.
[6]BRUNT EM. Pathology of fatty liver disease[J]. Mod Pathol, 2007, 20 (Suppl 1): S40-S48.
[7]FELDSTEIN AE, WIECKOWSKA A, LOPEZ AR, et al. Cytokeratin-18 fragment levels as noninvasive biomarkers for nonalcoholic steatohepatitis: a multicenter validation study[J]. Hepatology, 2009, 50(4): 1072-1078. DOI: 10.1002/hep.23050.
[8]DUAN Y, PAN X, LUO J, et al. Association of inflammatory cytokines with non-alcoholic fatty liver disease[J]. Front Immunol, 2022, 13: 880298. DOI: 10.3389/fimmu.2022.880298.
[9]SANYAL AJ, HARRISON SA, RATZIU V, et al. The natural history of advanced fibrosis due to nonalcoholic steatohepatitis: data from the simtuzumab trials[J]. Hepatology, 2019, 70(6): 1913-1927. DOI: 10.1002/hep.30664.
[10]BRUNT EM. Grading and staging the histopathological lesions of chronic hepatitis: the Knodell histology activity index and beyond[J]. Hepatology, 2000, 31(1): 241-246. DOI: 10.1002/hep.510310136.
[11]LUO J, LIU LW, LIU JM, et al. Comparative study of clinicopathological features, and risk factors of advanced fibrosis between genders with non-alcoholic fatty liver disease[J]. Chin J Hepatol, 2021, 29(4): 356-361. DOI: 10.3760/cma.j.cn501113-20200203-00027.
羅娟, 刘立伟, 刘纪民, 等. 非酒精性脂肪性肝病临床和病理特点及进展期纤维化危险因素性别差异的对比研究[J]. 中华肝脏病杂志, 2021, 29(4): 356-361. DOI: 10.3760/cma.j.cn501113-20200203-00027.
[12]
ANGULO P, KLEINER DE, DAM-LARSEN S, et al. Liver fibrosis, but no other histologic features, is associated with long-term outcomes of patients with nonalcoholic fatty liver disease[J]. Gastroenterology, 2015, 149(2): 389-397. e10. DOI: 10.1053/j.gastro.2015.04.043.
[13]
TIAN AP, YANG YF. A comparative analysis of pathological grading and staging systems for chronic hepatitis[J]. J Clin Hepatol, 2018, 34(11): 2271-2277. DOI: 10.3969/j.issn.1001-5256.2018.11.002.
田爱平, 杨永峰. 慢性肝炎病理学分级分期评分系统比较[J]. 临床肝胆病杂志, 2018, 34(11): 2271-2277. DOI: 10.3969/j.issn.1001-5256.2018.11.002.
[14]KLEINER DE, BRUNT EM, van NATTA M, et al. Design and validation of a histological scoring system for nonalcoholic fatty liver disease[J]. Hepatology, 2005, 41(6): 1313-1321. DOI: 10.1002/hep.20701.
[15]BEDOSSA P, POITOU C, VEYRIE N, et al. Histopathological algorithm and scoring system for evaluation of liver lesions in morbidly obese patients[J]. Hepatology, 2012, 56(5): 1751-1759. DOI: 10.1002/hep.25889.
[16]ALKHOURI N, de VITO R, ALISI A, et al. Development and validation of a new histological score for pediatric non-alcoholic fatty liver disease[J]. J Hepatol, 2012, 57(6): 1312-1318. DOI: 10.1016/j.jhep.2012.07.027.
[17]CLEVELAND E, BANDY A, VANWAGNER LB. Diagnostic challenges of nonalcoholic fatty liver disease/nonalcoholic steatohepatitis[J]. Clin Liver Dis (Hoboken), 2018, 11(4): 98-104. DOI: 10.1002/cld.716.
[18]LONGERICH T, SCHIRMACHER P. Determining the reliability of liver biopsies in NASH clinical studies[J]. Nat Rev Gastroenterol Hepatol, 2020, 17(11): 653-654. DOI: 10.1038/s41575-020-00363-8.
[19]CASTERA L, FRIEDRICH-RUST M, LOOMBA R. Noninvasive assessment of liver disease in patients with nonalcoholic fatty liver disease[J]. Gastroenterology, 2019, 156(5): 1264-1281.e4. DOI: 10.1053/j.gastro.2018.12.036.
[20]KWOK R, TSE YK, WONG GL, et al. Systematic review with meta-analysis: non-invasive assessment of non-alcoholic fatty liver disease-the role of transient elastography and plasma cytokeratin-18 fragments[J]. Aliment Pharmacol Ther, 2014, 39(3): 254-269. DOI: 10.1111/apt.12569.
[21]MIDDLETON MS, HEBA ER, HOOKER CA, et al. Agreement between magnetic resonance imaging proton density fat fraction measurements and pathologist-assigned steatosis grades of liver biopsies from adults with nonalcoholic steatohepatitis[J]. Gastroenterology, 2017, 153(3): 753-761. DOI: 10.1053/j.gastro.2017.06.005.
[22]TAOULI B, SERFATY L. Magnetic resonance imaging/elastography is superior to transient elastography for detection of liver fibrosis and fat in nonalcoholic fatty liver disease[J]. Gastroenterology, 2016, 150(3): 553-556. DOI: 10.1053/j.gastro.2016.01.017.
[23]WILDMAN-TOBRINER B, MIDDLETON MM, MOYLAN CA, et al. Association between magnetic resonance imaging-proton density fat fraction and liver histology features in patients with nonalcoholic fatty liver disease or nonalcoholic steatohepatitis[J]. Gastroenterology, 2018, 155(5): 1428-1435.e2. DOI: 10.1053/j.gastro.2018.07.018.
[24]NOUREDDIN M, TRUONG E, GORNBEIN JA, et al. MRI-based (MAST) score accurately identifies patients with NASH and significant fibrosis[J]. J Hepatol, 2022, 76(4): 781-787. DOI: 10.1016/j.jhep.2021.11.012.
[25]RINELLA ME, TACKE F, SANYAL AJ, et al. Report on the AASLD/EASL joint workshop on clinical trial endpoints in NAFLD[J]. J Hepatol, 2019, 71(4): 823-833. DOI: 10.1016/j.jhep.2019.04.019.
收稿日期:
2022-01-15;錄用日期:2022-02-20
本文编辑:林姣

