原发性胆汁性胆管炎诊治——病理是否必需?
刘红丽 杨永峰

摘要:原发性胆汁性胆管炎(PBC)是一种慢性肝内胆汁淤积性疾病。本文归纳了PBC病理组织学特征、病理检查在PBC的诊断和治疗中的作用,对病理在分期预后、不典型PBC的诊断、重叠综合征诊断、熊去氧胆酸UDCA应答不佳原因分析和鉴别疾病或排除其他合并疾病等中的作用进行综述,提高临床医生对病理检查对PBC作用的认识。
关键词:肝硬化, 胆汁性; 病理学, 临床; 诊断; 治疗学
基金项目:国家自然科学基金(81970454)
Diagnosis and treatment of primary biliary cholangitis: Is pathology necessary?
LIU Hongli1,2, YANG Yongfeng2,3. (1. School of Medicine, Southeast University, Nanjing 210009, China; 2. Department of Hepatology, Nanjing Second Hospital & Teaching Hospital of Southeast University, Nanjing 210003, China; 3. Department of Hepatology, Nanjing Hospital Affiliated to Nanjing University of Chinese Medicine & Nanjing Second Hospital, Nanjing 210003, China)
Corresponding author:
YANG Yongfeng, yyf1997@163.com (ORCID:0000-0002-3214-0038)
Abstract:
Primary biliary cholangitis (PBC) is a chronic intrahepatic cholestatic disease. This article summarizes and reviews the histopathological features of PBC and the role of pathological examination in the diagnosis and treatment of PBC, as well as the role of pathology in staging and prognosis, the diagnosis of atypical PBC and overlap syndrome, the analysis of reasons for poor response to ursodeoxycholic acid, and identification of diseases or exclusion of other comorbidities, so as to improve the awareness of the role of pathological examination in PBC among clinicians.
Key words:
Liver Cirrhosis, Biliary; Pathology, Clinical; Diagnosis; Therapeutics
Research funding:
National Natural Science Foundation of China(81970454)
原发性胆汁性胆管炎(PBC)是一种慢性非感染性的胆汁淤积性自身免疫性肝病,可能与遗传及环境等因素相互作用所导致的异常自身免疫反应有关。PBC年发病率为(0.23~5.31)/10万,患病率为(1.91~40.2)/10万[1]。该病多累及中老年女性,临床表现非特异性,常见乏力、皮肤瘙痒等,病理特点为进行性、非化脓性、破坏性肝内小胆管炎,常累及直径<100 μm的小胆管,随着疾病的不断进展而出现相应肝纤维化甚至肝硬化表现,治疗首选熊去氧胆酸(UDCA)药物,当疾病进展至肝衰竭等终末期时往往需要行肝移植。由于PBC具有特征性的自身免疫抗体——抗线粒体抗体(anti-mitochondrial antibodies, AMA)可用于诊断该病,且病理组织活检为有创性操作,肝穿刺要求熟练的操作技术,以及丰富的肝脏病理诊断水平,因此部分医生对病理在PBC诊治中是否必需存在争议,故本文将病理学检查在PBC诊治中的作用进行了系统的分析和综述。
1 PBC的临床诊断
根据我国《原发性胆汁性胆管炎诊断和治疗指南(2021)》[2],PBC诊断需综合临床表现、生化学、影像学及组织学等评估,诊断标准为满足以下3条标准中的2条即可诊断:(1)反映胆汁淤积的生物化学证据,如ALP和GGT升高的患者,且影像学排除肝内外大胆管梗阻表现;(2)特异性自身抗体抗线粒体抗体AMA/AMA-M2、抗gp210抗体、抗sp100抗体阳性;(3)组织学表现为非化脓性破坏性胆管炎。当满足(1)+(2)两项诊断标准时即典型的PBC患者无需病理学检查可临床诊断PBC。血清AMA和AMA-M2为经典的PBC抗体,因其敏感度及特异度均可达90%以上,故被临床广泛应用于诊断PBC。对AMA阴性者,可采用其他特异性PBC抗体辅助诊断[3],如以gp210和sp100為靶抗原的核膜型及核点型的特异性抗体。该两种抗体诊断AMA阴性PBC敏感度虽然只有23%和25% (95%CI:13%~37%及13%~43%),但特异度可高达99%和97%(95%CI:97%~100%及93%~98%)[4],当二者均阳性时诊断PBC的阳性预测值可达100%[5],故AMA阴性的胆汁淤积者若抗sp100、抗gp210阳性也诊断为AMA阴性PBC。
2 PBC的组织学特征
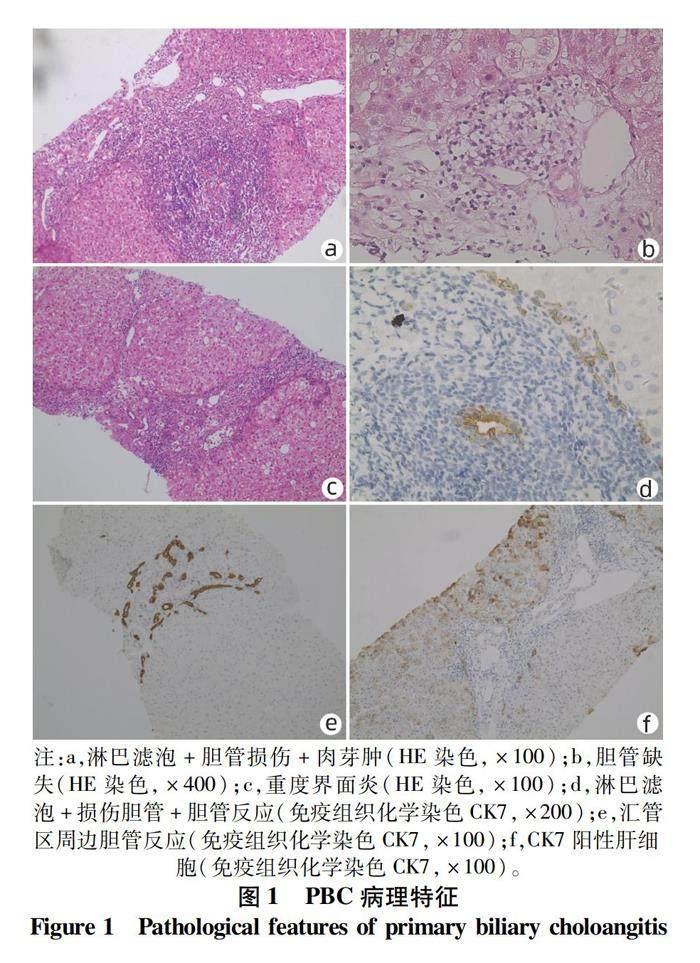
PBC病理表现可见慢性非化脓性破坏性胆管炎[6],旺炽性胆管病变即胆管周围淋巴细胞聚集且见上皮样肉芽肿。PBC通常累及<100 μm的小叶间胆管,严重时可导致胆管缺失。比较大的隔胆管、段胆管等通常不累及或仅轻微累及损伤,且不会引起大胆管消失。小胆管轻度损伤时可见正常的胆管细胞形态改变,细胞大小不规则或细胞水肿但胞核浓缩。淋巴细胞在汇管区胆管周围聚集并可破坏正常胆管细胞,对胆管造成持续性损伤,大量淋巴细胞聚集时可形成具有生发中心的淋巴滤泡,被损伤的胆管也渗出磷脂样物质,该种物质可引起周围细胞吞噬并在汇管区形成上皮样肉芽肿。当胆管被破坏后胆管结构最终消失。汇管区中的炎细胞可破坏界板形成界面炎,但与自身免疫性肝炎(AIH)的界面炎有所区别,PBC的界面炎通常为轻度,胆管缺失阶段可表现伴有细胆管增生和肝细胞羽毛样变性的胆汁性界面炎,界面处可见铜结合蛋白沉积、淤积的胆汁等。在胆管坏死、胆管周围炎症及胆汁淤积的作用下,纤维组织从汇管区进入肝小叶内,形成桥接纤维,逐步形成假小叶及肝硬化。
PBC病理表现为不均一病变,并非每个汇管区均有淋巴细胞聚集、上皮样肉芽肿等典型PBC表现,所以在肝穿刺时肝组织量要充分才能诊断。在发展至后期时,PBC的汇管区可仅有小叶间动脉,无与之伴行的小叶间胆管,当小叶间胆管毁损消失后,由于无免疫系统攻击的靶点,故淋巴细胞聚集及肉芽肿可能减轻,甚至消失。
肝脏病理组织可用多种染色方法结合辅助诊断。常规HE染色可以判断轻微或明显胆管损伤、淋巴细胞聚集、肉芽肿等典型病变,并可识别典型纤维化。免疫组织化学染色如细胞角蛋白7(CK7)或CK19可特异性识别胆管并评估胆管损伤程度,尤其是当汇管区淋巴细胞大量聚集及胆管被破坏但仅有少量残存结构时可帮助辨别胆管。PBC在HE染色及免疫组化CK7特征见图1。特殊染色中可用地衣紅染色评估铜结合蛋白,Masson染色评估纤维化程度。
3 PBC组织学诊断的临床应用
3.1 分级分期和预后评估 PBC根据临床表现及生化学指标可分为4期[7]:Ⅰ期为临床前期,表现为AMA阳性,但生化指标ALP或GGT无异常;Ⅱ期为无症状期,AMA阳性且生物化学指标ALP及GGT等指标异常,但通常患者无乏力、瘙痒等临床症状;Ⅲ期为症状期,在符合诊断标准基础上,伴有乏力及皮肤瘙痒等症状;Ⅳ期为进展期,患者此时病情较重,有肝硬化失代偿等门静脉高压及腹水、上消化道出血及肝性脑病,死亡风险高。
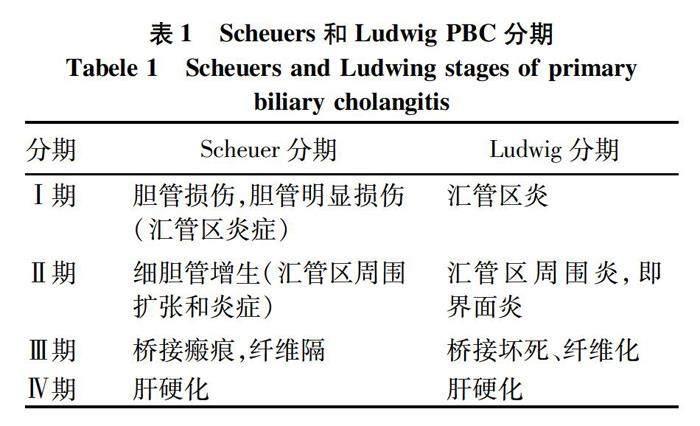
病理分期以组织学特征为依据,Scheuers分期[8]及Ludwigs分期[6]大致相似(表1),当病变局限于汇管区为Ⅰ期,病变从汇管区延伸时,并出现界板破坏为Ⅱ期,出现桥接纤维化为Ⅲ期,有肝硬化时为Ⅳ期。但是PBC为不均一性病变,典型的汇管区病变可能未被取样,而且纤维化和胆管缺失程度可能并不平行,Nakanuma分期[9]利用评分系统对纤维化、胆管缺失、地衣红阳性颗粒评估淤胆等表现,综合上述3项病理特征将PBC进行分期,可以更为客观的反映疾病分期;坏死炎症活性的分级与UDCA反应密切相关,而作为胆汁淤积标志物的地衣红阳性颗粒的沉积与肝硬化的进展密切相关[10],但与UDCA治疗应答相关的细胆管反应及CK7阳性肝细胞未纳入该项[11];该评分相对复杂且临床使用时繁琐,未在临床推广(表2)。
3.2 不典型PBC诊断
3.2.1 AMA阴性型PBC 典型PBC为AMA阳性且具有胆汁淤积生化学表现的患者,但临床存在5%~10%的患者为AMA阴性的PBC,该种类型患者可通过完善抗gp210、抗sp100抗体明确AMA阴性PBC诊断,两种抗体敏感度虽低,但其特异度较高。若特异性抗体均阴性但生化学指标升高的患者,根据肝穿刺活检病理组织学检查见PBC典型病理表现,如旺炽性胆管损伤,淋巴滤泡,上皮样肉芽肿等表现时,PBC诊断也可明确。此外,目前已有研究[12]认为抗核板层蛋白抗体、抗p80螺旋蛋白抗体、p62抗体、间质细胞源性因子-1、抗己糖激酶1抗体、Kelch样蛋白12也可辅助诊断PBC。
3.2.2 胆酶正常型PBC 临床常可见到AMA阳性但ALP正常的患者。有研究[13]对229例AMA阳性但ALP正常病例进行随访,根据生化指标的改变,在5年内1/6发展为PBC,提示这类病例可能处于PBC临床前期。但生化指标较病理指标敏感度差。我国学者[14]在169例AMA阳性且ALP正常门诊患者中,有67例知情同意肝穿刺病理检查,其中55例(82.1%)有典型PBC病理改变,分析显示AMA抗体滴度越高、越容易出现病理PBC典型表现。这也提示ALP和/或GGT正常并不能排除胆管损伤的存在,对AMA阳性肝功能正常的病例及时进行组织病理学检查是必要的,可以避免漏诊PBC而致疾病进展。
3.2.3 抗体阴性且胆酶正常 笔者在临床工作中诊治多例患者,表现为ALT增高等其他形式的肝损伤,ALP、GGT不高,AMA阴性,肝穿刺组织学可见PBC时典型旺炽性胆管损伤的病理表现,且排除病毒性肝炎、血液系统疾病等可能引起类似表现的疾病。按照现有诊断标准,该类病例并不符合PBC诊断。但既然有AMA阳性、胆酶正常型PBC,是否也存在AMA阴性且胆酶正常的PBC,值得临床进一步研究。
3.3 重叠综合征诊断 重叠综合征为具有2种自身免疫性肝病表现,PBC-AIH患者为同时具有PBC及AIH的特点,两种疾病可同时诊断或先确诊一项疾病后再诊断另一项疾病。常用的诊断标准为巴黎标准[11],即在PBC诊断明确的基础上,如果肝组织学显示中度或重度界面性肝炎,且至少满足以下2个标准之一: ALT>5×ULN;抗平滑肌抗体阳性或总免疫球蛋白G(IgG)>2×ULN。但该巴黎标准中IgG指标较高,可以达到PBC-AIH的诊断的患者远低于临床实践中观察到的患病率,有学者[15]建议将IgG指标调低至≥1.3×ULN,可以提高PBC-AIH诊断的敏感度而不降低特异度。诊断重叠综合征必须依靠肝穿刺组织病理学的中度及以上界面炎表现,以免临床过度诊断重叠综合征,使患者接受不必要的免疫抑制剂治疗。PBC- PSC重叠综合征:即患者同时或先后出现PBC及PSC(原发性硬化性胆管炎)的疾病表现[16],但发生率非常低,多为个案报道[17-18]。Kingham等[19]对261例自身免疫性肝病的20年的随访中仅有2例PBC-PSC,且临床表现为疲劳、瘙痒、黄疸或腹痛等非特异性症状。PSC胆管造影见肝内外胆管多灶性狭窄,多累及大胆管,病理检查见胆管周围同心圆性“洋葱皮”样的纤维化改变。小胆管PSC约占PSC患者中的10%[20],胆道造影无明显异常,诊断依赖肝活检,若出现PBC合并小胆管PSC时需依靠肝活检。
3.4 UDCA应答不佳原因分析 UDCA为国内外指南[2,21-22]推荐的治疗PBC首选用药,在足量及足疗程的规范治疗后可以改善PBC。人体自身具有该种亲水性的次级胆酸UDCA,占整个胆酸池的1%~3%,当连续口服(13~15 mg·kg-1·d-1)的UDCA后即成为肝内及体循环内的主要胆酸,内源性胆酸池的亲水性增加,促进肝细胞分泌胆汁酸及抑制内源性毒性胆汁酸的吸收。在UDCA 治疗6个月~2年后,可根据患者的生化学缓解判断应答情况。现有的生化应答判断标准有巴塞罗那标准、巴黎标准、鹿特丹标准、多伦多标准等。常用的巴黎标准在UDCA治疗1年后对肝功能评价[2],对病理学分期为Ⅰ~Ⅱ期的早期患者可使用巴黎Ⅱ标准:ALP及AST≤1.5×ULN,胆红素≤1 mg/dL。对病理学分期Ⅲ~Ⅳ期的中晚期患者可使用巴黎Ⅰ标准:ALP≤3×ULN,AST≤2×ULN,胆红素≤1 mg/dL。可见对于疾病早期患者的生化应答要求更加严格,应答不同的患者其生存期也不尽相同,通过病理学分期可为不同的患者制订应答策略。
临床中UDCA应答不佳的PBC约占40%[23],未获得生化学应答的PBC疾病进展至终末期肝病的风险将增加,生存率较应答者也有所下降,尽早明确UDCA应答不佳的原因可针对原因改善应答,提高生存率。其中转氨酶和/或IgG明显增高者,需要肝穿刺明确有无合并中度及以上界面炎,符合重叠综合征诊断的患者需尽早的加用免疫抑制剂治疗。此外,临床上常用于治疗高脂血症的贝特类药物也可改善PBC的胆汁淤积及胆固醇水平及改善PBC预后[24],如非诺贝特可提高UDCA应答率,改善GLOBE和UK-PBC評分,对组织学可能也有潜在的改善作用。当患者有UDCA应答不佳时可先完善肝穿刺活检排除有无重叠综合征,有重叠表现者加用免疫抑制剂,无重叠表现者则加用贝特改善生化学应答。奥贝胆酸也可改善部分对UDCA应答不佳患者的生化及组织学表现,但已处于肝硬化失代偿期者不建议使用该药物,因该药可引起肝脏失代偿,如肝性脑病、消化道出血或持续性血小板减少。但处于早期肝硬化者也需监测失代偿表现等[25]。
3.5 鉴别疾病或排除其他合并疾病 AMA虽为PBC的特异性抗体,但也可见于多种肝内外疾病,如AIH、慢性丙型肝炎、药物性肝炎、其他自身免疫性疾病如系统性红斑狼疮及干燥综合征、以及正常人群,故单纯AMA阳性并不能诊断PBC,对于诊断不确定的病例的组织学诊断至关重要。
PBC需要与其他胆汁淤积性疾病鉴别,尤其是有胆管损伤或缺失的疾病,如胆汁淤积型药物性肝损伤或有胆管缺失表现的药物性肝损伤[26]、Alagille综合征、家族性进行性胆汁淤积症、小胆管型PSC等鉴别。淋巴细胞聚集表现时要与血液系统疾病如浆细胞白血病、慢性丙型肝炎等进行鉴别,完善EBER原位杂交检查、病毒性肝炎血清学等鉴别。肉芽肿需要与引起肉芽肿疾病鉴别,如感染性疾病中的肝结核肉芽肿分布在汇管区,抗酸染色阳性者则支持肝结核。肝结节病的肉芽肿可见于汇管区及小叶内,但不聚集于胆管周围。在诊断重叠综合征时合并AIH时常以中度以上界面炎为标准,也需排除其他合并疾病引起的界面炎鉴别如药物性肝损伤、肝豆状核变性及病毒性肝炎等,可根据病史及完善血铜、尿铜、铜蓝蛋白及基因检测、病毒性肝炎血清学检查等有助于鉴别。
4 小结与展望
PBC诊治过程存在难点,在典型PBC诊断时,即特异性自身抗体(AMA、AMA-M2、抗gp210抗体、抗sp100抗体)阳性者结合胆汁淤积生化指标异常者,肝组织病理学检查并非诊断所必需。但是病理为分级分期的金标准,可判断疾病严重程度及评估预后;对不典型PBC包括抗体阴性型、胆酶正常型、抗体阴性且胆酶正常型PBC患者的诊断时,为重要的诊断标准之一,病理的作用是不可或缺的。在治疗PBC时,病理检查可应用于UDCA疗效不佳原因分析,尤其是有不明原因转氨酶升高>5×ULN或IgG升高≥1.3×ULN者,有中度及重度界面炎的患者考虑合并重叠综合征,及时加用免疫抑制剂治疗,若无界面炎患者可及时加用贝特类药物改善UDCA应答。此外,肝穿刺活检可用于其他病因引起的胆汁淤积性疾病的鉴别或病理表现中有胆管损伤及淋巴细胞聚集、肉芽肿的疾病鉴别诊断。总体而言,肝穿刺活检及病理组织学检查是PBC诊断及治疗中所需的,但是也期待其他无创方法(如特异性自身抗体或诊断及预后模型)用于不典型PBC的诊断及鉴别诊断和预后评估,能发现新的检查手段代替疾病组织病理学表现,可用于疾病进展评估和药物疗效的评估。
利益冲突声明:所有作者均声明不存在利益冲突。
作者贡献声明:
刘红丽负责检索文献,撰写文章;杨永峰负责设计文章框架,文献检索策略,修改和审核文章。
参考文献:
[1]
LV T, CHEN S, LI M, et al. Regional variation and temporal trend of primary biliary cholangitis epidemiology: A systematic review and meta-analysis[J]. J Gastroenterol Hepatol, 2021, 36(6): 1423-1434. DOI: 10.1111/jgh.15329.
[2]
Chinese Society of Hepatology, Chinese Medical Association. Guidelines on the diagnosis and management of primary biliary cholangitis (2021)[J]. J Clin Hepatol, 2022, 38(1): 35-41. DOI: 10.3760/cma.j.cn112138-20211112-00794.
中華医学会肝病学分会. 原发性胆汁性胆管炎的诊断和治疗指南(2021)[J]. 临床肝胆病杂志, 2022, 38(1): 35-41. DOI: 10.3760/cma.j.cn112138-20211112-00794.
[3]GRANITO A, MURATORI P, QUARNETI C, et al. Antinuclear antibodies as ancillary markers in primary biliary cirrhosis[J]. Expert Rev Mol Diagn, 2012, 12(1): 65-74. DOI: 10.1586/erm.11.82.
[4]ZHANG Q, LIU Z, WU S, et al. Meta-analysis of antinuclear antibodies in the diagnosis of antimitochondrial antibody-negative primary biliary cholangitis[J]. Gastroenterol Res Pract, 2019, 2019: 8959103. DOI: 10.1155/2019/8959103.
[5]GRANITO A, MURATORI P, MURATORI L, et al. Antinuclear antibodies giving the ‘multiple nuclear dots or the ‘rim-like/membranous patterns: diagnostic accuracy for primary biliary cirrhosis[J]. Aliment Pharmacol Ther, 2006, 24(11-12): 1575-1583. DOI: 10.1111/j.1365-2036.2006.03172.x.
[6]LUDWIG J, DICKSON ER, MCDONALD GS. Staging of chronic nonsuppurative destructive cholangitis (syndrome of primary biliary cirrhosis)[J]. Virchows Arch A Pathol Anat Histol, 1978, 379(2): 103-112. DOI: 10.1007/BF00432479.
[7]IMAM MH, LINDOR KD. The natural history of primary biliary cirrhosis[J]. Semin Liver Dis, 2014, 34(3): 329-333. DOI: 10.1055/s-0034-1383731.
[8]SCHEUER P. Primary biliary cirrhosis[J]. Proc R Soc Med, 1967, 60(12): 1257-1260.
[9]NAKANUMA Y, ZEN Y, HARADA K, et al. Application of a new histological staging and grading system for primary biliary cirrhosis to liver biopsy specimens: Interobserver agreement[J]. Pathol Int, 2010, 60(3): 167-174. DOI: 10.1111/j.1440-1827.2009.02500.x.
[10]KAKUDA Y, HARADA K, SAWADA-KITAMURA S, et al. Evaluation of a new histologic staging and grading system for primary biliary cirrhosis in comparison with classical systems[J]. Hum Pathol, 2013, 44(6): 1107-1117. DOI: 10.1016/j.humpath.2012.09.017.
[11]CARBONE M, NARDI A, FLACK S, et al. Pretreatment prediction of response to ursodeoxycholic acid in primary biliary cholangitis: development and validation of the UDCA Response Score[J]. Lancet Gastroenterol Hepatol, 2018, 3(9): 626-634. DOI: 10.1016/S2468-1253(18)30163-8.
[12]NORMAN GL, YANG CY, OSTENDORFF HP, et al. Anti-kelch-ike 12 and anti-hexokinase 1: novel autoantibodies in primary biliary cirrhosis[J]. Liver Int, 2015, 35(2): 642-651. DOI: 10.1111/liv.12690.
[13]DAHLQVIST G, GAOUAR F, CARRAT F, et al. Large-scale characterization study of patients with antimitochondrial antibodies but nonestablished primary biliary cholangitis[J]. Hepatology, 2017, 65(1): 152-163. DOI: 10.1002/hep.28859.
[14]SUN C, XIAO X, YAN L, et al. Histologically proven AMA positive primary biliary cholangitis but normal serum alkaline phosphatase: Is alkaline phosphatase truly a surrogate marker?[J]. J Autoimmun, 2019, 99: 33-38. DOI: 10.1016/j.jaut.2019.01.005.
[15]WANG Q, SELMI C, ZHOU X, et al. Epigenetic considerations and the clinical reevaluation of the overlap syndrome between primary biliary cirrhosis and autoimmune hepatitis[J]. J Autoimmun, 2013, 41: 140-145. DOI: 10.1016/j.jaut.2012.10.004.
[16]MAGO S, WU GY. Primary sclerosing cholangitis and primary biliary cirrhosis overlap syndrome: A review[J]. J Clin Transl Hepatol, 2020, 8(3): 336-346. DOI: 10.14218/JCTH.2020.00036.
[17]SUNDARAM S, S K, MAZUMDAR S, et al. Overlap syndrome between primary biliary cholangitis and primary sclerosing cholangitis[J]. ACG Case Rep J, 2018, 5: e54. DOI: 10.14309/crj.2018.54.
[18]MANDOLESI D, LENZI M, D'ERRICO A, et al. Primary biliary cholangitis-primary sclerosing cholangitis in an evolving overlap syndrome: A case report[J]. Gastroenterol Hepatol, 2017, 40(10): 669-671. DOI: 10.1016/j.gastrohep.2016.11.010.
[19]KINGHAM JG, ABBASI A. Co-existence of primary biliary cirrhosis and primary sclerosing cholangitis: a rare overlap syndrome put in perspective[J]. Eur J Gastroenterol Hepatol, 2005, 17(10): 1077-1080. DOI: 10.1097/00042737-200510000-00011.
[20]
Chinese Society of Hepatology, Chinese Medical Association. Guidelines on the diagnosis and management of primary sclerosing cholangitis (2021)[J]. J Clin Hepatol, 2022, 38(1): 50-61. DOI: 10.3760/cma.j.cn112138-20211109-00786.
中華医学会肝病学分会. 原发性硬化性胆管炎诊断及治疗指南(2021)[J]. 临床肝胆病杂志, 2022, 38(1): 50-61. DOI: 10.3760/cma.j.cn112138-20211109-00786.
[21]European Association for the Study of the Liver. EASL clinical practice guidelines: The diagnosis and management of patients with primary biliary cholangitis[J]. J Hepatol, 2017, 67(1): 145-172. DOI: 10.1016/j.jhep.2017.03.022.
[22]LINDOR KD, BOWLUS CL, BOYER J, et al. Primary biliary cholangitis: 2018 practice guidance from the American Association for the Study of Liver Diseases[J]. Hepatology, 2019, 69(1): 394-419. DOI: 10.1002/hep.30145.
[23]CAREY EJ, ALI AH, LINDOR KD. Primary biliary cirrhosis[J]. Lancet, 2015, 386(10003): 1565-1575. DOI: 10.1016/S0140-6736(15)00154-3.
[24]ZHANG Y, LI S, HE L, et al. Combination therapy of fenofibrate and ursodeoxycholic acid in patients with primary biliary cirrhosis who respond incompletely to UDCA monotherapy: a meta-analysis[J]. Drug Des Devel Ther, 2015, 9: 2757-2766. DOI: 10.2147/DDDT.S79837.
[25]TRAUNER M, NEVENS F, SHIFFMAN ML, et al. Long-term efficacy and safety of obeticholic acid for patients with primary biliary cholangitis: 3-year results of an international open-label extension study[J]. Lancet Gastroenterol Hepatol, 2019, 4(6): 445-453. DOI: 10.1016/S2468-1253(19)30094-9.
[26]YANG J, YU YL, JIN Y, et al. Clinical characteristics of drug-induced liver injury and primary biliary cirrhosis[J]. World J Gastroenterol, 2016, 22(33): 7579-7586. DOI: 10.3748/wjg.v22.i33.7579.
收稿日期:
2022-12-31;录用日期:2023-02-17
本文编辑:林姣

