引起非妊娠成年患者血流感染的无乳链球菌毒力基因及分子分型研究
陈星月 刘婧娴 刘瑛

摘要:目的 對上海交通大学医学院附属新华医院引起非妊娠成人患者血流感染的无乳链球菌进行毒力基因检测和分子分型研究。方法收集上海市某三甲医院2012—2020年分离的引起非妊娠成人患者血流感染的无乳链球菌(group B Streptococcus,GBS)临床菌株,通过病例系统收集相应患者的临床资料进行统计分析。采用MALDI-TOF MS对菌株进行鉴定;采用Vitek-2 Compact联合纸片扩散法(K-B法)进行药物敏感试验;采用PCR方法和琼脂糖凝胶电泳方法进行与菌株黏附、侵袭和免疫逃逸相关的毒力基因检测;采用多重PCR方法进行血清学分型;采用MLST方法进行分子分型研究,分型结果采用Bionumeric 8.0软件分析菌株间亲缘关系。结果 2012—2020年共分离到13株符合入组条件的GBS菌株,相应患者人群以中老年为主,占92.4%;男女比例为3.3:1,且大部分患者有心律失常、糖尿病或肝硬化等基础疾病。药敏结果提示菌株对氨苄西林、万古霉素、利奈唑胺、青霉素、头孢曲松、替加环素等抗菌药物仍然保持高度敏感,对克林霉素耐药率最高达84.6%,其次是四环素(61.5%)和红霉素(53.8%)。黏附作用相关基因中fbsB、pavA基因携带率100%,而菌毛编码基因gbsPC1的携带率最低(46.15%);侵袭力相关基因中cylX、cylD、cylG、acpC、cylZ、cylA、cylB、cylE、cylF、cylI、cylJ、cfb、hylB和bca基因的携带率100%,cylK和spb1的携带率较低分别为7.69%和38.45%,rib基因在13株菌种均未检出。免疫逃避相关基因中cpsF、cpsE、cpsD、cpsB、neuA、neuD、neuC、neuB和pbp1A的基因携带率为100%,bac、cpsJ、cpsI、cpsG的携带率较低。菌株的血清学分型以Ⅰb型为主,占38.5%(5/13);13株菌共分为10种ST型,同源性分析显示菌株亲缘关系较远。结论 无乳链球菌引起非妊娠成人患者血流感染的危险因素可能为高龄、男性以及心律失常等基础疾病,菌株对克林霉素、四环素耐药率较高,且携带较多毒力基因,血清分型以Ⅰb型为主,但ST分型较为分散,未出现暴发流行趋势。
关键词:无乳链球菌;成人;血流感染;荚膜血清型;毒力基因;多位点序列分型
中图分类号:R978 文献标志码:A
Abstract Objective To investigate the virulence genes and molecular typing of Streptococcus agalactiae which caused bloodstream infection in non-pregnant adult patients in Xin Hua Hospital, Shanghai Jiao Tong University School of Medicine. Methods The Streptococcus agalactiae (GBS) isolated from blood culture in non-pregnant adult patients, were collected from 2012 to 2020 in Xinhua Hospital, clinical data of the patients were collected from medical records for statistical analysis. The strains were identified by MALDI-TOF MS. The drug sensitivity test was performed by VITEK-2 Compact combined with paper diffusion method (K-B method). The virulence genes related to adhesion, invasion and immune escape were detected by PCR and agarose gel electrophoresis. The serotyping was performed by multiplex PCR. MLST method was used for molecular typing study, and Bionumeric 8.0 software was used to analyze the relationship among the strains. Results From 2012 to February 2020, a total of 13 strains of GBS met the inclusion criteria were collected. The majority of patients were middle-aged and elderly, accounting for 92.4%. The male-female ratio was 3.3:1, and most patients had underlying diseases such as arrhythmias, diabetes or cirrhosis of the liver. The strains were still highly sensitive to ampicillin, vancomycin, linezolid, penicillin, ceftriaxone, tigecycline and other antibiotics, but the resistance rate of clindamycin was up to 84.6%, followed by tetracycline (61.5%) and erythromycin (53.8%). In adhesion related genes, the positive rate of fbsB and pavA genes was 100%, while gbsPC1 was low (46.15%). Among the invasiveness related genes, the positive rate of cylX, cylD, cylG, acpC, cylZ, cylA, cylB, cylF, cylI, cylJ, cfb, hylB, and bca genes were 100%, while for cylK and spb1 were 7.69% and 38.45%, respectively. rib gene was not detected in 13 strains. Among the genes related to immune evasion, the positive rate of cpsF, cpsE, cpsD, cpsB, neuA, neuD, neuC, neuB and pbp1A was 100%, while for bac, cpsJ, cpsI and cpsG the positive rate was low. The main serotype in these strains was Ⅰb, accounting for 38.5% (5/13). The 13 isolates were divided into 10 STs, and homology analysis showed that the isolates had a distant genetic relationship. Conclusion The risk factors of Streptococcus agalactiae bloodstream infections in adult patients may be older, male, and basic diseases such as arrhythmia. Streptococcus agalactiae isolated from non-pregnant adults had high resistance rate in clindamycin, tetracycline, and carried many virulence genes. The major serotype of these strains was Ⅰb, but there were no sign of outbreak trend observed since no specific ST was found prevalence.
Key words Group B Streptococcus; Adult; Bloodstream infection; Capsular serotype; Virulence gene; Multi-locus sequence typing
無乳链球菌(Streptococcus agalactiae),是一种革兰染色阳性、触酶阴性的兼性厌氧菌,呈球形或卵圆形。因其菌体表面具有革兰阳性B组抗原,又被称为B族链球菌(group B Streptococcus,GBS)。既往研究表明GBS是导致新生儿及孕妇侵袭性疾病的主要致病菌之一,然而,近年的研究数据表明,非妊娠成人群体的GBS感染率逐渐升高,患者多存在基础疾病、免疫低下或者存在免疫功能缺陷[1-4]。B族链球菌可引起非妊娠成人患者各种类型的感染,其中发展成脓毒血症的患者预后通常较差[5]。 虽然无乳链球菌对青霉素和头孢菌素类仍保持很高的敏感性,然而,美国一家医疗中心的回顾性病例对照研究显示,采用敏感抗生素治疗无乳链球菌感染时,仍有28%的失败率[6]。
鉴于非妊娠成人GBS感染的形势日趋严峻,而目前有关引起非妊娠成人无乳链球菌血流感染相关的研究较少,对于此类感染的临床特点及相关菌株的分子特点认识尚不全面,故本研究拟通过对上海交通大学医学院附属新华医院2012—2020年从非妊娠成人血培养标本分离到的GBS菌株进行的血清分型情况、MLST分型情况及毒力基因检测情况进行分析,旨在为非妊娠成年患者无乳链球菌血流感染的临床诊治及预防控制提供理论科学依据。
1 材料与方法
1.1 材料
1.1.1 菌株来源
2012—2020年上海交通大学医学院附属新华医院非妊娠成人患者血培养标本中分离到的GBS菌株,置于甘油肉汤中-80℃冻存,待用。
1.1.2 试剂
质谱基质液HCCA(Sigma,德国)、VITEK GN67 药敏板(BioMérieux,法国)、细菌基因组 DNA 提取试剂盒(上海生工生物工程公司),聚合酶链式反应(polymerasechain reaction,PCR)试剂(TAKARA,日本)。PCR引物及PCR产物测序委托上海生工生物工程技术服务有限公司完成。
1.1.3 仪器
基质辅助激光解吸电离飞行时间质谱检测仪(matrix-assisted laser desorption/ionization time-of-flight mass spectrometry, MALDI-TOF MS)(Bruker Daltonics,德国)、VITEK 2-Compact全自动细菌鉴定药敏分析仪(Bruker Daltonics,德国)、PCR 基因扩增仪(Eppendorf,德国)、紫外照胶仪器(Bio-Rad,美国)。
1.2 方法
1.2.1 菌株鉴定
将待测菌株接种于血琼脂平板37℃培养18~24 h,挑取平板中待测菌落涂抹于靶板,加1 μL甲酸裂解,干燥后加1 μL基质液,晾干,靶板装载上机,进行质谱鉴定。质控菌株为大肠埃希菌 ATCC8739。
1.2.2 菌株药敏试验
采用Vitek-2 Compact全自动药敏分析系统联合K-B纸片扩散法对菌株进行药敏试验,结果根据2020版美国临床和实验室标准化协会(CLSI)M100进行判读。检测药物包括氨苄西林、万古霉素、左氧氟沙星、克林霉素、利奈唑胺、红霉素、青霉素、头孢曲松、替加环素和四环素。
1.2.3 菌株毒力基因检测
采用PCR方法检测与黏附有关的基因fbsA,fbsB,pavA,scpB,lmb以及GBS菌毛编码基因,与侵袭有关的基因cylX,cylD,cylG, acpC, cylZ, cylA, cylB, cylE, cylF, cylI, cylJ, cylK, cfb, spb1, hylB, rib和bca以及与免疫逃逸相关的基因bac, cpsM, cpsIaJ, cpsJ, cpsI, cpsG, cpsF, cpsE, cpsD, cpsC, cpsB, cpsA, neuA, neuD, neuC, neuB, cspA和pbp1A。各毒力基因的引物及PCR反应条件见参考文献[7]。
1.2.4 菌株血清学分型
采用多重PCR方法检测菌株的血清型。无乳链球菌血清型(Ⅰa、Ⅰb和Ⅱ~Ⅷ)扩增引物、PCR扩增条件及判读标准参见参考文献[8]。
1.2.5 MLST分型及同源性分析
参考GBS的MLST数据库网站(https://pubmlst.org/sagalactiae/info/primers.sh tml)推荐的方案,合成adhP、atr、glcK、glnA、pheS、sdhA和tkt等7对管家基因扩增引物和7对测序引物序列。扩增条件:94℃预变性3 min;94℃ 1min,56℃ 45 s,72℃ 1 min,30个循环;72℃ 5min,扩增产物经一代序列测定,测序结果在 MLST 网站数据库比对确定菌株分型,采用Bionumeric 8.0软件分析菌株之间的亲缘关系。
2 结果
2.1 临床信息
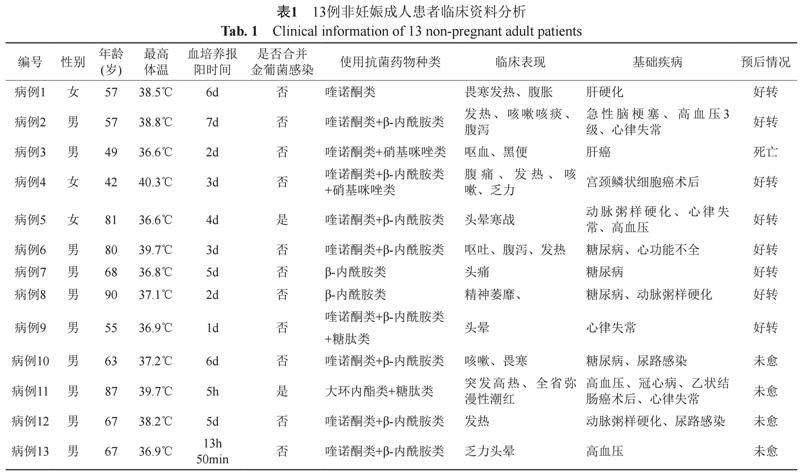
自2012—2020年2月共分离到13株符合入组条件的GBS菌株,对应13例患者。男女患者性别比例为 3.3:1,患者人群以中老年为主,占92.4%,GBS血流感染时最主要的临床表现为发热和精神不振,69.23%患者存在基础疾病,15.4%(2/13)合并金黄色葡萄球菌血流感染,全因死亡率7.7%(1/13)如表1所示。
2.2 药敏结果
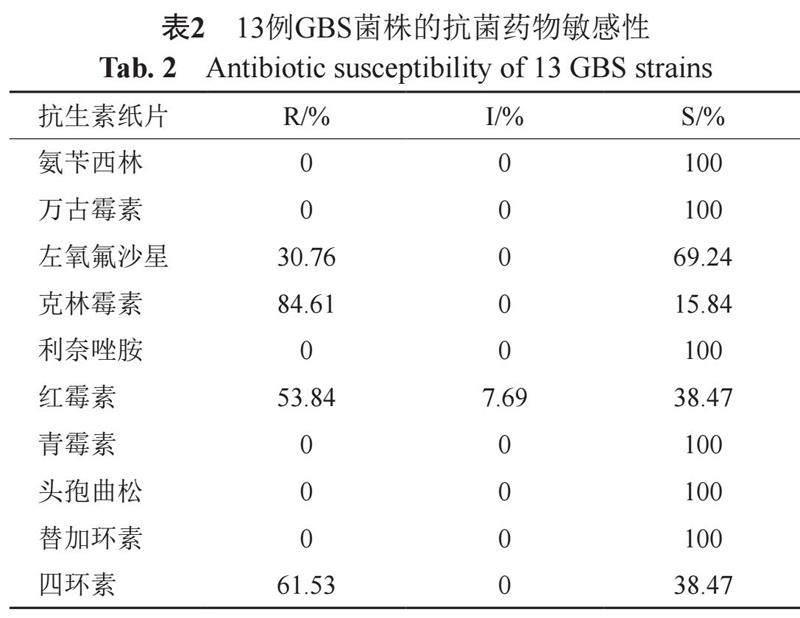
13株无乳链球菌抗菌药物药敏试验结果见表2。所有菌株对氨苄西林、万古霉素、利奈唑胺、青霉素、头孢曲松和替加环素等保持敏感,克林霉素耐药率最高为84.6%,四环素耐药率次之为61.5%,红霉素耐药率为53.8%,左氧氟沙星耐药率为30.8%。13株菌中53.85%(7/13)为多重耐药菌株。
2.3 毒力基因分析
13株无乳链球菌,有25个毒力基因检出率为100%,包括fbsB、pavA、cylX、cylD、cylG、acpC、cylZ、cylA、cylB、cylE、cylF、cylI、cylJ、cfb、hylB、bca、cpsF、cpsE、cpsD、cpsB、neuA、neuD、neuC、neuB和pbp1A。检测出5个毒力基因检出率为92.31%,包括scpB、lmb、cpsC、cpsA和cspA。5个毒力基因检出率为76.9%,包括fbsA、gbsPC2、gbsPC3、gbsPC4和gbsPC5。有3个基因检出率为15.38%,包括bac、cpsJ和cpsI。有2个基因的检出率为30.77%,包括spb1和cpsIaJ。其他毒力基因检出率为cpsM(84.62%)、cpsG(23.08%)、gbsPC1(46.15%)和cylK(7.6%)。但在任何分離菌株中均未发现rib基因。各毒力基因的检出情况如表3所示。
2.4 血清学分析
13株无乳链球菌分为 6个血清型,Ⅰb占 38.46%(5/13),Ⅰa、Ⅲ和Ⅴ均占 15.38%(2/13),Ⅵ、Ⅶ型各检出1株,未检出Ⅱ、Ⅳ及Ⅷ型。如表3所示。
2.5 MLST及同源性分析
13株菌种共分为10种ST分型,分别为ST1、ST8、ST10、ST12、ST19、ST103、ST234、ST529、ST1037、ST1318,其中ST1037、ST1318为本研究发现的新类型,见表3。ST10、ST1372、ST12仅存在单个等位基因差异,属于同一个克隆复合群(colonal complex, CC),且上述类型菌株的血清分型均为Ⅰb型。本地区Ⅰb/CC12型菌株较其他类型流行更为广泛,但并未出现暴发流行趋势。其他类型菌株之间的亲缘关系较远,以散发流行为主(图1)。
3 讨论
无乳链球菌为常见的革兰阳性链球菌,在非妊娠成年人群中,可以广泛定植在下消化道、泌尿道和生殖道。当机体免疫力下降的时候,可引起严重侵袭性感染,如脓毒血症、心内膜炎、脑膜炎等[5]。无乳链球菌引起非妊娠成人侵袭性感染性疾病中最常见的类型为血流感染,患者通常同时合并其他细菌感染,以金黄色葡萄球菌最为多见 [1,9-10]。近年来,GBS引起非妊娠成年人的感染率呈逐年上升趋势,估计每年发病率为每10万名患者中出现4至11名,主要是免疫力低下或免疫缺陷的群体,在极少数情况下,GBS也会导致免疫功能正常成年人发生严重感染[1-4]。在本研究中,13例无乳链球菌血流感染的非妊娠成年患者中位年龄为67岁,主要以中老年患者为主,且大部分患者存在糖尿病、肝硬化等基础疾病,且15.4%(2/13)患者合并金黄色葡萄球菌感染。
目前治疗GBS感染仍推荐首选青霉素类药物;而对该类药物过敏的患者主要是选用大环内酯类药物或者林可霉素类药物替代[11]。近年来,无乳链球菌对于红霉素和克林霉素的耐药率逐步升高,美国CDC已将耐克林霉素无乳链球菌列为值得关注的耐药菌之一。在上海地区开展的一项研究显示,GBS对红霉素和克林霉素的耐药率分别为69.0%和50.6%[7]。阿根廷一项对非妊娠患者无乳链球菌的研究中,也发现红霉素和克林霉素耐药的菌株[12]。本研究中,GBS对红霉素和克林霉素的耐药率分别为53.84%和84.61%,耐大环内酯类GBS的出现和流行将给青霉素过敏患者GBS感染的治疗带来挑战。因此,临床中应注意抗生素合理使用,避免耐药菌株的传播和流行。
本研究检测的45个毒力基因按照功能主要分为3大类:黏附作用相关、侵袭力相关以及免疫逃避相关。本研究纳入的菌株大部分携带fbsB、pavA、scpB及lmb等黏附作用相关基因。fbsA和fbsB编码的纤维蛋白原结合蛋白(fibrinogen-binding protein)、lmb编码的层粘连蛋白结合蛋白(laminin-binding protein),主要通过黏附上皮细胞,使GBS免受调理吞噬作用[13-15]。而由pavA编码的纤维结合蛋白可以介导纤连蛋白黏附于上皮细胞[16]。C5a肽酶是一种由scpB基因编码丝氨酸蛋白,通过与纤连蛋白黏附于上皮细胞;同时可以使人类的补体趋化因子C5a裂解,阻止中性粒细胞聚集到感染部位[17]。本研究发现,非妊娠成人GBS菌株在侵袭相关毒力基因携带率很高,14个侵袭相关毒力基因阳性率为100%。所有GBS携带两种穿孔毒素,即β-H/C和CAMP因子的编码基因。β-H/C是由cyl操纵子编码,是一种表面相关的多能性毒素,参与溶血素和色素生成,可以侵入宿主细胞的各种屏障,例如肺上皮细胞或内皮细胞以及血脑屏障[18]。cfb基因编码的CAMP 因子可在细胞膜上的富集诱导细胞膜结构变化而形成膜孔,导致细胞破裂[19]。国外研究发现,由spb1编码的另一种溶血素蛋白在血清型Ⅲ型的 GBS 菌株中更为多见,并且毒力更强[20],但本研究发现,携带spb1基因的菌株均为CC12型,与文献报道存在一定差异。GBS主要通过荚膜多糖、荚膜唾液酸、丝氨酸蛋白酶A等介导免疫逃逸。本研究的菌株neu编码基因、cspA基因、PBP1a基因阳性率为100%,但荚膜多糖编码基因的携带情况存在较大差异。GBS的荚膜多糖由cps基因簇编码,主要通过两种机制阻止免疫系统清除病原体;防止补体沉积和吞噬作用[21]。荚膜唾液酸(Sia),其合成由neu编码基因,可以产生一种分子模拟形式,使GBS表面形成与宿主细胞表面的相似区域,进而逃避宿主的免疫激活[22]。cspA毒力基因表达的丝氨酸蛋白酶A除了能裂解纤维蛋白原外,还可介导趋化因子裂解中性粒细胞,减弱中性粒细胞调理吞噬作用的能力[23]。青霉素结合蛋白(PBP1a)在GBS对吞噬细胞清除的抗性中发挥重要作用,能够强化GBS对于抗菌肽的抗性[24]。
在大多數国家或地区的报道中,分离自非妊娠成人患者的GBS血清型主要为Ⅰa、Ⅰb、Ⅱ、Ⅲ和Ⅴ型[1,25-26],总体上,V型最为常见,但无乳链球菌的血清型分布具有区域性差异[27-28]。法国一项多中心研究发现,Ⅰa、Ⅰb、Ⅱ、Ⅲ 和 Ⅴ型血清型的无乳链球菌株所引起的感染占总病例数的91.0%[9]。在美国,非妊娠成人感染患者中分离到的GBS血清型主要为Ⅰa型和Ⅴ型,但是Ⅰb、Ⅱ、Ⅳ型菌株的检出率逐年上升[2]。 根据一项匈牙利研究,在性病患者中,无乳链球菌最常见的类型为V型,此外高致病性Ⅲ/ST17型GBS的检出率为27.1%[27]。在国内,台湾地区感染成年患者的GBS以Ⅵ,Ⅰb 和Ⅴ为主[29],上海地区以Ⅲ、Ⅰa、Ⅴ、Ⅰb 和Ⅱ最为多见[7],而北京则以Ⅲ最多,其次为Ⅰa、Ⅰb 和Ⅴ[30]。本研究发现引起非妊娠成人患者血流感染的GBS菌株,血清型以Ⅰb为主,其次为Ⅰa,Ⅲ型,与国内地区报道较为一致。
既往研究表明ST和荚膜血清型之间存在一定相关性。根据美国和加拿大的研究,非妊娠成人患者感染的GBS主要为V型,其中,92%V型分离株的ST型为ST-1型[31]。此外,也有研究显示,Ⅰb型与ST10和ST12,Ⅲ型与ST19和ST17有显著相关性[7],在本次实验中,也发现血清型和ST型具有一致性的现象,如ST-19型菌株的血清型为Ⅲ型,而CC12克隆复合群的菌株均为Ⅰb型。Hall等[32]的一项meta分析显示,引起妊娠妇女感染的GBS以Ⅰa型最为常见,占31%,其次为Ⅲ型,占27%。感染妊娠妇女的GBS分子流行病学还存在一定的地域差异,在塞尔维亚,Ⅲ/ST17 和 V/ST1是最常见的类型[33],而我国分离自妊娠患者的GBS菌株中,最常见的分子型则为Ⅲ/ ST19型[34-35]。本研究发现引起非妊娠成人患者血流感染的GBS菌株以Ⅰb/CC12菌株最为常见,占38.46%,这提示该类型菌株可能更容易引起非妊娠患者侵袭性感染。总体而言本研究分离的菌株亲缘关系较远,未发现优势ST型及暴发流行趋势。
本研究存在一些不足,比如本研究为单中心研究,且分离株数量较少,故研究结果存在一定局限性,后续还需多中心、多区域的研究,纳入更多数量的菌株进行分析以进一步明确。
参 考 文 献
Francois Watkins L K, McGee L, Schrag S J, et al. Epidemiology of invasive group b streptococcal infections among nonpregnant adults in the United States, 2008-2016[J]. JAMA Intern Med, 2019, 179(4): 479-488.
Graux E, Hites M, Martiny D, et al. Invasive group B Streptococcus among non-pregnant adults in Brussels-Capital Region, 2005-2019[J]. Eur J Clin Microbiol Infect Dis, 2021, 40(3): 515-523.
Edwards M S, Baker C J. Group B streptococcal infections in elderly adults[J]. Clin Infect Dis, 2005, 41(6): 839-847.
Skoff T H, Farley M M, Petit S, et al. Increasing burden of invasive group B streptococcal disease in nonpregnant adults, 1990-2007[J]. Clin Infect Dis, 2009, 49(1): 85-92.
Abdelradi A, Murphy A, Ahasic A M. Invasive Streptococcus agalactiae causing meningitis, ventriculitis, and endocarditis in a non-pregnant adult[J]. Cureus, 2020, 12(11): e11412.
Sunkara B, Bheemreddy S, Lorber B, et al. Group B Streptococcus infections in non-pregnant adults: The role of immunosuppression[J]. Int J Infect Dis, 2012, 16(3): e182-6.
Jiang H, Chen M, Li T, et al. Molecular characterization of Streptococcus agalactiae causing community- and hospital-acquired infections in Shanghai, China[J]. Front Microbiol, 2016, 7: 1308.
Imperi M, Pataracchia M, Alfarone G, et al. A multiplex PCR assay for the direct identification of the capsular type (Ia to Ⅸ) of Streptococcus agalactiae[J]. J Microbiol Methods, 2010, 80(2): 212-214.
Vuillemin X, Hays C, Plainvert C, et al. Invasive group B Streptococcus infections in non-pregnant adults: A retrospective study, France, 2007-2019[J]. Clin Microbiol Infect, 2021, 27(1): 129.e1-129.e4.
Huang P Y, Lee M H, Yang C C, et al. Group B streptococcal bacteremia in non-pregnant adults[J]. J Microbiol Immunol Infect, 2006, 39(3): 237-241.
De Francesco M A, Caracciolo S, Gargiulo F, et al. Phenotypes, genotypes, serotypes and molecular epidemiology of erythromycin-resistant Streptococcus agalactiae in Italy[J]. Eur J Clin Microbiol Infect Dis, 2012, 31(8): 1741-1747.
Saad E J, Baenas D F, Boisseau C S, et al. Streptococcus agalactiae bacteremia in non-pregnant adult patients at two teaching hospitals[J]. Rev Argent Microbiol, 2018, 50(3): 280-284.
Schubert A, Zakikhany K, Pietrocola G, et al. The fibrinogen receptor FbsA promotes adherence of Streptococcus agalactiae to human epithelial cells[J]. Infect Immun, 2004, 72(11): 6197-6205.
Gutekunst H, Eikmanns B J, Reinscheid D J. The novel fibrinogen-binding protein FbsB promotes Streptococcus agalactiae invasion into epithelial cells[J]. Infect Immun, 2004, 72(6): 3495-3504.
Bobadilla F J, Novosak M G, Cortese I J, et al. Prevalence, serotypes and virulence genes of Streptococcus agalactiae isolated from pregnant women with 35-37 weeks of gestation[J]. BMC Infect Dis, 2021, 21(1): 73.
Pracht D, Elm C, Gerber J, et al. PavA of Streptococcus pneumoniae modulates adherence, invasion, and meningeal inflammation[J]. Infect Immun, 2005, 73(5): 2680-2689.
Rajagopal L. Understanding the regulation of group B streptococcal virulence factors[J]. Future Microbiol, 2009, 4(2): 201-221.
Pritzlaff C A, Chang J C, Kuo S P, et al. Genetic basis for the beta-haemolytic/cytolytic activity of group B Streptococcus[J]. Mol Microbiol, 2001, 39(2): 236-247.
Li Y, Zeng W, Li Y, et al. Structure determination of the CAMP factor of Streptococcus agalactiae with the aid of an MBP tag and insights into membrane-surface attachment[J]. Acta Crystallogr D Struct Biol, 2019,75(Pt 8): 772-781.
Adderson E E, Takahashi S, Wang Y, et al. Subtractive hybridization identifies a novel predicted protein mediating epithelial cell invasion by virulent serotype Ⅲ group B Streptococcus agalactiae[J]. Infect Immun, 2003, 71(12): 6857-6863.
Hanson B R, Runft D L, Streeter C, et al. Functional analysis of the CpsA protein of Streptococcus agalactiae[J]. J Bacteriol, 2012, 194(7): 1668-1678.
Lartigue M F, Poulard A F, Al Safadi R, et al. Variability of neuD transcription levels and capsular sialic acid expression among serotype Ⅲ group B Streptococcus strains[J]. Microbiology (Reading), 2011, 157(Pt 12): 3282-3291.
Bryan J D, Shelver D W. Streptococcus agalactiae CspA is a serine protease that inactivates chemokines[J]. J Bacteriol, 2009, 191(6): 1847-1854.
Hamilton A, Popham D L, Carl D J, et al. Penicillin-binding protein 1a promotes resistance of group B Streptococcus to antimicrobial peptides[J]. Infect Immun, 2006, 74(11): 6179-6187.
Bj?rnsdóttir E S, Martins E R, Erlendsdóttir H, et al. Changing epidemiology of group B streptococcal infections among adults in Iceland: 1975-2014[J]. Clin Microbiol Infect, 2016, 22(4): 379.
Martins E R, Melo-Cristino J, Ramirez M, et al. Dominance of serotype Ia among group B streptococci causing invasive infections in nonpregnant adults in Portugal[J]. J Clin Microbiol, 2012, 50(4): 1219-1227.
Kardos S, Tóthpál A, Laub K, et al. High prevalence of group B Streptococcus ST17 hypervirulent clone among non-pregnant patients from a Hungarian venereology clinic[J]. BMC Infect Dis, 2019, 28, 19(1): 1009.
Raabe V N, Shane A L. Group B Streptococcus (Streptococcus agalactiae)[J]. Microbiol Spectr, 2019, 7(2): 10.1128.
Tsai M H, Hsu J F, Lai M Y, et al. Molecular characteristics and antimicrobial resistance of group B Streptococcus strains causing invasive disease in neonates and adults[J]. Front Microbiol, 2019, 10: 264.
Wang P, Tong J, Ma X, et al. Serotypes, antibiotic susceptibilities, and multi-locus sequence type profile of Streptococcus agalactiae isolates circulating in Beijing, China[J]. PLoS One, 2015, 10(3): e0120035.
Flores A R, Galloway-Pe?a J, Sahasrabhojane P, et al. Sequence type 1 group B Streptococcus, an emerging cause of invasive disease in adults, evolves by small genetic changes[J]. Proc Natl Acad Sci USA, 2015, 112(20): 6431-6436.
Hall J, Adams N H, Bartlett L, et al. Maternal disease with group b Streptococcus and serotype distribution worldwide: Systematic review and meta-analyses[J]. Clin Infect Dis, 2017, 65(suppl_2): S112-S124.
Gajic I, Plainvert C, Kekic D, et al. Molecular epidemiology of invasive and non-invasive group B Streptococcus circulating in Serbia[J]. Int J Med Microbiol, 2019, 309(1): 19-25.
Wang X, Cao X, Li S, et al. Phenotypic and molecular characterization of Streptococcus agalactiae, colonized in Chinese pregnant women: Predominance of ST19/Ⅲ and ST17/Ⅲ[J]. Res Microbiol, 2018, 169(2): 101-107.
Cheng Z, Qu P, Ke P, et al. Antibiotic resistance and molecular epidemiological characteristics of Streptococcus agalactiae isolated from pregnant women in Guangzhou, South China[J]. Can J Infect Dis Med Microbiol, 2020, 2020: 1368942.
作者簡介:陈星月,女,生于1998年,主要从事无乳链球菌分子流行病学研究。E-mail: chenxy9746@163.com

