秋播冬麦区矮秆基因 RhtB1b、 RhtD1b和 Rht8的分布频率及其与产量性状的关系
张 凯,兰素缺,金京京,张颖君,彭晓慧,李杏普,张业伦
(河北省农林科学院粮油作物研究所/河北省作物遗传育种实验室,河北石家庄 050035)
利用矮秆基因调节株高是培育高产小麦品种的重要途径[1],同时,矮秆基因还可以提高小麦的抗倒伏能力、抗旱性和产量[2-3]。小麦矮秆基因大致分为三类:D-草丛型矮生基因、Us -单茎矮生基因和Rht基因[4]。目前,已被发掘并命名的矮秆基因有24个。其中,被广泛应用的矮秆基因主要是来自农林10号和赤小麦的Rht1(Rht-B1b)、Rht2(Rht-D1b)和Rht8、Rht9[5-7]。Rht-B1b、Rht-D1b和Rht8基因分别位于4BS、4DS和2DL染色体上[8]。Rht-B1b和Rht-D1b基因编码的DELLA蛋白,主要抑制植物对赤霉素(GA)的响应,但该蛋白并不结合GA受体蛋白,因此对赤霉素表现为不敏感[9]。Rht8是赤霉素敏感基因,通过调节赤霉素合成相关基因的表达,影响不同活性GA的含量比例,从而降低株高[10]。 Ellis等[11]研究表明,Rht-B1b和Rht-D1b是中等强度降秆基因,两个基因同时存在时,存在较强的累加效应,降秆效应可达40%以上,这两个基因的降秆效应均强于Rht8基因。
矮秆基因的定位与克隆为分子标记的开发奠定了基础。Peng等[9]利用同源克隆的方法获得小麦矮秆基因Rht-B1a和Rht-D1a。在此基础上,Ellis等[11]开发了STS标记BF/MR1、BF/WR1、DF1/MR2和DF2/WR2,分别用于检测矮秆基因Rht-B1b、Rht-B1a、Rht-D1b和Rht-D1a。为了提高检测效率,Rasheed等[12]和Wu等[13]分别开发了KASP和STARP标记,用于检测Rht-B1a和Rht-D1a基因型。Korzun等[14]和Debora等[10]分别开发了Rht8基因连锁的微卫星标记Xgwm261和侧翼标记DG279、DG371,可用于检测Rht8基因。熊宏春等[15]将Rht8基因精细定位于分子标记 INDEL-2005 和 SSR-2650 之间,并开发了分子标记CAPS-Rht8。分子标记的开发为分子标记辅助选择育种以及矮秆基因的高效应用提供了便利的检测方法。
目前,中国北部冬麦区大部分小麦品种株高为75~80 cm,南部冬麦区为85~95 cm,已接近最适株高[16]。然而,矮秆基因在不同麦区分布多样化且无规律性,不同麦区间生态环境和栽培条件也差异较大,小麦品种的矮秆基因类型及产量性状结构特点也不明确,给育种亲本选配和矮秆基因的高效利用造成困扰。因此,本研究利用STS分子标记BF/MR1、BF/WR1、DF1/MR2和DF2/WR2以及微卫星标记Xgwm261,对不同生态区近十年来育成的237份秋播冬小麦品种进行Rht-B1b、Rht-D1b和Rht8基因检测,并分析三个基因的分布情况以及与株高和产量相关性状的关系,以期为育种亲本选配提供参考依据。
1 材料与方法
1.1 试验材料
供试材料共237份,其中黄淮冬麦区121份、北部冬麦区57份、西南冬麦区41份、长江中下游冬麦区17份、新疆冬春麦区1份,大部分为2010年后育成的品种。分别于2019-2020和2020-2021年度在河北省农林科学院粮油作物研究所堤上试验站,按照随机区组设计,每份材料种植5行,每行4 m,株距5 cm,行距25 cm。
1.2 基因组DNA的提取
每份材料选取两粒具有代表性的种子,用钢珠打碎后,参照TPS法[17]提取基因组DNA。用核酸定量仪(Nano Drop 2000)检测DNA浓度,将DNA原液稀释至100 ng·μL-1后,保存于 -20 ℃备用。
1.3 矮秆基因的分子标记检测
利用Ellis 等[11]设计的四对STS分子标记BF/MR1、BF/WR1、DF1/MR2和DF2/WR2检测Rht-B1和Rht-D1基因(表1),其中BF/MR1与BF/WR1为一对互补引物,分别用于检测Rht-B1b和Rht-B1a;DF1/MR2与DF2/WR2也为一对互补引物,分别用于检测Rht-D1b和Rht-D1a,以石4185(含有Rht-B1b基因)和郑麦7698(含有Rht-D1b基因)为阳性对照。用Korzun等[10]设计的微卫星标记Xgwm261检测Rht8基因,以石4185为阳性对照。PCR反应体系均为10 μL,包括模板DNA 2 μL,2×SanTaq PCR Mix 预混液5 μL,上、下游引物(浓度为0.025 nmol·μL-1)各0.3 μL,用灭菌双蒸水补至 10 μL。PCR反应程序:94 ℃预变性5 min;94 ℃变性30 s,55~63 ℃退火30 s,72 ℃延伸30 s,35个循环;72 ℃延伸5 min,4 ℃保存。Rht-B1和Rht-D1的PCR扩增产物用1.5%的琼脂糖凝胶(含Gold View染料)进行检测,在凝胶成像仪下观察并拍照记录。Rht8基因的PCR扩增产物用8%的非变性聚丙烯酰胺凝胶进行检测,银染显色,拍照记录。

表1 本研究所用的分子标记信息
1.4 小麦株高和产量性状调查
于2020和2021年小麦灌浆中后期,每份材料选取10个单株测量株高,同时随机调查10个麦穗的穗长。于2020和2021年小麦成熟期,用万深SC-G自动考种仪统计千粒重、粒长和粒宽;人工调查单位面积穗数,收获后称重测产;随机选取10个麦穗,调查穗粒数。所有测量指标均取2年的平均值作为最终调查结果。
2 结果与分析
2.1 Rht-B1b、 Rht-D1b和 Rht8基因的分子标记检测结果及其分布频率
检测结果表明,发现237份供试材料中,仅含Rht-B1b(突变型)的材料有17份,占比7.2%;含Rht-B1b并同时含其他矮秆基因的材料有22份,占比9.3%(图1和表2);仅含Rht-D1b(突变型)的材料有63份,占比26.6%;含Rht-D1b并同时含其他矮秆基因的材料有50份,占比21.1%(图2和表2);仅含Rht8的材料有39份,含Rht8并同时含其他矮秆基因的材料有65份,分别占 16.5%和27.4%(图3和表2)。

M:DL1200;a: Rht-B1a;b: Rht-B1b;1:冀麦449;2:农大5695;3:济麦32;4:荣华901;5:石4185(CK)。
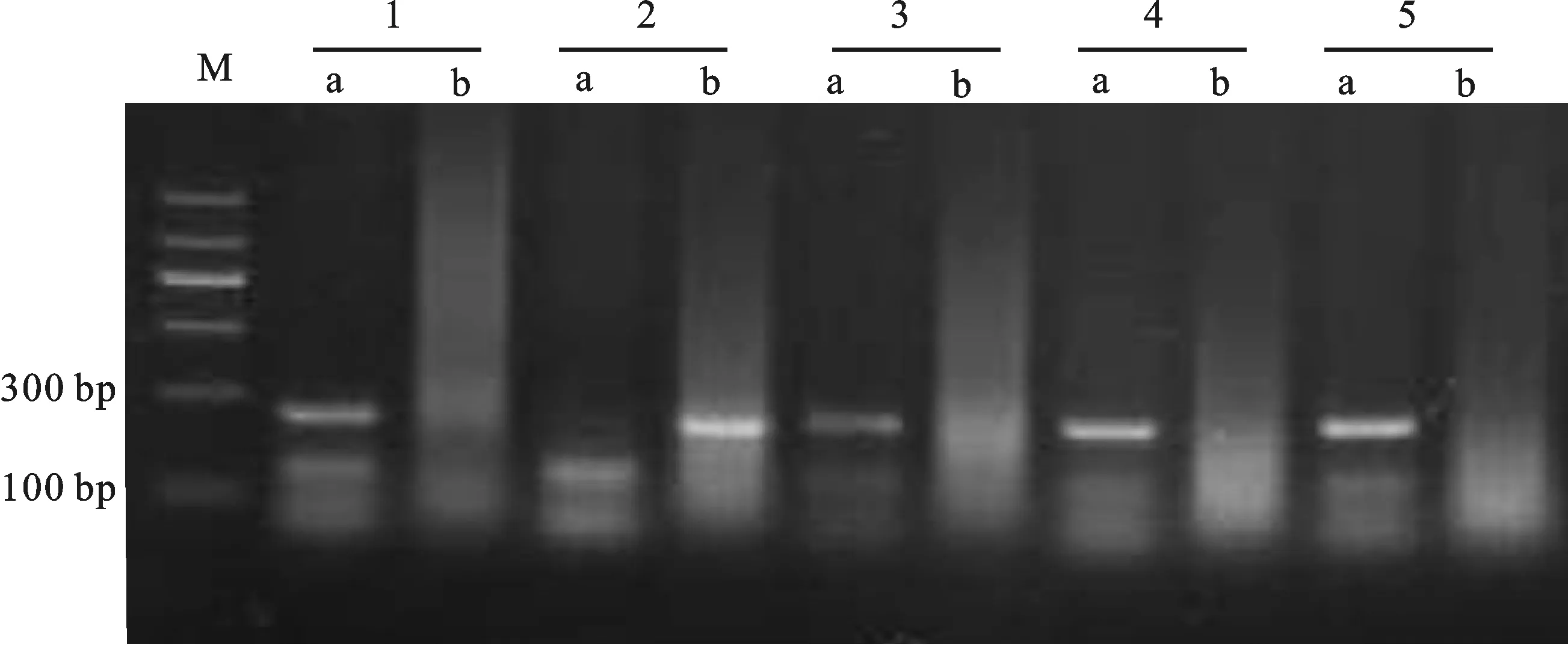
M:DL1200;a: Rht-D1a;b: Rht-D1b;1:新麦36;2:郑麦7698(CK);3:洛麦27;4:蜀麦1628;5:华1168。
从矮秆基因在不同冬麦区的分布频率来看,Rht-B1b在西南冬麦区的分布频率最高,其次是在北部冬麦区和长江中下游冬麦区,在黄淮冬麦区分布频率最低;Rht-D1b在长江中下游冬麦区的分布频率最高,其次是在黄淮冬麦区和北部冬麦区,在西南冬麦区分布频率最低;Rht8在各冬麦区均有分布,在长江中下游冬麦区分布频率最高,其次是在北部冬麦区和黄淮冬麦区,西南冬麦区分布频率最低(表2和表3)。
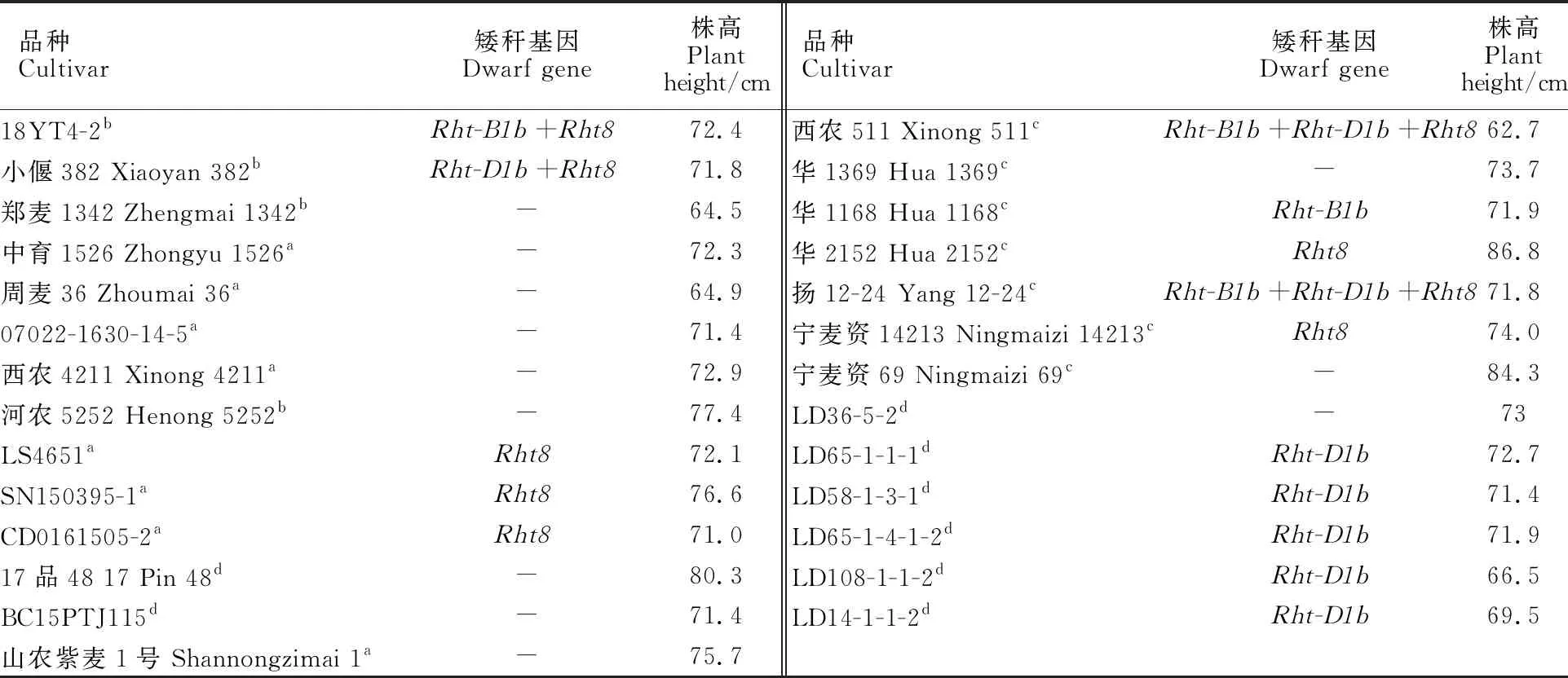
(续表2 Continued table 2)
矮秆基因及其组合在所有麦区(由于新疆冬春麦区只有1份小麦材料,未进行统计)的分布频率由高到低依次为Rht-D1b(26.7%);Rht-D1b+Rht8(18.2%);Rht8(16.5%);Rht-B1b(7.2%);Rht-B1b+Rht8(6.8%);Rht-B1b+Rht-D1b+Rht8(2.1%);Rht-B1b+Rht-D1b(0.4%)。Rht-B1b在西南冬麦区的分布频率最高,为 24.4%;Rht-D1b在黄淮冬麦区的分布频率最高,为32.2%;Rht8在各麦区分布频率相当,在14.9%~19.5%之间;Rht-B1b+Rht8在北部冬麦区分布频率最高,为12.3%;Rht-B1b+Rht-D1b仅在黄淮冬麦区有分布,在其他麦区未检测到该聚合类型。Rht-D1b+Rht8在长江中下游冬麦区和黄淮冬麦区分布频率较高,分别为 23.5%和 22.3%;Rht-B1b+Rht-D1b+Rht8在长江中下游冬麦区分布频率最高,为5.9%,在西南冬麦区未检测到该聚合类型。此外,供试材料中有22.0%的材料均未检测到Rht-B1b、Rht-D1b和Rht8,西南麦区的分布频率最高,达 31.7%(表3)。
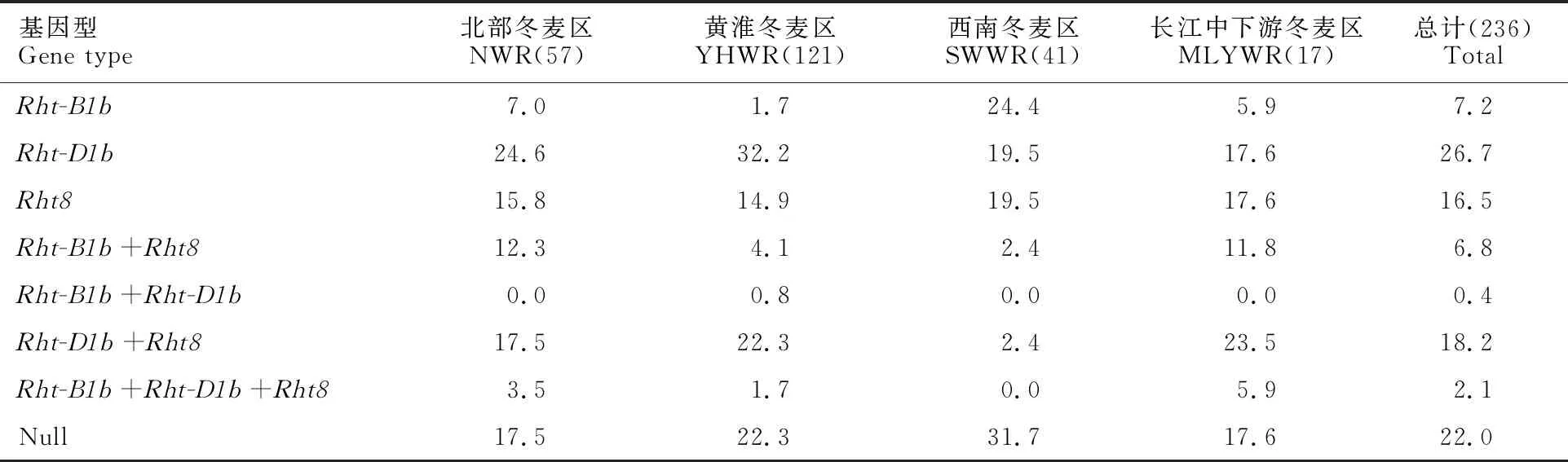
表3 矮秆基因 Rht-B1b、 Rht-D1b和 Rht8及其组合在不同麦区的分布频率
2.2 Rht-B1b、 Rht-D1b和 Rht8与株高及产量性状的相关性
不含目标基因的小麦株高最高,与Rht-D1b+Rht8和Rht-B1b+Rht-D1b+Rht8基因型小麦差异显著;Rht-B1b+Rht-D1b+Rht8基因型小麦的株高最低,与Rht-B1b+Rht8和Rht-D1b+Rht8基因型小麦差异不显著。不同矮秆基因型的降秆效果表现为Rht-B1b+Rht-D1b+Rht8;Rht-D1b+Rht8;Rht-B1b+Rht8;Rht-D1b;Rht-B1b;Rht8(表4和表5)。Rht-D1b+Rht8基因型小麦的穗长最短,与其他基因型以及不含目标基因的小麦差异显著。Rht-B1b+Rht-D1b+Rht8基因型小麦的粒宽最大,显著大于Rht-B1b、Rht-B1b+Rht8基因型以及不含目标基因的小麦。Rht-B1b+(Rht-D1b+)Rht8基因型小麦的千粒重最大,显著高于Rht-B1b、Rht-B1b+Rht8基因型小麦。所有基因型及不含目标基因的小麦的粒长和穗粒数均无显著差异(表4)。由于Rht-B1b+Rht-(D1b+Rht8)种质只有5份,结果还需进一步验证。
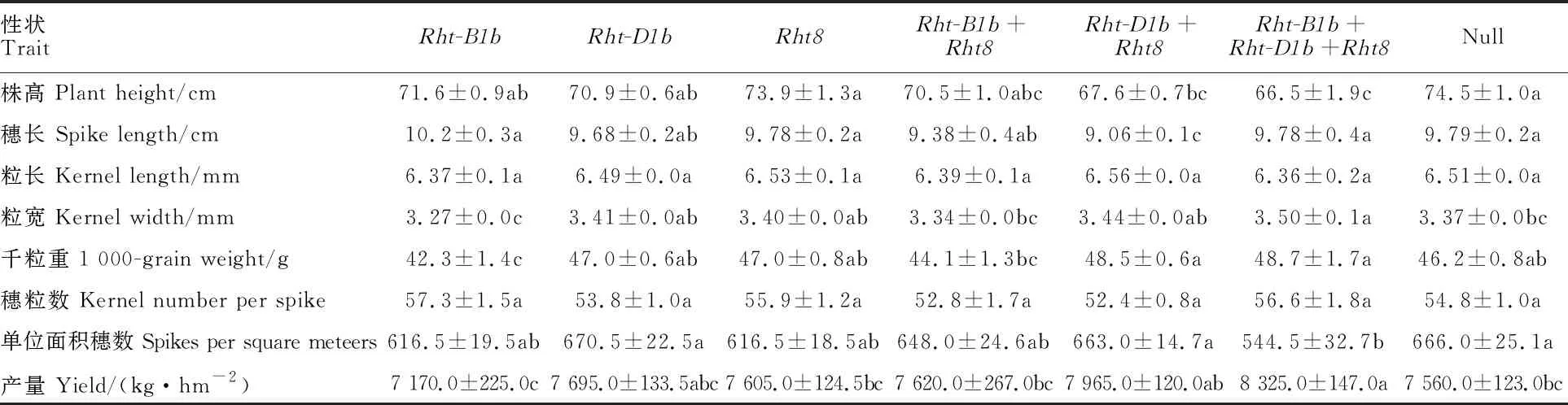
表4 Rht-B1b、 Rht-D1b和 Rht8及其组合对株高及产量相关性状的影响
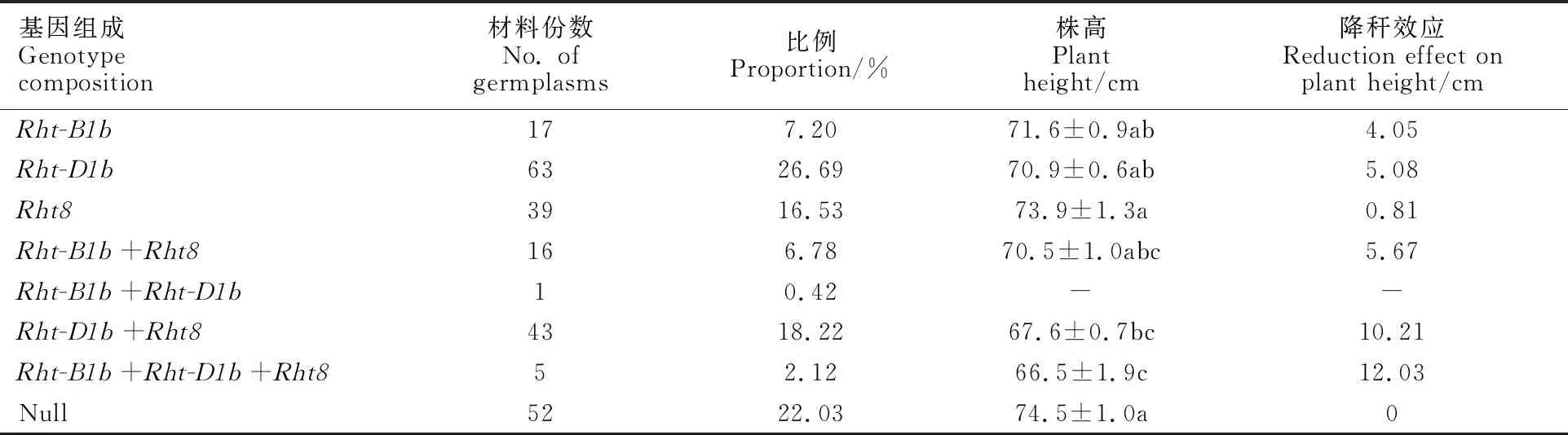
表5 矮秆基因 Rht-B1b、 Rht-D1b和 Rht8 及其组合的降秆效应
3 讨 论
3.1 矮秆基因的分布频率
本研究供试237份材料中,含有Rht-D1b、Rht-B1b和Rht8基因的材料占所有供试材料的 78.0%,可见,Rht-D1b、Rht-B1b和Rht8虽占据中国冬小麦矮秆基因的主导地位,但仍有一些其他矮秆基因在生产中得到一定规模应用。在本研究矮秆基因不明确的材料中,多数植株株高低于75 cm,属于矮秆种质,说明含有其他矮秆基因。陈向东等[18]发现117份国内推广小麦品种及中间种质中,矮秆基因的分布频率为27.4%。周晓变[19]发现黄淮麦区主栽品种、历史品种和农家种中,Rht4、Rht9和Rht12基因的分布频率分别为 66.7%、40.7%和34.6%。可见,在中国主要冬麦区中,除了Rht-B1b、Rht-D1b和Rht8外, 其他矮秆基因分布也较为广泛。
本研究中Rht-D1b和Rht8基因的分布频率分别为47.9%和44.1%,而Rht-B1b的分布频率仅为16.5%,说明Rht-D1b和Rht8应用更广泛。杨松杰[4]和周 阳等[20]研究表明,Rht-D1b和Rht8基因在中国小麦的分布频率分别为47.5%和 43.9%,与本研究研究结果基本一致。
3.2 不同麦区矮秆基因型的分布及其与产量性状的关系
不同麦区间矮秆基因型的分布频率存在明显的差异。黄淮冬麦区主要以Rht-D1b(32.2%)、Rht8(14.9%)和Rht-D1b+Rht8(22.3%)为主。可见,黄淮冬麦区更偏好使用Rht-D1b,其次是Rht8。周 阳等[21]和杨松杰[4]也发现该麦区Rht-D1b的分布频率高。曹廷杰等[21]和慕美财等[22]认为,这是由于Rht-D1b在黄淮冬麦区的小麦种质中已被固定所致。北部冬麦区矮秆基因型主要以Rht-D1b(24.6%)、Rht8(15.8%)和Rht-D1b+Rht8(17.5%)为主,西南冬麦区主要以Rht-B1b(24.4%)、Rht-D1b(19.5%)和Rht8(19.5%)为主,长江中下游冬麦区主要以Rht-D1b(17.6%)、Rht8(17.6%)和Rht-D1b+Rht8(23.5%)为主。其中,西南冬麦区是所有麦区中种植密度最低的生态区,植株个体发育健壮不易倒伏,不需要聚合多个矮秆基因降低株高来规避倒伏风险,并且以此来获得更高生物量和产量。此外,Rht-B1b基因在西南冬麦区的分布频率明显高于其他麦区,且具有比其他基因型更高的穗粒数和较低的单位面积穗数,这也正是西南冬麦区小麦群体的产量结构特征。说明矮秆基因在不同生态区的分布与矮源产量结构特征和生态环境适应性有关。
本课题组研究也发现,黄淮冬麦区、西南冬麦区和长江中下游冬麦区矮秆基因Rht-B1b、Rht-D1b和Rht8野生型与突变型之间的产量因子差异均不显著(数据未提供),表明不同矮秆基因与产量因子间并不存在相关性。显著性分析发现,黄淮冬麦区单位面积穗数最高,北部冬麦区和长江中下游冬麦区千粒重较高,而这三个麦区Rht-D1b基因的分布频率分别为57.0%、45.6%和47.0%,Rht8基因的分布频率分布为43.0%、54.4%和58.8%;西南冬麦区的穗粒数最高,Rht-B1b基因的在该麦区的分布频率为26.8%。可见,小麦植株具有所在生态区的产量结构特征,与矮秆基因本身无关。因此,各生态区矮秆基因的使用偏好性可能与矮秆基因被固定的先后顺序有关,越早在某个生态区被固定的矮秆基因,其携带者越早具有该生态区的产量结构特征,故被利用的机率和分布频率也就越高,从而造成矮秆基因与产量性状关联的遗传假象。
3.3 Rht-B1b、 Rht-B1b和 Rht8及其组合对株高的影响
不同矮秆基因型的降秆效果从强到弱依次为:Rht-B1b+Rht-D1b+Rht8;Rht-D1b+Rht8;Rht-B1b+Rht8;Rht-D1b;Rht-B1b;Rht8。这与Tang 等[23]和冯 洁等[24]的研究结果一致。但Rht-B1b、Rht-B1b和Rht8单独应用时,降秆效果不显著。Rht8只有与Rht-D1b聚合(Rht-D1b+Rht8和Rht-B1b+Rht-D1b+Rht8)株高才显著降低,而与Rht-B1b聚合时差异不显著。同时,三个矮秆基因聚合类型(Rht-B1b+Rht-D1b+Rht8)的株高显著低于仅含单个基因的株高,表明不同矮秆基因聚合时,降秆效果存在累加效应,并且Rht-D1b的降秆效果优于Rht-B1b,这与Sheoran等[25]和Robbins等[26]的研究结果基本一致。
总之,Rht-B1b、Rht-D1b和Rht8是中国小麦矮秆基因的主要类型。虽然Rht-D1b和Rht8基因型小麦总体上具有较高的千粒重和单位面积穗数,Rht-B1b基因型小麦具有较高的穗粒数,但矮秆基因本身与产量因子间无显著相关性。矮秆基因聚合时降秆效果存在累加效应,且Rht-D1b的降秆效果优于Rht-B1b。

