含淀粉/糊精的香菇制品中粗多糖含量测定
薄晓菲,朱新成,孙伟,李正纪,李晓灵
河南省香菇加工工程技术研究中心,仲景食品股份有限公司(南阳 474500)
多糖是存在于自然界的醛糖或酮糖通过糖苷连接在一起的聚合物,是一切有生命的有机体必不可少的成分,参与了生命现象中细胞的各种活动,具有多种多样的生物学功能[1]。
香菇多糖(Lentinan,简称LNT)是从优质香菇子实体中提取的有效活性成分,是香菇的主要有效成分,是一种宿主免疫增强剂[2]。临床与药理研究表明,香菇多糖具有抗病毒、抗肿瘤、调节免疫功能和刺激干扰素形成等作用[1]。香菇及其制品中因其含有一定量的香菇多糖,因而备受市场青睐。
中华人民共和国农业部于2008年8月28日发布NY/T 1676《食用菌中粗多糖含量的测定》[4],规范了食用菌及其制品中食用菌粗多糖的检测方法。标准明示不适于添加淀粉、糊精的食用菌产品,以及食用菌液体发酵或固体发酵产品。
目前,粗多糖的测定方法主要是碱性酒石酸铜滴定法和比色法(苯酚-硫酸法、蒽酮-硫酸法)两种[5-6]。一般来说,比色法优点是灵敏度高、样品用量少;缺点是做常规测定时用葡萄糖作为对照品,误差较大。其中,苯酚-硫酸分光法是粗多糖测定最常用的方法,该方法的原理是多糖经乙醇沉淀分离后,去除其他可溶性糖及杂质的干扰,在浓硫酸作用下,先水解成单糖,并迅速脱水生成糖醛(糠醛)衍生物,与苯酚反应生成橙黄色溶液,在490 nm处有特征吸收,其呈色强度与溶液中糖的浓度呈正比,与标准系列比较定量[7-8]。
由于加工工艺及配方设计的需求,市面在售的食用菌制品,多含有淀粉、糊精等组分。这类食用菌制品中食用菌粗多糖的检测无法遵照NY/T 1676《食用菌中粗多糖含量的测定》实施,亟需研究建立含淀粉、糊精的食用菌制品中粗多糖含量的检测方法,有效填补空白,满足需求。
1 试验部分
1.1 材料与试剂
香菇制品(仲景食品股份有限公司);α-淀粉酶(AAL型)、淀粉葡萄糖苷酶(GAL型),宁夏夏盛实业集团有限公司;葡萄糖(使用前应于105 ℃恒温烘干至恒重,成都普思生物科技股份有限公司);磷酸盐缓冲溶液(0.1 nmol/L,pH 6.8,麦克林生物科技有限公司);硫酸、无水乙醇、苯酚(重蒸馏),国药集团化学试剂有限公司;蒸馏水,实验室制备。
80%苯酚溶液:称取80 g苯酚于100 mL烧杯中,加水溶解,定容至100 mL后转至棕色瓶中,置4 ℃冰箱中避光贮存。
5%苯酚:吸取5 mL苯酚溶液,溶于75 mL水中,混匀,现用现配。
100 mg/L标准葡萄糖溶液:称取0.100 0 g葡萄糖于100 mL烧杯中,加水溶解,定容至1 000 mL,置4 ℃冰箱中贮存。
1.2 仪器与设备
UV1800紫外可见分光光度计(日本岛津公司);ME104E电子天平[梅特勒-托利多仪器(上海)有限公司];SC-3610低速离心机(安徽中科中佳科学仪器有限公司);HH-4数显恒温水浴锅(上海力辰邦西仪器科技有限公司);MixMax漩涡混匀器(合肥艾本森科学仪器有限公司)。
1.3 方法
1.3.1 样品处理
称取1 g样品加蒸馏水溶解(稀释)至3 mL,加入4倍体积无水乙醇(边加边搅拌),然后按4 000 r/min离心10 min,弃去上清液,得到沉淀,将沉淀用乙醇溶液冲洗3次,按4 000 r/min离心10 min,弃去上清液,置70 ℃的恒温水浴锅上加热20 min,除去残余的乙醇,将得到的沉淀加少量蒸馏水溶解,定容至100 mL,此溶液为样品溶液。
1.3.2 样品中粗多糖提取工艺流程
工艺流程:样品溶液→α-淀粉酶处理→淀粉葡萄糖苷酶处理→乙醇沉淀,得到粗多糖。
取2 mL 1.3.1小节的样品溶液于具塞试管中,加入α-淀粉酶溶液,恒温酶解,反应结束后于100 ℃沸水中灭酶,然后加入1 mL淀粉葡萄糖苷酶,恒温酶解,反应结束后于100 ℃沸水中灭酶,加入10~50 mL无水乙醇(边加边搅拌),按4 000 r/min离心10 min,弃去上清液,置70 ℃的恒温水浴锅上加热20 min,除去残余的乙醇,制得粗多糖。
1.3.3 粗多糖含量测定
参照NY/T 1676《食用菌中粗多糖含量的测定》进行。
1.3.3.1 葡萄糖标准曲线绘制
分别吸取0,0.2,0.4,0.6,0.8和1.0 mL的标准葡萄糖工作溶液置25 mL具塞玻璃试管中,用蒸馏水补至1.0 mL。向试液中加入1.0 mL苯酚溶液,然后快速加入5.0 mL硫酸(与液面垂直加入,勿接触试管壁,以便与反应液充分混合),静置10 min。使用漩涡混匀器使反应液充分混合,然后将试管放置于30 ℃水浴中反应20 min,490 nm波长处测吸光度。以葡萄糖质量浓度为横坐标、吸光度为纵坐标,制定标准曲线。
1.3.3.2 样品粗多糖含量测定
将1.3.2小节所得粗多糖溶解,制得试液。向试液中加入1.0 mL苯酚溶液,然后快速加入5.0 mL硫酸(与液面垂直加入,勿接触试管壁,以便与反应液充分混合),静置10 min。使用漩涡混匀器使反应液充分混合,然后将试管放置于30 ℃水浴中反应20 min,于490 nm波长处测吸光度,同时做空白试验。根据葡萄糖含量的标准曲线,按式(1)计算粗多糖含量。样品中多糖含量以质量分数w计(单位g/100 g)。
式中:c1为从标准曲线上述查得样品酶解后测定液中含糖量,μg;V1为样品定容体积,mL;m为样品重量,g;V2为酶解时移取样品测定液的体积,mL;0.9为葡萄糖换算为葡聚糖的校正系数。
1.3.4α-淀粉酶酶解单因素试验
在其他条件相同的条件下,以粗多糖含量为指标,分别研究酶用量(0.08,0.12,0.16,0.20,0.24和0.28 U/mL,即加酶量为1%,1.5%,2%,2.5%,3%和3.5%)、酶解温度(40,50,60,70,80和90 ℃)、酶解时间(15,20,25,30,35和40 min)3个单因素对样品中粗多糖提取效果的影响。
1.3.5α-淀粉酶酶解正交试验
在单因素试验基础上,以粗多糖含量为考察指标,用正交试验L9(33)优化α-淀粉酶酶解工艺,设置因素水平如表1所示。
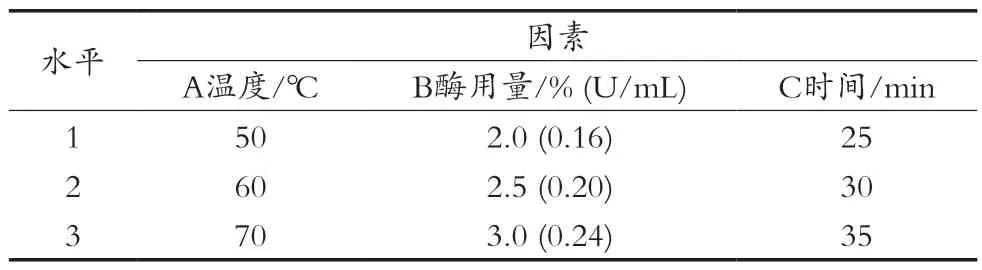
表1 正交试验因素与水平
1.3.6 淀粉葡萄糖苷酶酶解单因素试验
称取50 mg多糖样品,用蒸馏水定容至100 mL。取8 mL样品溶液,加入2 mL浓度为0.2 U/mL的α-淀粉酶,温度60 ℃,酶解35 min后于100 ℃沸水中灭活10 min,冷却至常温后在其他条件相同的条件下,以粗多糖含量为指标,分别研究淀粉葡萄糖苷酶用量(10,20,30,40,50和60 U/mL)、酶解温度(40,50,60,70,80和90 ℃)、酶解时间(20,30,40,50,60和70 min)3个单因素对样品中粗多糖提取效果的影响。
1.3.7 淀粉葡萄糖苷酶酶解正交试验
在单因素试验基础上,以粗多糖含量为考察指标,用正交试验L9(33)优化淀粉葡萄糖苷酶酶解工艺,设置因素水平如表2所示。

表2 正交试验因素与水平
1.4 正交试验
根据单因素试验的结果,进行正交试验,以粗多糖含量来确定最佳条件组合。
2 结果与讨论
2.1 标准曲线的绘制
以葡萄糖为标准,所得回归方程:y=0.011 5x+ 0.003 2,R2=0.999,结果表明:在0~102.38 μg/mL范围内,浓度与吸光度呈良好的线性关系,可信度较高。标准曲线见图1。
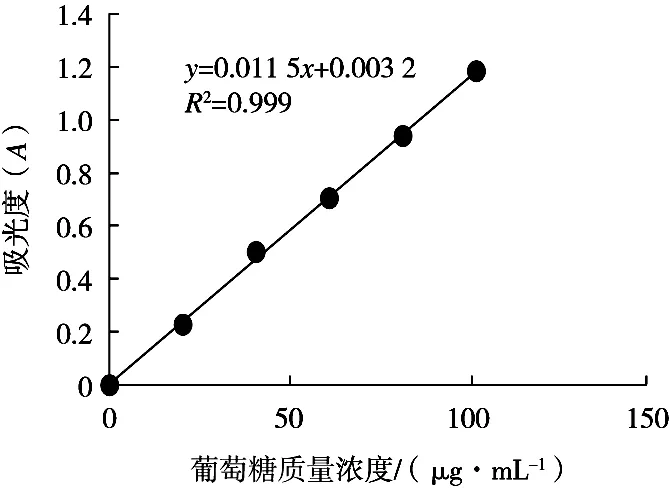
图1 葡萄糖标准曲线
2.2 α-淀粉酶酶解单因素试验结果
2.2.1α-淀粉酶用量对试液吸光度的影响
称取50 mg多糖样品,用蒸馏水定容至100 mL。取8 mL样品溶液,控制酶解温度60 ℃,时间35 min,研究加入2 mL不同浓度α-淀粉酶酶解后试液的吸光度变化,结果如图2所示。
数据显示,随着酶量的增加,试液的吸光度呈现上升,在达到峰值后缓慢下降的趋势。尤其是在酶量为2.5%(0.2 U/mL)时,吸光度达到最高。
2.2.2α-淀粉酶酶解温度对试液吸光度的影响
称取50 mg多糖样品,用蒸馏水定容至100 mL。取8 mL样品溶液,在加入2 mL浓度为0.2 U/mL的α-淀粉酶,控制酶解时间35 min,研究不同温度酶解后试液的吸光度变化,结果如图3所示。
数据显示,酶解温度为50~70 ℃时,吸光度较佳,尤其是在酶解温度为70 ℃时,吸光度达到最高,随之吸光度迅速降低。
2.2.3α-淀粉酶酶解时间对试液吸光度的影响
称取50 mg多糖样品,用蒸馏水定容至100 mL。取8 mL样品溶液,在加入2 mL浓度为0.2 U/mL的α-淀粉酶,酶解温度为70 ℃,研究不同酶解时间后试液的吸光度变化,结果如图4所示。
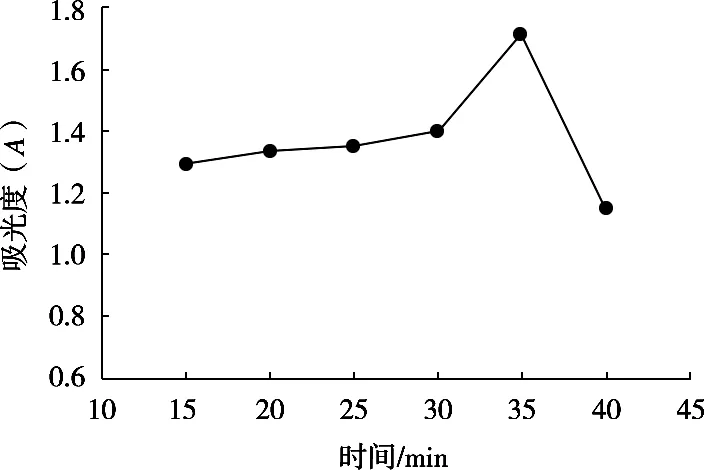
图4 酶解时间对试液吸光度的影响
数据显示,酶解时间为25~35 min时,吸光度较佳,尤其是在酶解时间为35 min时,吸光度达到最高,随之吸光度迅速降低。
2.3 α-淀粉酶酶解正交试验结果
α-淀粉酶酶解正交试验结果见表3和表4。由直观分析及方差分析结果可以看出:RC>RA>RB,即酶解时间对样品中粗多糖含量测定影响最大,其次是酶解温度和α-淀粉酶用量。方差分析结果显示A、B、C三因素对试验结果影响均不显著,所以由直观分析得出最优条件为A1B1C2,即α-淀粉酶酶解温度50 ℃、酶量2.0%(0.16 U/mL)、酶解时间30 min。

表3 α-淀粉酶酶解L9(33)正交试验结果
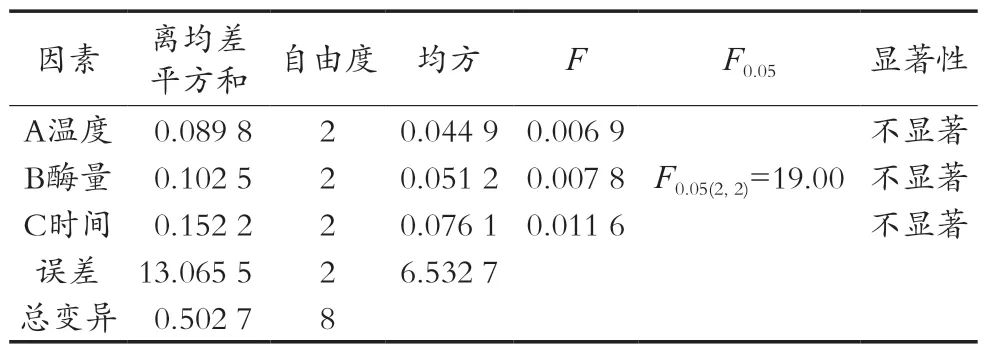
表4 α-淀粉酶酶解L9(33)正交试验方差分析
2.4 淀粉葡萄糖苷酶酶解单因素试验结果
2.4.1 淀粉葡萄糖苷酶用量对试液吸光度的影响
称取50 mg多糖样品,用蒸馏水定容至100 mL。取8 mL样品溶液,加入2 mL浓度为0.2 U/mL的α-淀粉酶,温度60 ℃,酶解35 min后于100 ℃沸水中灭活10 min,冷却至常温后控制酶解温度50 ℃,时间40 min,研究加入1 mL不同浓度淀粉葡萄糖苷酶酶解后试液的吸光度变化,结果如图5所示。
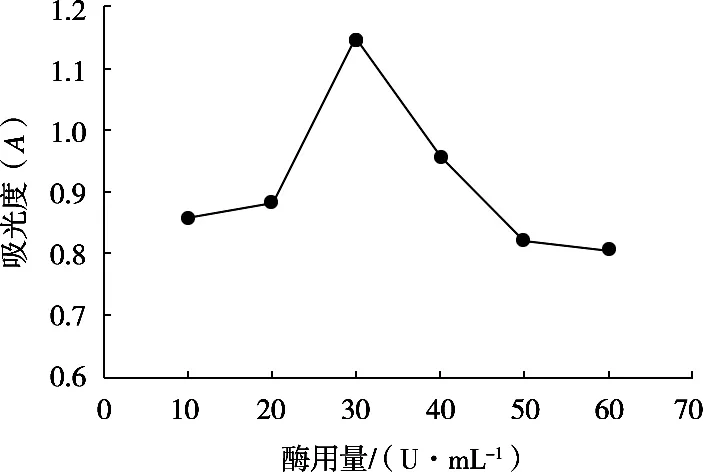
图5 淀粉葡萄糖苷酶用量对试液吸光度的影响
结果显示,在酶量为30 U/mL时,吸光度达到最高,且再添加酶量效果略下降。
2.4.2 淀粉葡萄糖苷酶酶解温度对试液吸光度的影响
称取50 mg多糖样品,用蒸馏水定容至100 mL。取8 mL样品溶液,加入2 mL浓度为0.2 U/mL的α-淀粉酶,温度60 ℃,酶解35 min后于100 ℃沸水中灭活10 min,冷却至常温,加入1 mL浓度为30 U/mL的淀粉葡萄糖苷酶酶解时间40 min,研究不同酶解温度条件下试液吸光度变化,结果如图6所示。数据显示,酶解温度为60 ℃时,试液吸光度达到最高,随之吸光度迅速降低。
2.4.3 淀粉葡萄糖苷酶酶解时间对试液吸光度的影响
称取50 mg多糖样品,用蒸馏水定容至100 mL。取8 mL样品溶液,加入2 mL浓度为0.2 U/mL的α-淀粉酶,温度60 ℃,酶解35 min后于100 ℃沸水中灭活10 min,冷却至常温后加入1 mL浓度为30 U/mL的淀粉葡萄糖苷酶在60 ℃下酶解,研究不同酶解时间条件下试液的吸光度变化,结果如图7所示。数据显示,酶解时间40 min时,吸光度达到最高,随之吸光度迅速降低。
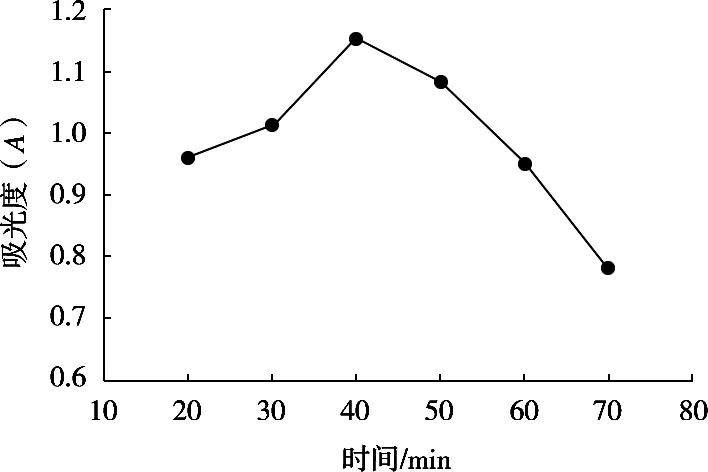
图7 酶解时间对试液吸光度的影响
2.5 淀粉葡萄糖苷酶酶解正交试验结果
淀粉葡萄糖苷酶酶解正交试验结果见表5和表6。由直观分析及方差分析结果可以看出:RC>RA>RB,即酶解时间对样品中粗多糖含量测定影响最大,其次是酶解温度和淀粉葡萄糖苷酶用量。方差分析结果显示A、B、C三因素对试验结果影响均不显著,所以由直观分析得出最优条件为A2B3C1,即淀粉葡萄糖苷酶酶解温度60 ℃、酶量40 U/mL、酶解时间30 min。
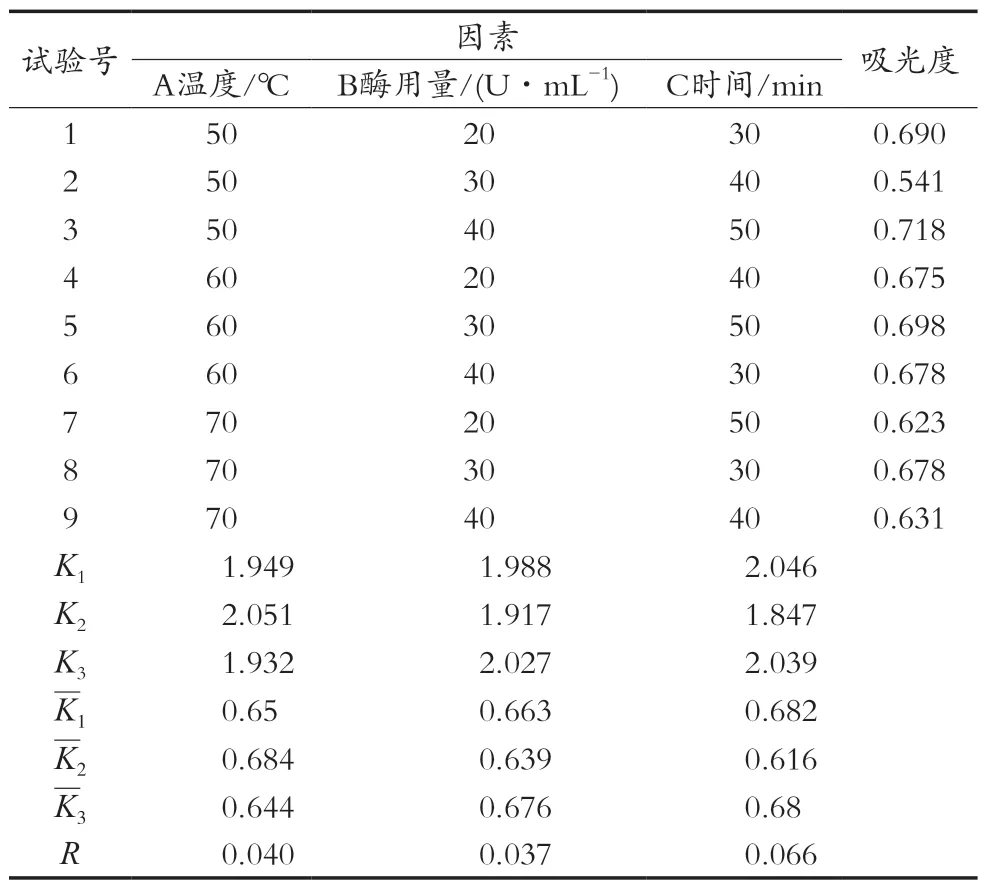
表5 淀粉葡萄糖苷酶L9(33)正交试验结果
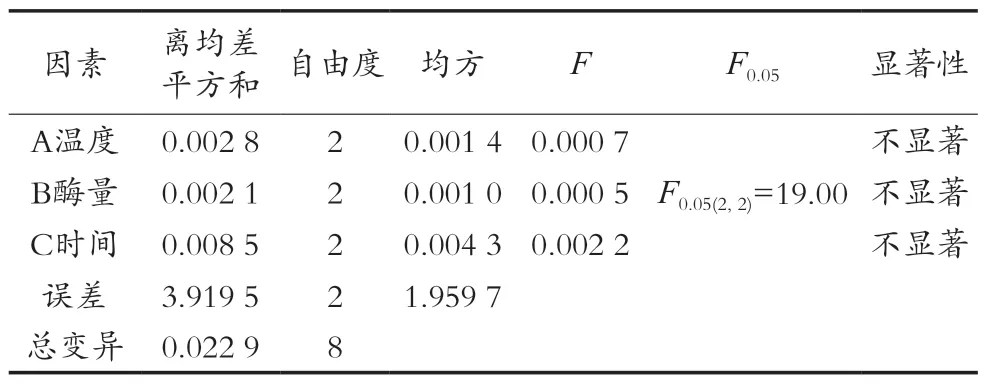
表6 淀粉葡萄糖苷酶L9(33)正交试验方差分析
2.6 精密度试验结果
分别称取样品6份,每份称取1 g样品,按照供试品溶液的制备方法,测定吸光度,结果见表7。吸光度的SRSD小于3%,精密度好。
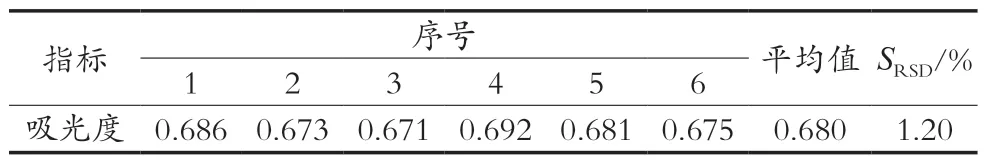
表7 精密度试验
3 结论
试验研究了含淀粉/糊精的香菇制品中粗多糖含量测定方法,通过正交试验得到粗多糖最优提取工艺参数。最优工艺参数:α-淀粉酶酶解温度50 ℃、酶量2.0%(0.16 U/mL)、酶解时间30 min;淀粉葡萄糖苷酶酶解温度60 ℃、酶量40 U/mL、酶解时间30 min。
在0~102.38 μg/mL范围内,葡萄糖浓度与吸光度呈良好的线性关系,线性回归方程:y=0.011 5x+ 0.003 2,R2=0.999,可信度较高。精密度试验表明[6次平行测定吸光度,SRSD=1.2%(<3%)]:检测方法精密度好。
研究建立的含淀粉/糊精的香菇制品中粗多糖含量测定方法是可行的。样品采用乙醇进行第一次沉淀,可将样品中的葡萄糖溶解去除,采用α-淀粉酶和淀粉葡萄糖苷酶将样品中添加的淀粉和糊精酶解成葡萄糖经乙醇二次沉淀去除,避免其对香菇制品中粗多糖检测的干扰,可满足含淀粉、糊精组分的香菇制品中粗多糖含量检测需求。

